
- •Модуль 1 атомно-молекулярне вчення. Класифікація неорганічних сполук
- •1.1. Основні поняття та закони хімії
- •1.1.1. Ключові положення атомно-молекулярного вчення
- •1.1.2. Поняття загальної хімії
- •1.1.3. Фізичні величини, що застосовуються в хімії
- •Моль – це кількість речовини, яка містить стільки часток – структурних елементів, скільки атомів міститься в ізотопі Карбону с12 масою 0,012 кг.
- •1.1.4. Основні закони хімії
- •М.В. Ломоносов
- •Ж. Пруст
- •Наприклад, у реакції
- •А. Авогадро
- •2) Фактор еквівалентності може дорівнювати 1 і бути меншим за 1.
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •1.2. Основні класи неорганічних сполук
- •1.2.1. Класифікація неорганічних сполук
- •1.2.2. Оксиди
- •1.2.3. Основи
- •1.2.4. Кислоти
- •1.2.6. Генетичний зв’язок між класами неорганічних сполук
- •Класами неорганічних сполук
- •Підсумки
- •Задачі для самостійного розв’язування
- •Модуль 2 будова речовини
- •2.1. Будова атома
- •2.1.1. Складність будови атома та її експериментальне доведення
- •2.1.2. Перші моделі атома
- •Е. Резерфорд
- •2.1.3. Атомні спектри
- •2.1.4. Квантова теорія світла
- •2.1.5. Основні положення теорії будови атома Бора
- •2.1.6. Хвильова природа електрона. Електронні хмари
- •2.1.7. Квантові числа
- •Орієнтація s-, p- I d-орбіталей
- •2.1.8. Принцип Паулі
- •2.1.9. Послідовність заповнення електронами енергетичних рівнів у багатоелектронних атомах
- •Підсумки
- •Д. І. Менделєєв
- •2.2.3. Періодичність властивостей хімічних елементів
- •Спорідненістю до електрона (f) називається енергетичний ефект процесу приєднання електрона до нейтрального атома е з перетворенням його на негативний іон е-:
- •Підсумки
- •2.3.1. Іонний зв’язок
- •2.3.2. Ковалентний зв’язок
- •І електронів у молекулі водню н:h
- •Підсумки
- •Задачі для самостійного Розв’язування
- •Модуль 3 Закономірності перебігу хімічних реакцій
- •3.1.Хімічна термодинаміка
- •3.1.1. Теплові ефекти. Внутрішня енергія та ентальпія
- •Термодинаміки
- •Г. І. Гесс
- •1. Тепловий ефект хімічної реакції дорівнює сумі теплових ефектів її проміжних стадій.
- •3. Тепловий ефект хімічної реакції дорівнює різниці між сумою теплот утворення продуктів реакції і сумою теплот утворення вихідних речовин з урахуванням числа молів цих речовин.
- •3.1.2. Напрямленість процесів. Ентропія. Ізобарно-ізотермічний потенціал
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •3.2. Хімічна кінетикА та рівновага
- •3.2.1. Предмет хімічної кінетики
- •3.2.2. Швидкість хімічних реакцій
- •Речовин під час перебігу реакції
- •Залежність швидкості реакції від концентрації реагуючих речовин закон діючих мас
- •3.2.4. Вплив температури на швидкість реакцій. Енергія активації
- •3.2.5. Каталіз
- •3.2.6. Хімічна рівновага
- •Оборотної реакції
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •Приклади розв’язування задач
- •V(t2)моль/лхв.
- •Задачі для самостійного розв’язування
- •Модуль 4 Розчини. Теорія електролітичної дисоціації
- •4.1. Основні поняття про розчини
- •4.1.1. Термінологія, що використовується в теорії розчинів
- •4.1.2. Концентрація розчинів та способи її вираження
- •4.1.3. Колігативні властивості розчинів. Осмос
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •4.2. Теорія електролітичної дисоціації
- •4.2.1. Теорія електролітичної дисоціації Арреніуса
- •4.2.2. Реакції в розчинах електролітів. Іонні рівняння
- •4.2.3.Константа електролітичної дисоціації
- •4.2.4. Властивості розчинів сильних електролітів
- •4.2.5. Добуток розчинності
- •4.2.6. Дисоціація води. Іонний добуток води. Водневий показник
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •4.3. Гідроліз
- •4.4. Окисно-відновні реакції
- •Практичні заняття приклади розв’язування задач (до розділу 4.14.2)
- •Задачі для самостійного розв’язування
- •Приклади розв’язування задач (до розділу 4.3)
- •4. Розрахувати рН середовища під час взаємодії з водою амоній ціаніду.
- •Задачі для самостійного розв’язування
- •Приклади розв’язування задач (до розділу 4.4)
- •2. Підібрати коефіцієнти у схемі окисно-відновної реакції
- •Задачі для самостійного розв’язування
- •Предметний покажчик
- •Список рекомендованої літератури
Треба вміти
1. Писати рівняння іонних реакцій у розчинах електролітів: повне молекулярне, повне іонне та скорочене іонне.
2. Здійснювати розрахунок рН середовища в розчинах, утворених слабкими та сильними електролітами.
3. Із застосуванням констант (Кд, ДР, S) розраховувати рівновагу в розчинах електролітів; створювати умови для випадіння осадів та запобігати цьому процесу.
Слід запам’ятати
1. Прості речовини, оксиди, а також нерозчинні речовини не дисоціюють.
2. Якщо малорозчинна речовина утворюється в результаті реакції, то в записі іонного рівняння її вважають нерозчинною.
3. Формули розрахунку:
ступеня дисоціації електроліту −
![]() ;
;
іонної сили розчину −
![]() ;
;
активності −
a=f C;
добутку розчинності −
![]() ;
;
іонного добутку води −
![]() ;
;
рН середовища −
![]() ,
,
або
![]() .
.
4.3. Гідроліз
Реакції обмінної взаємодії в розчинах дуже поширені й відбуваються не тільки між електролітами, а й між розчиненою речовиною та розчинником. Останні називаються реакціями гідролізу.
Гідроліз – це обмінна взаємодія речовин із водою, під час якої складові частини речовини сполучаються зі складовими частинами води.
Найяскравішим прикладом такого типу обмінної взаємодії є гідроліз солей. Вимірювання рН водних розчинів солей показали, що часто значення водневого показника бувають більшими (лужне середовище) або меншими (кисле середовище) ніж 7. Причиною цього є взаємодія солі з водою, або процес гідролізу.
Сутність процесу гідролізу солей полягає в тому, що іони солі зв’язують складові частини води (Н+, ОН− або обидва ці іони) з утворенням малодисоційованого електроліту. Унаслідок цього рівновага процесу електролітичної дисоціації води
Н2О ↔ Н+ + ОН−
певною мірою зміщується вправо. Наприклад, перебіг реакції обмінної взаємодії солі МеА з водою, яка супроводжується зв’язуванням іонів ОН− води з катіонами металу Меn+ у слабкий електроліт, можна пояснити такою схемою:
-












Зміщення рівноваги процесу дисоціації води
Загальне рівняння гідролізу таких солей матиме вигляд
![]() .
.
![]() .
.
Для іншої групи солей перебіг процесу гідролізу забезпечується зв’язуванням іонів H+ води аніонами солі з утворенням слабкої кислоти:
-












Зміщення рівноваги процесу дисоціації води
У цьому разі гідроліз солі можна описати таким іонним рівнянням:
![]() .
.
Обмінна взаємодія солі з водою посилюється в разі одночасного зв’язування іонів Н+ та ОН− води зі складовими частинами солі:
-















Зміщення рівноваги процесу дисоціації води
Загальне рівняння гідролізу має вигляд
![]() .
.
Природно, що коли іони Н+ та ОН− води не зв’язуються, гідроліз солей не відбувається і рівновага процесу дисоціації води не зміщується.
Отже, гідроліз солей має місце лише тоді, коли іони води зв’язуються з іонами солі, утворюючи слабкі кислоти або слабкі основи. Звідси випливає, що гідролізу піддаються солі, утворені слабкими кислотами, слабкими основами або одночасно слабкими кислотами й основами. Солі сильних кислот та основ гідролізу не піддаються.
Гідроліз солей – це процес, зворотний до реакцій нейтралізації слабких кислот або слабких основ, які не відбуваються до кінця у зв’язку з перебігом зворотної реакції – гідролізу утвореної солі:
|
|
|
|
|
|
|
|
|
Кислота |
|
Основа |
|
Сіль |
|
|
|
Реакція нейтралізації | ||||||
|
Реакція гідролізу | ||||||
Ступінь та константа гідролізу. Кількісними характеристиками гідролізу є його ступінь та константа.
Ступінь гідролізу солі (h) − це відношення концентрації солі, що піддалася гідролізу, до її загальної концентрації. Аналогічно до ступеня дисоціації ступінь гідролізу може змінюватися від 0 до 1, або від 0 до 100 %.
Оскільки гідроліз є зворотним процесом, для його характеристики можна застосувати закон діючих мас та розрахувати константу рівноваги – константу гідролізу (Кг).
Розглянемо рівняння гідролізу солі, утвореної слабкою кислотою та сильною основою:
![]() .
.
У розведених розчинах концентрація води є константою, тому рівняння гідролізу набуває такого вигляду:
![]() .
.
Помноживши чисельник та знаменник на концентрацію іонів Гідрогену [H+], одержимо:
 .
.
Таким чином, константа гідролізу солі, утвореної сильною основою та слабкою кислотою, дорівнюватиме частці іонного добутку води на константу дисоціації кислоти.
Чим слабша кислота (менше значення константи дисоціації), тим сильніше вона піддається гідролізу.
За аналогією можна довести, що константа гідролізу солі, утвореної слабкою основою та сильною кислотою, дорівнює
![]() .
.
А для солі, утвореної слабкими основою та кислотою
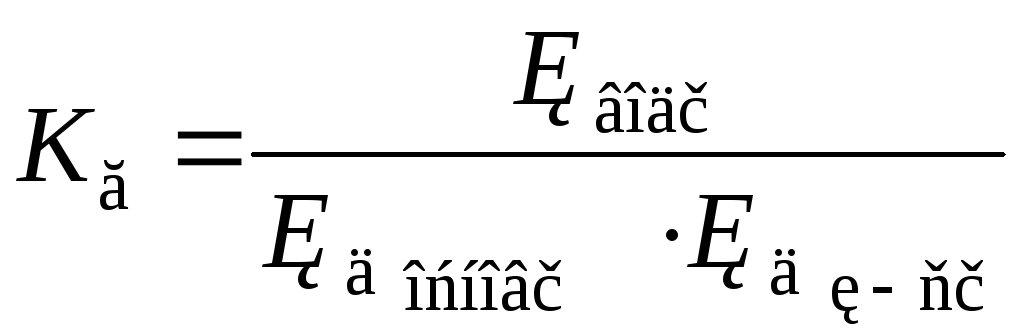 .
.
Щоб визначити зв'язок між Кг та h, наприклад, для солі сильної основи та слабкої кислоти, треба записати іонне рівняння її гідролізу:
![]() .
.
Якщо позначити вихідну концентрацію солі в розчині через С (моль/л), а ступінь гідролізу h, то
![]() ;
;
![]() ;
;
![]() .
.
Рівняння для розрахунку константи гідролізу можна записати так:
![]() , або
, або
![]() .
.
При h <<1 рівняння спрощується:
![]() та
та ![]() .
.
Оскільки
 ,
то
,
то![]() .
.
Із останнього рівняння випливають такі важливі висновки:
1) ступінь гідролізу буде тим більшим, чим менша концентрація розчину солі;
2) гідроліз солі підсилюється із підвищенням температури розчину, оскільки при цьому збільшується концентрація іонів Гідрогену та гідроксилу (із підвищенням температури константа води зростає);
3) чим слабша кислота, аніон якої утворює сіль (тобто чим менша константа дисоціації кислоти), тим більш повним є гідроліз солі.
