
- •Модуль 1 атомно-молекулярне вчення. Класифікація неорганічних сполук
- •1.1. Основні поняття та закони хімії
- •1.1.1. Ключові положення атомно-молекулярного вчення
- •1.1.2. Поняття загальної хімії
- •1.1.3. Фізичні величини, що застосовуються в хімії
- •Моль – це кількість речовини, яка містить стільки часток – структурних елементів, скільки атомів міститься в ізотопі Карбону с12 масою 0,012 кг.
- •1.1.4. Основні закони хімії
- •М.В. Ломоносов
- •Ж. Пруст
- •Наприклад, у реакції
- •А. Авогадро
- •2) Фактор еквівалентності може дорівнювати 1 і бути меншим за 1.
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •1.2. Основні класи неорганічних сполук
- •1.2.1. Класифікація неорганічних сполук
- •1.2.2. Оксиди
- •1.2.3. Основи
- •1.2.4. Кислоти
- •1.2.6. Генетичний зв’язок між класами неорганічних сполук
- •Класами неорганічних сполук
- •Підсумки
- •Задачі для самостійного розв’язування
- •Модуль 2 будова речовини
- •2.1. Будова атома
- •2.1.1. Складність будови атома та її експериментальне доведення
- •2.1.2. Перші моделі атома
- •Е. Резерфорд
- •2.1.3. Атомні спектри
- •2.1.4. Квантова теорія світла
- •2.1.5. Основні положення теорії будови атома Бора
- •2.1.6. Хвильова природа електрона. Електронні хмари
- •2.1.7. Квантові числа
- •Орієнтація s-, p- I d-орбіталей
- •2.1.8. Принцип Паулі
- •2.1.9. Послідовність заповнення електронами енергетичних рівнів у багатоелектронних атомах
- •Підсумки
- •Д. І. Менделєєв
- •2.2.3. Періодичність властивостей хімічних елементів
- •Спорідненістю до електрона (f) називається енергетичний ефект процесу приєднання електрона до нейтрального атома е з перетворенням його на негативний іон е-:
- •Підсумки
- •2.3.1. Іонний зв’язок
- •2.3.2. Ковалентний зв’язок
- •І електронів у молекулі водню н:h
- •Підсумки
- •Задачі для самостійного Розв’язування
- •Модуль 3 Закономірності перебігу хімічних реакцій
- •3.1.Хімічна термодинаміка
- •3.1.1. Теплові ефекти. Внутрішня енергія та ентальпія
- •Термодинаміки
- •Г. І. Гесс
- •1. Тепловий ефект хімічної реакції дорівнює сумі теплових ефектів її проміжних стадій.
- •3. Тепловий ефект хімічної реакції дорівнює різниці між сумою теплот утворення продуктів реакції і сумою теплот утворення вихідних речовин з урахуванням числа молів цих речовин.
- •3.1.2. Напрямленість процесів. Ентропія. Ізобарно-ізотермічний потенціал
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •3.2. Хімічна кінетикА та рівновага
- •3.2.1. Предмет хімічної кінетики
- •3.2.2. Швидкість хімічних реакцій
- •Речовин під час перебігу реакції
- •Залежність швидкості реакції від концентрації реагуючих речовин закон діючих мас
- •3.2.4. Вплив температури на швидкість реакцій. Енергія активації
- •3.2.5. Каталіз
- •3.2.6. Хімічна рівновага
- •Оборотної реакції
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •Приклади розв’язування задач
- •V(t2)моль/лхв.
- •Задачі для самостійного розв’язування
- •Модуль 4 Розчини. Теорія електролітичної дисоціації
- •4.1. Основні поняття про розчини
- •4.1.1. Термінологія, що використовується в теорії розчинів
- •4.1.2. Концентрація розчинів та способи її вираження
- •4.1.3. Колігативні властивості розчинів. Осмос
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •4.2. Теорія електролітичної дисоціації
- •4.2.1. Теорія електролітичної дисоціації Арреніуса
- •4.2.2. Реакції в розчинах електролітів. Іонні рівняння
- •4.2.3.Константа електролітичної дисоціації
- •4.2.4. Властивості розчинів сильних електролітів
- •4.2.5. Добуток розчинності
- •4.2.6. Дисоціація води. Іонний добуток води. Водневий показник
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •4.3. Гідроліз
- •4.4. Окисно-відновні реакції
- •Практичні заняття приклади розв’язування задач (до розділу 4.14.2)
- •Задачі для самостійного розв’язування
- •Приклади розв’язування задач (до розділу 4.3)
- •4. Розрахувати рН середовища під час взаємодії з водою амоній ціаніду.
- •Задачі для самостійного розв’язування
- •Приклади розв’язування задач (до розділу 4.4)
- •2. Підібрати коефіцієнти у схемі окисно-відновної реакції
- •Задачі для самостійного розв’язування
- •Предметний покажчик
- •Список рекомендованої літератури
4.2.2. Реакції в розчинах електролітів. Іонні рівняння
Відповідно до теорії електролітичної дисоціації реакції в розчинах електролітів відбуваються між іонами.
Реакції між іонами відбуваються тільки тоді, коли в результаті їх взаємодії утворюється малорозчинна або легколетка сполука, або слабкий електроліт.
Вираження рівнянь хімічних реакцій в іонному вигляді дозволяє з’ясувати, у яких випадках реакції мають тільки один напрямок, а коли вони оборотні. Розглянемо декілька типів хімічних реакцій з позиції теорії електролітичної дисоціації та спробуємо встановити закономірності їх перебігу.
Оборотні реакції. Якщо змішати розчини натрій хлориду та калій нітрату, то ніяких змін не відбудеться. Натрій хлорид у розчині дисоціює на іони Натрію та хлориду, а калій нітрат – на іони Калію та нітрат-іони. Рівняння реакції, яка відбувається між цими речовинами має такий вигляд:
![]() .
.
Вихідні речовини добре розчинні у воді, є сильними електролітами і тому в розчині знаходяться у вигляді іонів. Іонне рівняння реакції можна записати так:
![]() .
.
Як бачимо, і в лівій, і в правій частинах рівняння в розчині знаходяться одні й ті ж іони. Таким чином, реакція фактично не відбувається.
Розглянемо іншу реакцію:
![]() .
.
Запишемо її в іонно-молекулярному вигляді (усі речовини, які є сильними електролітами, записуються як іони, інші – як молекули):
![]() .
.
П![]() ісля
скорочення однакових іонів отримуємо
ісля
скорочення однакових іонів отримуємо
Ця реакція є оборотною, оскільки і в лівій, і в правій частинах рівняння є недисоційовані молекули. Таким чином, ця реакція не відбувається до кінця.
Необоротні процеси. Серед практично необоротних реакцій можна виділити декілька типів.
Реакції іонного обміну можна вважати здійсненими до кінця в тих випадках, коли утворюється:
осад
CuSO4 + 2KOH = Cu(OH)2 + K2SO4 − молекулярна форма;
Cu2+
+ SO![]() + 2K+
+ 2OH-
= Cu(OH)2
+ 2K+
+ SO
+ 2K+
+ 2OH-
= Cu(OH)2
+ 2K+
+ SO![]() − повна іонна форма;
− повна іонна форма;
Cu2+ + 2OH- = Cu(OH)2 − скорочена іонна форма;
газ
Na2CO3 + 2HCl 2NaCl + H2CO3,
2Na+
+ CO![]() +
2H+
+ 2Cl-
2Na+
+ 2Сl-
+ H2O
+ CO2,
+
2H+
+ 2Cl-
2Na+
+ 2Сl-
+ H2O
+ CO2,
CO![]() +
2H+
H2O
+ CO2;
+
2H+
H2O
+ CO2;
слабкий електроліт (Н2О)
KOH + HNO3 KNO3 + Н2О;
K+
+ OH-
+ H+
+ NO![]()
K+
+ NO
K+
+ NO![]() +
Н2О;
+
Н2О;
OH- + H+ Н2О.
Під час написання рівнянь іонних реакцій у розчинах електролітів треба враховувати, що:
прості речовини, оксиди, а також нерозчинні речовини не дисоціюють;
якщо малорозчинна речовина утворюється в результаті реакції, то в іонному рівнянні її вважають нерозчинною;
сума зарядів іонів ліворуч і праворуч повинна бути однаковою;
подавати слід три рівняння: повне молекулярне, повне іонне та скорочене іонне.
4.2.3.Константа електролітичної дисоціації
Оскільки електрична дисоціація слабких електролітів являє собою оборотний процес, то вона підпорядковується закону діючих мас. Таким чином, для процесу дисоціації слабкого електроліту можна записати константу рівноваги. Як приклад розглянемо дисоціацію слабкого електроліту KA:
![]() .
.
Позначимо концентрацію іонів як [K+] та[A−], а концентрацію недисоційованих молекул через [KA]. Тоді константу рівноваги запишемо так:
![]() .
.
Константа рівноваги процесу дисоціації слабкого електроліту називається константою дисоціації Кдис. Вона, як і ступінь дисоціації, є кількісною мірою можливості речовини дисоціювати в розчині. Чим менше значення Кдис, тим слабший електроліт і навпаки, чим більше Кдис, тим краще дисоціює розчинена речовина. Константа дисоціації не залежить від концентрації розчину, але залежить від температури. (Вона має розмірність концентрації моль на літр.)
Із
рівноваги слабкого електроліту
![]() бачимо, що збільшення концентрації в
розчині одного з іонів [K+]
або [A−]
внаслідок введення у розчин електроліту
[KА]
речовини, яка містить однойменний іон,
зміщує рівновагу вліво (принцип Ле
Шательє). Тому, якщо до розчину ацетатної
кислоти додати розчин натрій ацетату,
то концентрація молекул кислоти
збільшиться. Розбавлення розчину
слабкого електроліту сприяє дисоціації.
Ступінь дисоціації при цьому збільшується,
а значення константи дисоціації Кдис
залишається
незмінним.
бачимо, що збільшення концентрації в
розчині одного з іонів [K+]
або [A−]
внаслідок введення у розчин електроліту
[KА]
речовини, яка містить однойменний іон,
зміщує рівновагу вліво (принцип Ле
Шательє). Тому, якщо до розчину ацетатної
кислоти додати розчин натрій ацетату,
то концентрація молекул кислоти
збільшиться. Розбавлення розчину
слабкого електроліту сприяє дисоціації.
Ступінь дисоціації при цьому збільшується,
а значення константи дисоціації Кдис
залишається
незмінним.
Слабкі електроліти, які складаються більше ніж із двох іонів, дисоціюють ступінчасто. Кожен ступінь дисоціації характеризується певною величиною константи дисоціації. Ці константи дисоціації називаються ступінчастими і позначаються К1, К2, …Кn. Прикладом багатоіонного електроліту є ортофосфатна кислота H3PO4. Відповідно до послідовного відщеплення іонів гідрогену можна записати три рівняння рівноваги, які характеризуються ступінчастими константами дисоціації. При цьому практично завжди К1 > К2 >…> Кn, оскільки енергія відщеплення першого іона від нейтральної молекули завжди менша:
 ;
;
 ;
;
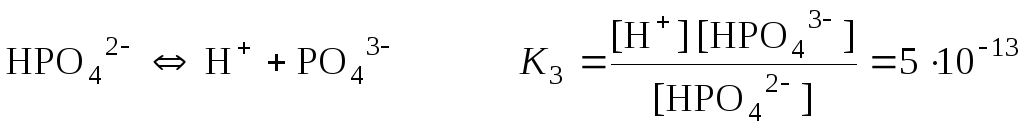 .
.
К1 > К2 > К3.
Сумарна константа дисоціації

дорівнює добутку ступінчастих констант дисоціації:
![]() .
.
Ступінчасто дисоціюють також багатокислотні основи та амфотерні гідроксиди, наприклад:
Pb(OH)2 PbOH+ + OH−,
PbOH+ Pb2+ + OH−.
Закон розведення. Між константою та ступенем електролітичної дисоціації існує взаємозв’язок, який називається законом розведення Оствальда. Запишемо рівняння дисоціації слабкого бінарного електроліту типу КА:
![]() .
.
Нехай його концентрація [KА]0 дорівнює С моль/л, а ступінь дисоціації . Тоді концентрація іонів
[KA]х = [K+] = [A−] =С,
а концентрація недисоційованих молекул дорівнює
[KА] = С(1).
Якщо підставити значення концентрацій усіх частинок електроліту у вираз його константи дисоціації, одержимо
![]() ,
або
,
або
![]() −
−
це рівняння є математичним вираженням закону розведення Оствальда.
Якщо електроліт дуже слабкий, тобто 0,1, то рівняння спрощується:
![]() ,
,
звідси
![]() .
.
Із цього рівняння випливає важливий висновок: зі зменшенням концентрації електроліту ступінь його дисоціації зростає.
