
- •Модуль 1 атомно-молекулярне вчення. Класифікація неорганічних сполук
- •1.1. Основні поняття та закони хімії
- •1.1.1. Ключові положення атомно-молекулярного вчення
- •1.1.2. Поняття загальної хімії
- •1.1.3. Фізичні величини, що застосовуються в хімії
- •Моль – це кількість речовини, яка містить стільки часток – структурних елементів, скільки атомів міститься в ізотопі Карбону с12 масою 0,012 кг.
- •1.1.4. Основні закони хімії
- •М.В. Ломоносов
- •Ж. Пруст
- •Наприклад, у реакції
- •А. Авогадро
- •2) Фактор еквівалентності може дорівнювати 1 і бути меншим за 1.
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •1.2. Основні класи неорганічних сполук
- •1.2.1. Класифікація неорганічних сполук
- •1.2.2. Оксиди
- •1.2.3. Основи
- •1.2.4. Кислоти
- •1.2.6. Генетичний зв’язок між класами неорганічних сполук
- •Класами неорганічних сполук
- •Підсумки
- •Задачі для самостійного розв’язування
- •Модуль 2 будова речовини
- •2.1. Будова атома
- •2.1.1. Складність будови атома та її експериментальне доведення
- •2.1.2. Перші моделі атома
- •Е. Резерфорд
- •2.1.3. Атомні спектри
- •2.1.4. Квантова теорія світла
- •2.1.5. Основні положення теорії будови атома Бора
- •2.1.6. Хвильова природа електрона. Електронні хмари
- •2.1.7. Квантові числа
- •Орієнтація s-, p- I d-орбіталей
- •2.1.8. Принцип Паулі
- •2.1.9. Послідовність заповнення електронами енергетичних рівнів у багатоелектронних атомах
- •Підсумки
- •Д. І. Менделєєв
- •2.2.3. Періодичність властивостей хімічних елементів
- •Спорідненістю до електрона (f) називається енергетичний ефект процесу приєднання електрона до нейтрального атома е з перетворенням його на негативний іон е-:
- •Підсумки
- •2.3.1. Іонний зв’язок
- •2.3.2. Ковалентний зв’язок
- •І електронів у молекулі водню н:h
- •Підсумки
- •Задачі для самостійного Розв’язування
- •Модуль 3 Закономірності перебігу хімічних реакцій
- •3.1.Хімічна термодинаміка
- •3.1.1. Теплові ефекти. Внутрішня енергія та ентальпія
- •Термодинаміки
- •Г. І. Гесс
- •1. Тепловий ефект хімічної реакції дорівнює сумі теплових ефектів її проміжних стадій.
- •3. Тепловий ефект хімічної реакції дорівнює різниці між сумою теплот утворення продуктів реакції і сумою теплот утворення вихідних речовин з урахуванням числа молів цих речовин.
- •3.1.2. Напрямленість процесів. Ентропія. Ізобарно-ізотермічний потенціал
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •3.2. Хімічна кінетикА та рівновага
- •3.2.1. Предмет хімічної кінетики
- •3.2.2. Швидкість хімічних реакцій
- •Речовин під час перебігу реакції
- •Залежність швидкості реакції від концентрації реагуючих речовин закон діючих мас
- •3.2.4. Вплив температури на швидкість реакцій. Енергія активації
- •3.2.5. Каталіз
- •3.2.6. Хімічна рівновага
- •Оборотної реакції
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •Приклади розв’язування задач
- •V(t2)моль/лхв.
- •Задачі для самостійного розв’язування
- •Модуль 4 Розчини. Теорія електролітичної дисоціації
- •4.1. Основні поняття про розчини
- •4.1.1. Термінологія, що використовується в теорії розчинів
- •4.1.2. Концентрація розчинів та способи її вираження
- •4.1.3. Колігативні властивості розчинів. Осмос
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •4.2. Теорія електролітичної дисоціації
- •4.2.1. Теорія електролітичної дисоціації Арреніуса
- •4.2.2. Реакції в розчинах електролітів. Іонні рівняння
- •4.2.3.Константа електролітичної дисоціації
- •4.2.4. Властивості розчинів сильних електролітів
- •4.2.5. Добуток розчинності
- •4.2.6. Дисоціація води. Іонний добуток води. Водневий показник
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •4.3. Гідроліз
- •4.4. Окисно-відновні реакції
- •Практичні заняття приклади розв’язування задач (до розділу 4.14.2)
- •Задачі для самостійного розв’язування
- •Приклади розв’язування задач (до розділу 4.3)
- •4. Розрахувати рН середовища під час взаємодії з водою амоній ціаніду.
- •Задачі для самостійного розв’язування
- •Приклади розв’язування задач (до розділу 4.4)
- •2. Підібрати коефіцієнти у схемі окисно-відновної реакції
- •Задачі для самостійного розв’язування
- •Предметний покажчик
- •Список рекомендованої літератури
Підсумки Необхідно зрозуміти
Розчинення є фізико-хімічним процесом.
Концентрація розчину − кількість розчиненої речовини, що міститься в певній кількості розчину або розчинника. Існують різні способи вираження концентрації речовини, але всі вони пов’язані математичними співвідношеннями і можуть бути переведені із однієї форми в іншу.
Критерієм розподілу речовин на електроліти та неелектроліти є електропровідність їх розчинів та розплавів.
Фізико-хімічні властивості розведених розчинів неелектролітів: тиск насиченої пари над розчином, температури кипіння, кристалізації та замерзання, осмотичний тиск − змінюються пропорційно концентрації розчинів.
Треба вміти
Розраховувати кількості речовин, необхідних для приготування розчинів, концентрація яких виражена: молярною, нормальною, моляльною, масовою та мольною частками.
Виходячи із закону осмотичного тиску та законів Рауля обчислювати тиск пари розчину, абсолютне зниження тиску пари, визначати молекулярні маси речовин, установлювати концентрації та склад розчинів за їх фізико-хімічними характеристиками.
Слід запам’ятати
1. Формули:
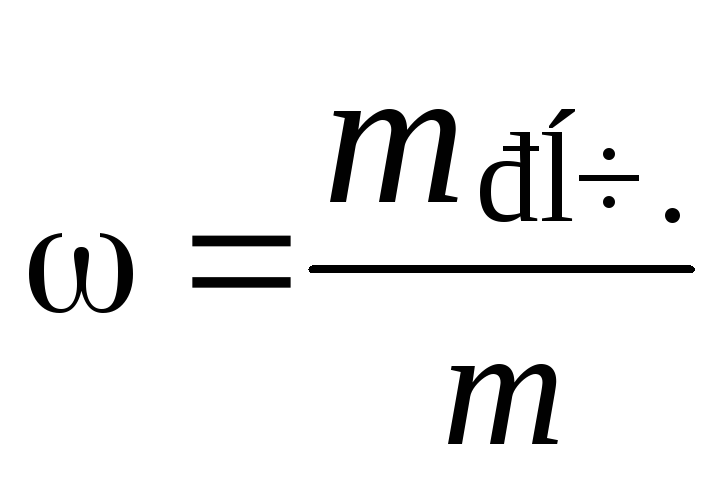 −масова
частка речовини в розчині;
−масова
частка речовини в розчині;
 −процентна
концентрація речовини в розчині;
−процентна
концентрація речовини в розчині;
 −молярна
концентрація речовини в розчині;
−молярна
концентрація речовини в розчині;
 −нормальна
концентрація речовини в розчині;
−нормальна
концентрація речовини в розчині;
 −масова
концентрація речовини в розчині;
−масова
концентрація речовини в розчині;
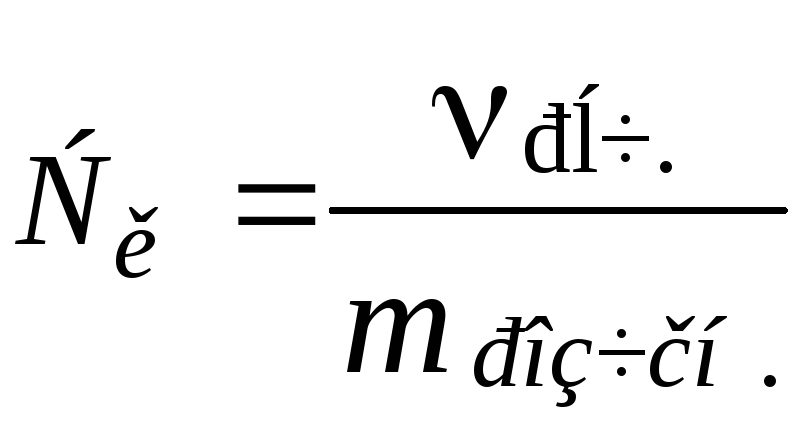 −моляльна
концентрація речовини у розчині.
−моляльна
концентрація речовини у розчині.
2. Математичні вирази
- закону осмотичного тиску:
Pосм. = CRT;
Pосм. = mRT/M;
- законів Рауля:
∆Р/Р0 = n1/(n1+n2);
∆tкип. = Ке Сm;
∆tзам. = Кк Сm.
4.2. Теорія електролітичної дисоціації
Закони Рауля і принцип Вант-Гоффа не дійсні для розчинів електролітів (навіть нескінченно розведених). Ці розчини поводять себе так, нібито вони містять більше часток розчиненої речовини, ніж це випливає з їх концентрації. Реальні показники підвищення температури кипіння, зниження температури замерзання, осмотичний тиск цих розчинів завжди більші, ніж розраховані теоретично. Для врахування даних відхилень Вант-Гофф запропонував застосовувати ізотонічний коефіцієнт (і):
![]() .
.
Отже, всі експериментальні значення в i разів більші за теоретичні:
Pосм. = і CRT; ∆tкип. = і Ке Сm; ∆tзам. = і Кк Сm.
Для неелектролітів і = 1.
Для електролітів: NaCl = Na+ + Cl- i =2;
CaCl2 = Ca2+ + 2Cl- i =3;
AlCl3 = Al3+ + 3Cl- i =4.
Експериментально, наприклад, для NaCl 1 < i < 2. Ці факти можна пояснити за допомогою теорії електролітичної дисоціації.
4.2.1. Теорія електролітичної дисоціації Арреніуса
У 1887 р. учений-хімік Сванте Арреніус зробив такі припущення:
1. Електроліти в розчинах розпадаються на іони − дисоціюють; i вказує, у скільки разів збільшилась загальна кількість частинок у розчині в результаті розпаду на іони молекул.
2. Дисоціація є зворотним рівноважним процесом, електроліти під час розчинення розпадаються на іони не повністю; це пояснює, чому експериментально, наприклад, для NaCl, 1 < i < 2.
3. Сили взаємодії іонів розчиненої речовини з молекулами розчинника слабкі (тобто розчини є ідеальними).
Дисоціація – процес розпаду молекул електролітів на позитивно заряджені іони – катіони і негативно заряджені іони – аніони. Електролітична дисоціація речовин, яка відбувається з утворенням вільних іонів, пояснює електричну провідність розчинів.
Процес електролітичної дисоціації можна подати у вигляді рівняння
KNO3 = K+ + NO3-.
Одна молекула дисоціює на два іони.
Рівняння дисоціації гідроген хлориду під дією полярного розчинника води таке:
HCl + H2O H3O+ + Cl-.
Іон гідроксонію
Але для спрощення запису нехтують водою
HCl = H+ + Cl-.
Механізм електролітичної дисоціації іонних сполук (іон-дипольний механізм). Орієнтуючись навколо іонів кристалічної решітки натрій хлориду (рис. 20) молекули води утворюють із ними водневі зв’язки, при цьому виділяється велика кількість енергії, яка називається енергією гідратації.
Механізм електролітичної дисоціації полярних сполук (диполь – дипольний механізм). Під впливом диполів води поляризований ковалентний зв`язок перетворюється на іонний і молекула гідроген хлориду розпадається на два гідратовані іони (рис. 21).

Рис. 20. Модель дисоціації натрій хлориду під дією полярного розчинника води

Рис. 21. Модель дисоціації гідроген хлориду під дією полярного розчинника води
Концентрації іонів у розчинах слабких електролітів якісно характеризуються ступенем та константою дисоціації.
Ступінь дисоціації (α) – відношення числа молекул, які розпалися на іони (n), до загальної кількості розчинених молекул (N):
α=n/N.
І![]() зотонічний
коефіцієнт пов`язаний зі ступенем
електролітичної дисоціації:
зотонічний
коефіцієнт пов`язаний зі ступенем
електролітичної дисоціації:
i =1
+ α(k - 1),
або
i – 1
= α(k - 1)
=1
+ α(k - 1),
або
i – 1
= α(k - 1)
де k – кількість іонів, на які може розпадатися речовина. Ступінь електролітичної дисоціації виражають у відсотках або частках одиниці.
Між недисоційованими молекулами та іонами слабких електролітів через деякий час установлюється динамічна рівновага:
NH4OH NH4+ + OH
![]() ,
,
де Кр – константа рівноваги, що відповідає дисоціації слабкого електроліту. Величина константи залежить від природи електроліту і розчинника, температури, але не залежить від концентрації. На рис. 22 наведена класифікація та приклади електролітів.
Амфотерні основи можуть дисоціювати за такою схемою:
2H+ + ZnO22− Zn(OH)2 Zn2+ + 2OH−.
Нормальні солі є сильними електролітами, що утворюють у результаті дисоціації катіон металу та аніон кислотного залишку:
CuCl2 = Cu2+ + 2Cl.
Кислі солі сильні електроліти, що утворюють внаслідок дисоціації катіон металу та складний аніон, до складу якого входять іони гідрогену та кислотний залишок:
NaHCO3=Na+ + HCO3- α = 1;
HCO3- H+ + CO3- α < 1.

У розчині − лише іони У розчині є іони й молекули
і практично немає молекул
|
Кислоти: HCl, HBr, HI, H2SO4, HNO3, HMnO4, HClO4, HClO3 |
Кислоти: HF, H2SO3, H3PO4 |
Кислоти: H2S, H2CO3, H2SiO3, H3BO3, HAc |
|
Луги: LiOH, NaOH, RbOH, CsOH, Ca(OH)2, Sr(OH)2, Ba(OH)2 |
|
Основи: нерозчинні у воді, NH4OH |
|
Солі − практично всі водорозчинні |
|
Деякі солі: Fe(CNS)3, Hg(CN)2, ZnCl2 |
Рис. 22. Класифікація електролітів
Основні солі – електроліти, що утворюють у результаті дисоціації складний катіон, що містить іон металу й гідроксогрупи та аніони кислотного залишку:
Fe(OH)2Cl = Fe(OH)2+ + Cl α = 1;
Fe(OH)2+ Fe(OH)2+ + OH α < 1;
Fe(OH)2+ Fe3+ + OH.
