
- •Модуль 1 атомно-молекулярне вчення. Класифікація неорганічних сполук
- •1.1. Основні поняття та закони хімії
- •1.1.1. Ключові положення атомно-молекулярного вчення
- •1.1.2. Поняття загальної хімії
- •1.1.3. Фізичні величини, що застосовуються в хімії
- •Моль – це кількість речовини, яка містить стільки часток – структурних елементів, скільки атомів міститься в ізотопі Карбону с12 масою 0,012 кг.
- •1.1.4. Основні закони хімії
- •М.В. Ломоносов
- •Ж. Пруст
- •Наприклад, у реакції
- •А. Авогадро
- •2) Фактор еквівалентності може дорівнювати 1 і бути меншим за 1.
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •1.2. Основні класи неорганічних сполук
- •1.2.1. Класифікація неорганічних сполук
- •1.2.2. Оксиди
- •1.2.3. Основи
- •1.2.4. Кислоти
- •1.2.6. Генетичний зв’язок між класами неорганічних сполук
- •Класами неорганічних сполук
- •Підсумки
- •Задачі для самостійного розв’язування
- •Модуль 2 будова речовини
- •2.1. Будова атома
- •2.1.1. Складність будови атома та її експериментальне доведення
- •2.1.2. Перші моделі атома
- •Е. Резерфорд
- •2.1.3. Атомні спектри
- •2.1.4. Квантова теорія світла
- •2.1.5. Основні положення теорії будови атома Бора
- •2.1.6. Хвильова природа електрона. Електронні хмари
- •2.1.7. Квантові числа
- •Орієнтація s-, p- I d-орбіталей
- •2.1.8. Принцип Паулі
- •2.1.9. Послідовність заповнення електронами енергетичних рівнів у багатоелектронних атомах
- •Підсумки
- •Д. І. Менделєєв
- •2.2.3. Періодичність властивостей хімічних елементів
- •Спорідненістю до електрона (f) називається енергетичний ефект процесу приєднання електрона до нейтрального атома е з перетворенням його на негативний іон е-:
- •Підсумки
- •2.3.1. Іонний зв’язок
- •2.3.2. Ковалентний зв’язок
- •І електронів у молекулі водню н:h
- •Підсумки
- •Задачі для самостійного Розв’язування
- •Модуль 3 Закономірності перебігу хімічних реакцій
- •3.1.Хімічна термодинаміка
- •3.1.1. Теплові ефекти. Внутрішня енергія та ентальпія
- •Термодинаміки
- •Г. І. Гесс
- •1. Тепловий ефект хімічної реакції дорівнює сумі теплових ефектів її проміжних стадій.
- •3. Тепловий ефект хімічної реакції дорівнює різниці між сумою теплот утворення продуктів реакції і сумою теплот утворення вихідних речовин з урахуванням числа молів цих речовин.
- •3.1.2. Напрямленість процесів. Ентропія. Ізобарно-ізотермічний потенціал
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •3.2. Хімічна кінетикА та рівновага
- •3.2.1. Предмет хімічної кінетики
- •3.2.2. Швидкість хімічних реакцій
- •Речовин під час перебігу реакції
- •Залежність швидкості реакції від концентрації реагуючих речовин закон діючих мас
- •3.2.4. Вплив температури на швидкість реакцій. Енергія активації
- •3.2.5. Каталіз
- •3.2.6. Хімічна рівновага
- •Оборотної реакції
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •Приклади розв’язування задач
- •V(t2)моль/лхв.
- •Задачі для самостійного розв’язування
- •Модуль 4 Розчини. Теорія електролітичної дисоціації
- •4.1. Основні поняття про розчини
- •4.1.1. Термінологія, що використовується в теорії розчинів
- •4.1.2. Концентрація розчинів та способи її вираження
- •4.1.3. Колігативні властивості розчинів. Осмос
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •4.2. Теорія електролітичної дисоціації
- •4.2.1. Теорія електролітичної дисоціації Арреніуса
- •4.2.2. Реакції в розчинах електролітів. Іонні рівняння
- •4.2.3.Константа електролітичної дисоціації
- •4.2.4. Властивості розчинів сильних електролітів
- •4.2.5. Добуток розчинності
- •4.2.6. Дисоціація води. Іонний добуток води. Водневий показник
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •4.3. Гідроліз
- •4.4. Окисно-відновні реакції
- •Практичні заняття приклади розв’язування задач (до розділу 4.14.2)
- •Задачі для самостійного розв’язування
- •Приклади розв’язування задач (до розділу 4.3)
- •4. Розрахувати рН середовища під час взаємодії з водою амоній ціаніду.
- •Задачі для самостійного розв’язування
- •Приклади розв’язування задач (до розділу 4.4)
- •2. Підібрати коефіцієнти у схемі окисно-відновної реакції
- •Задачі для самостійного розв’язування
- •Предметний покажчик
- •Список рекомендованої літератури
4.1.2. Концентрація розчинів та способи її вираження
Склад розчинів визначають за вмістом розчиненої речовини, який характеризується її концентрацією або часткою.
Концентрацією розчину називається кількість розчиненої речовини, що міститься в певній кількості розчину або розчинника. Розчини з великою концентрацією розчиненої речовини називаються концентрованими, з малою – розведеними. Межі між ними досить умовні. Для більш повної характеристики склад розчинів характеризують кількісно. Одиницею об’єму розчину або розчинника слугує кубічний метр (м3) або кубічний дециметр (дм3), який дорівнює 1 літру (л).
Найбільш застосовувані способи вираження вмісту розчиненої речовини наведені в табл. 10, із якої видно, що всі вони взаємопов’язані, а за допомогою математичних розрахунків склад розчинів може бути поданий у будь-якій формі.
Молярна концентрація (С) – це фізична величина, що визначається відношенням кількості молів розчиненої речовини до об’єму розчину. Цей термін поширюється на будь-який вид умовних частинок (атоми, іони, молекули, частини молекул тощо). Молярну концентрацію виражають у молях на дециметр кубічний або молях розчиненої речовини в літрі розчину, наприклад С(НCl)=0,1 моль/л. Для деяких значень молярної концентрації розчинів застосовують спеціальні терміни та позначення: 1,0000 моль/л (1 М) – молярний, 0,1000 моль/л (0,1 М) – децимолярний, 0,0100 моль/л (0,01 М) – сантимолярний.
Таблиця 10. Способи вираження складу розчинів
-
Величина
Символ (вимова)
Визначальне
рівняння
Одиниці вимірювання
основні
додаткові
Частка
масова
або
процентна концентрація

(омега)



безрозмірна
%
мольна

(ксі)
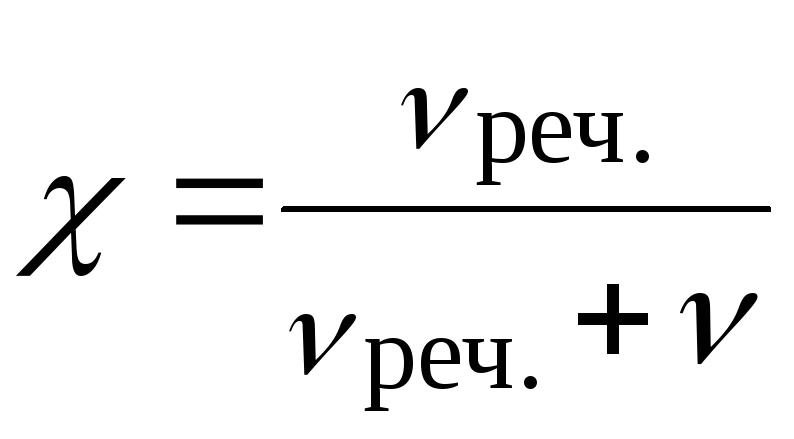
безрозмірна
об'ємна

(фі)

безрозмірна
Концентрація
молярна

(це)

моль/л
моль/дм3
нормальна (нормальність, молярна концентрація еквівалентів)

(це еф)

моль∙екв/л
моль∙екв/дм3
масова

(ро)

кг/л
кг/дм3
моляльна

(це ем)

моль/кг
Еквівалентна концентрація, або нормальність (Сf) – число еквівалентів речовини, що міститься в 1 л розчину.
Для розрахунків еквівалентної концентрації потрібно згадати про поняття еквівалентів хімічних речовин та способи їх обчислення. Індекс f означає фактор еквівалентності – число, на яке треба помножити молярну масу речовини, щоб отримати її еквівалент.
Фактори еквівалентності дорівнюють:
для кислот – одиниці, поділеній на кількість атомів Гідрогену, що беруть участь у хімічних реакціях;
основ – одиниці, поділеній на кількість гідроксильних груп, що беруть участь у хімічних реакціях;
солей – одиниці, поділеній на добуток числа іонів (катіонів) металів на їх заряд.
Для окисно-відновних реакцій фактор еквівалентності речовин визначається як одиниця, поділена на кількість електронів, що беруть участь у процесі окиснення або відновлення частинок.
Особливістю еквінормальних (однакових за нормальністю) речовин є те, що вони взаємодіють без залишку. Це є ілюстрацією до закону еквівалентів: речовини взаємодіють між собою в кількостях, пропорційних їх еквівалентам. Математичний вираз закону дає можливість легко розраховувати кількості речовин, що вступають у взаємодію, а також кількості, необхідні для приготування розчинів:
Сf 1∙V1=Сf 2∙V2.
Значення молярної та нормальної концентрацій розраховують із точністю до 4-го знака після коми, ці способи вираження концентрації вважаються точними та застосовуються для здійснення хімічного аналізу. Наважку речовини для приготування розчину з концентрацією, вираженою в молях на літр, обов’язково зважують на точних аналітичних вагах.
Для деяких значень еквівалентної концентрації розчинів застосовують спеціальні терміни та позначення: 1,0000 моль∙екв/л – нормальний, 0,1000 моль∙екв/л – децинормальний, 0,0100 моль∙екв/л – сантинормальний.
Моляльна концентрація, моляльність (Сm) − кількість молів розчиненої речовини в 1000 г розчинника.
У загальному вигляді Сm=1000∙ реч./ m,
де реч. − число молів розчиненої речовини; m – кількість розчинника, г (якщо виразити кількість розчинника в кілограмах, рівняння набуде такого вигляду: Сm.=реч./ m).
Мольна частка – відношення числа молів певної речовини до суми молів усіх речовин, що містяться в розчині.
Під час технологічних процесів для розрахунків рецептур харчових продуктів найчастіше застосовують масову частку ω (раніше її називали процентною концентрацією) – відношення маси розчиненої речовини до маси розчину, або кількість грамів розчиненої речовини, що міститься в 100 г розчину. Так, 9%-й розчин оцтової кислоти, це такий, у 100 г якого міститься 9 г крижаної оцтової кислоти.
Масова концентрація – відношення маси розчиненої речовини до об’єму розчину (виражається в кілограмах на дециметр кубічний або кілограмах на літр). Масова концентрація, виражена в грамах на мілілітр, − титр. Ця одиниця дала назву класичному методу аналізу − титрометрії.
Процентну концентрацію слід розраховувати з точністю до другого знака після коми. Цей спосіб вираження концентрації порівняно з іншими вважається менш точним. Він найчастіше застосовується для обчислення кількості інгредієнтів для рецептур у виробничому процесі.
