
- •Модуль 1 атомно-молекулярне вчення. Класифікація неорганічних сполук
- •1.1. Основні поняття та закони хімії
- •1.1.1. Ключові положення атомно-молекулярного вчення
- •1.1.2. Поняття загальної хімії
- •1.1.3. Фізичні величини, що застосовуються в хімії
- •Моль – це кількість речовини, яка містить стільки часток – структурних елементів, скільки атомів міститься в ізотопі Карбону с12 масою 0,012 кг.
- •1.1.4. Основні закони хімії
- •М.В. Ломоносов
- •Ж. Пруст
- •Наприклад, у реакції
- •А. Авогадро
- •2) Фактор еквівалентності може дорівнювати 1 і бути меншим за 1.
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •1.2. Основні класи неорганічних сполук
- •1.2.1. Класифікація неорганічних сполук
- •1.2.2. Оксиди
- •1.2.3. Основи
- •1.2.4. Кислоти
- •1.2.6. Генетичний зв’язок між класами неорганічних сполук
- •Класами неорганічних сполук
- •Підсумки
- •Задачі для самостійного розв’язування
- •Модуль 2 будова речовини
- •2.1. Будова атома
- •2.1.1. Складність будови атома та її експериментальне доведення
- •2.1.2. Перші моделі атома
- •Е. Резерфорд
- •2.1.3. Атомні спектри
- •2.1.4. Квантова теорія світла
- •2.1.5. Основні положення теорії будови атома Бора
- •2.1.6. Хвильова природа електрона. Електронні хмари
- •2.1.7. Квантові числа
- •Орієнтація s-, p- I d-орбіталей
- •2.1.8. Принцип Паулі
- •2.1.9. Послідовність заповнення електронами енергетичних рівнів у багатоелектронних атомах
- •Підсумки
- •Д. І. Менделєєв
- •2.2.3. Періодичність властивостей хімічних елементів
- •Спорідненістю до електрона (f) називається енергетичний ефект процесу приєднання електрона до нейтрального атома е з перетворенням його на негативний іон е-:
- •Підсумки
- •2.3.1. Іонний зв’язок
- •2.3.2. Ковалентний зв’язок
- •І електронів у молекулі водню н:h
- •Підсумки
- •Задачі для самостійного Розв’язування
- •Модуль 3 Закономірності перебігу хімічних реакцій
- •3.1.Хімічна термодинаміка
- •3.1.1. Теплові ефекти. Внутрішня енергія та ентальпія
- •Термодинаміки
- •Г. І. Гесс
- •1. Тепловий ефект хімічної реакції дорівнює сумі теплових ефектів її проміжних стадій.
- •3. Тепловий ефект хімічної реакції дорівнює різниці між сумою теплот утворення продуктів реакції і сумою теплот утворення вихідних речовин з урахуванням числа молів цих речовин.
- •3.1.2. Напрямленість процесів. Ентропія. Ізобарно-ізотермічний потенціал
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •3.2. Хімічна кінетикА та рівновага
- •3.2.1. Предмет хімічної кінетики
- •3.2.2. Швидкість хімічних реакцій
- •Речовин під час перебігу реакції
- •Залежність швидкості реакції від концентрації реагуючих речовин закон діючих мас
- •3.2.4. Вплив температури на швидкість реакцій. Енергія активації
- •3.2.5. Каталіз
- •3.2.6. Хімічна рівновага
- •Оборотної реакції
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •Приклади розв’язування задач
- •V(t2)моль/лхв.
- •Задачі для самостійного розв’язування
- •Модуль 4 Розчини. Теорія електролітичної дисоціації
- •4.1. Основні поняття про розчини
- •4.1.1. Термінологія, що використовується в теорії розчинів
- •4.1.2. Концентрація розчинів та способи її вираження
- •4.1.3. Колігативні властивості розчинів. Осмос
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •4.2. Теорія електролітичної дисоціації
- •4.2.1. Теорія електролітичної дисоціації Арреніуса
- •4.2.2. Реакції в розчинах електролітів. Іонні рівняння
- •4.2.3.Константа електролітичної дисоціації
- •4.2.4. Властивості розчинів сильних електролітів
- •4.2.5. Добуток розчинності
- •4.2.6. Дисоціація води. Іонний добуток води. Водневий показник
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •4.3. Гідроліз
- •4.4. Окисно-відновні реакції
- •Практичні заняття приклади розв’язування задач (до розділу 4.14.2)
- •Задачі для самостійного розв’язування
- •Приклади розв’язування задач (до розділу 4.3)
- •4. Розрахувати рН середовища під час взаємодії з водою амоній ціаніду.
- •Задачі для самостійного розв’язування
- •Приклади розв’язування задач (до розділу 4.4)
- •2. Підібрати коефіцієнти у схемі окисно-відновної реакції
- •Задачі для самостійного розв’язування
- •Предметний покажчик
- •Список рекомендованої літератури
Т
Рис. 19. ШвидкістьОборотної реакції
оді константа рівноваги
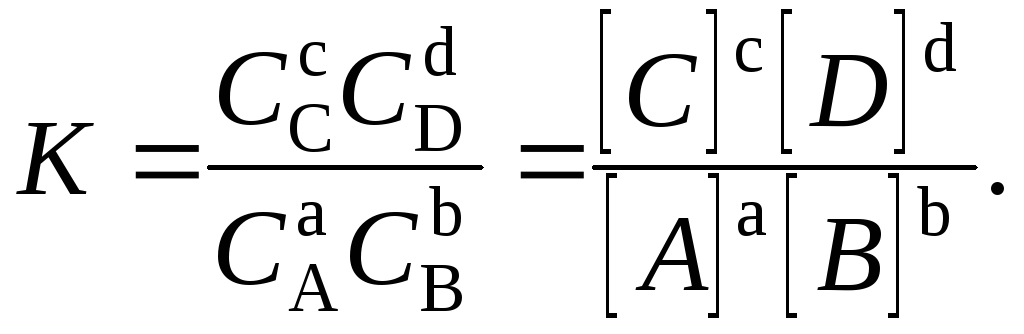
Це рівняння є математичним виразом закону діючих мас для стану рівноваги. Константа рівноваги залежить від температури, зміни ентальпії та ентропії, але не залежить від енергії активації, яка впливає лише на час встановлення рівноваги. Тому каталізатор, знижуючи енергію активації й підвищуючи ентропію активації прямої та зворотної реакцій, прискорює встановлення рівноваги, не змінюючи її константу.
Змінюючи умови, можна перевести систему з одного рівноважного стану в інший, що відповідає новим умовам. Рівновага зміщується тому, що зміна умов неоднаково впливає на швидкість прямої та зворотної реакцій. Характер зміщення рівноваги залежно від зовнішніх факторів можна визначити за принципом Ле Шательє (1884): якщо на систему, що перебуває в стані рівноваги, впливати ззовні, то рівновага зміщується в бік тієї реакції, яка послаблює цей вплив.
Згідно з принципом Ле Шательє:
1) нагрівання сприяє перебігу ендотермічної, а охолодження екзотермічної реакцій;
2) підвищення тиску зумовлює зміщення рівноваги в бік утворення тих речовин, які займають менший об'єм, а зниження тиску у протилежний бік. Якщо об'єм системи під час реакції не змінюється, то тиск не впливає на стан рівноваги;
3) введення в систему додаткової кількості будь-якого з реагентів викликає зміщення рівноваги в тому напрямку, в якому його концентрація зменшується. У зв’язку з цим введення в систему вихідних речовин зміщує рівновагу в бік утворення продуктів реакції, а збільшення концентрації продуктів реакції у бік утворення вихідних речовин;
4) однаково прискорюючи як пряму, так і зворотну реакції, каталізатор сприяє швидкому встановленню рівноваги, не впливаючи на рівноважні концентрації речовин.
Принцип Ле Шательє дає змогу передбачити напрямок реакції за різних умов і, отже, керувати їх перебігом. Він справджується не тільки для хімічних процесів, а має загальнонаукове значення і поширюється на всі процеси, які перебувають у стані динамічної рівноваги.
На практиці принцип Ле Шателье особливо важливий у харчовій промисловості. Визначаючи положення рівноваги для різних температур і тиску, можна вибрати найсприятливіші умови проведення технологічного процесу: необхідно, щоб досягався максимально можливий вихід продукту (зміщення хімічної рівноваги) за найбільшої швидкості його утворення.
Підсумки Необхідно зрозуміти
1. Для характеристики хімічної реакції необхідно знати основні закономірності її перебігу за певний час, мати дані про швидкість і механізм процесу.
2. Швидкість хімічних реакцій залежить від природи реагуючих речовин, їх концентрацій, температури, наявності каталізатора та деяких інших зовнішніх факторів.
3. Енергія активації – важлива характеристика хімічних перетворень. Саме вона затримує чи робить неможливими багато реакцій, які з позиції термодинаміки можуть відбуватися самочинно.
4. Хімічна рівновага зміщується тому, що зміна умов неоднаково впливає на швидкість прямої та зворотної реакцій.
Треба вміти
1. Обчислювати швидкість хімічної реакції за законом діючих мас.
2. Визначати залежність швидкості хімічної реакції від температури, застосовуючи емпіричне правило Вант-Гоффа.
3. Визначати характер зміщення хімічної рівноваги під дією зміни зовнішніх факторів.
