
- •Модуль 1 атомно-молекулярне вчення. Класифікація неорганічних сполук
- •1.1. Основні поняття та закони хімії
- •1.1.1. Ключові положення атомно-молекулярного вчення
- •1.1.2. Поняття загальної хімії
- •1.1.3. Фізичні величини, що застосовуються в хімії
- •Моль – це кількість речовини, яка містить стільки часток – структурних елементів, скільки атомів міститься в ізотопі Карбону с12 масою 0,012 кг.
- •1.1.4. Основні закони хімії
- •М.В. Ломоносов
- •Ж. Пруст
- •Наприклад, у реакції
- •А. Авогадро
- •2) Фактор еквівалентності може дорівнювати 1 і бути меншим за 1.
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •1.2. Основні класи неорганічних сполук
- •1.2.1. Класифікація неорганічних сполук
- •1.2.2. Оксиди
- •1.2.3. Основи
- •1.2.4. Кислоти
- •1.2.6. Генетичний зв’язок між класами неорганічних сполук
- •Класами неорганічних сполук
- •Підсумки
- •Задачі для самостійного розв’язування
- •Модуль 2 будова речовини
- •2.1. Будова атома
- •2.1.1. Складність будови атома та її експериментальне доведення
- •2.1.2. Перші моделі атома
- •Е. Резерфорд
- •2.1.3. Атомні спектри
- •2.1.4. Квантова теорія світла
- •2.1.5. Основні положення теорії будови атома Бора
- •2.1.6. Хвильова природа електрона. Електронні хмари
- •2.1.7. Квантові числа
- •Орієнтація s-, p- I d-орбіталей
- •2.1.8. Принцип Паулі
- •2.1.9. Послідовність заповнення електронами енергетичних рівнів у багатоелектронних атомах
- •Підсумки
- •Д. І. Менделєєв
- •2.2.3. Періодичність властивостей хімічних елементів
- •Спорідненістю до електрона (f) називається енергетичний ефект процесу приєднання електрона до нейтрального атома е з перетворенням його на негативний іон е-:
- •Підсумки
- •2.3.1. Іонний зв’язок
- •2.3.2. Ковалентний зв’язок
- •І електронів у молекулі водню н:h
- •Підсумки
- •Задачі для самостійного Розв’язування
- •Модуль 3 Закономірності перебігу хімічних реакцій
- •3.1.Хімічна термодинаміка
- •3.1.1. Теплові ефекти. Внутрішня енергія та ентальпія
- •Термодинаміки
- •Г. І. Гесс
- •1. Тепловий ефект хімічної реакції дорівнює сумі теплових ефектів її проміжних стадій.
- •3. Тепловий ефект хімічної реакції дорівнює різниці між сумою теплот утворення продуктів реакції і сумою теплот утворення вихідних речовин з урахуванням числа молів цих речовин.
- •3.1.2. Напрямленість процесів. Ентропія. Ізобарно-ізотермічний потенціал
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •3.2. Хімічна кінетикА та рівновага
- •3.2.1. Предмет хімічної кінетики
- •3.2.2. Швидкість хімічних реакцій
- •Речовин під час перебігу реакції
- •Залежність швидкості реакції від концентрації реагуючих речовин закон діючих мас
- •3.2.4. Вплив температури на швидкість реакцій. Енергія активації
- •3.2.5. Каталіз
- •3.2.6. Хімічна рівновага
- •Оборотної реакції
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •Приклади розв’язування задач
- •V(t2)моль/лхв.
- •Задачі для самостійного розв’язування
- •Модуль 4 Розчини. Теорія електролітичної дисоціації
- •4.1. Основні поняття про розчини
- •4.1.1. Термінологія, що використовується в теорії розчинів
- •4.1.2. Концентрація розчинів та способи її вираження
- •4.1.3. Колігативні властивості розчинів. Осмос
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •4.2. Теорія електролітичної дисоціації
- •4.2.1. Теорія електролітичної дисоціації Арреніуса
- •4.2.2. Реакції в розчинах електролітів. Іонні рівняння
- •4.2.3.Константа електролітичної дисоціації
- •4.2.4. Властивості розчинів сильних електролітів
- •4.2.5. Добуток розчинності
- •4.2.6. Дисоціація води. Іонний добуток води. Водневий показник
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •4.3. Гідроліз
- •4.4. Окисно-відновні реакції
- •Практичні заняття приклади розв’язування задач (до розділу 4.14.2)
- •Задачі для самостійного розв’язування
- •Приклади розв’язування задач (до розділу 4.3)
- •4. Розрахувати рН середовища під час взаємодії з водою амоній ціаніду.
- •Задачі для самостійного розв’язування
- •Приклади розв’язування задач (до розділу 4.4)
- •2. Підібрати коефіцієнти у схемі окисно-відновної реакції
- •Задачі для самостійного розв’язування
- •Предметний покажчик
- •Список рекомендованої літератури
3.2.2. Швидкість хімічних реакцій
Хімічні перетворення відбуваються в разі зіткнення молекул, якщо в результаті цього перебудовуються хімічні зв’язки, тобто зв’язки у вихідних молекулах розриваються, а нові утворюються. Швидкість хімічної реакції характеризує інтенсивність хімічного процесу, тобто число елементарних актів взаємодії чи розкладу за одиницю часу в одиниці об’єму (для гомогенних реакцій) чи на одиницю поверхні поділу фаз (для гетерогенних).
Для гомогенних процесів, які відбуваються без зміни об’єму, швидкість хімічної реакції визначають як зміну концентрацій реагуючих речовин чи продуктів реакції за одиницю часу.
Зміна концентрацій дорівнює різниці між концентрацією С2, яка відповідає моменту часу t2, і вихідною (початковою) концентрацією С1 у момент часу t1. Тоді середня швидкість реакції дорівнює
v![]()

Концентрація речовин у процесі реакції весь час змінюється, а це впливає на її швидкість, тому слід розглядати миттєву швидкість реакції, тобто швидкість у даний момент часу. Для гомогенних реакцій – це похідна концентрації за часом:
v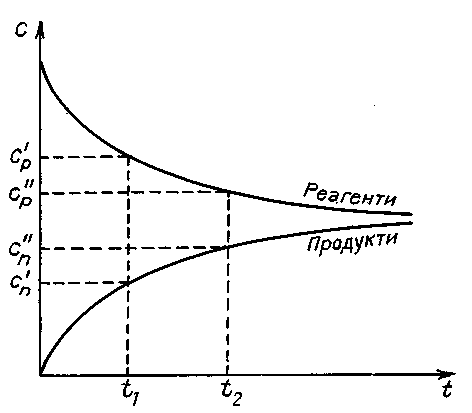

О
Рис. 15. Зміна концентрацій
Речовин під час перебігу реакції
кривої залежності концентрації від часу:
v = tg a.
Швидкість хімічних реакцій залежить від природи реагуючих речовин, їх концентрації, температури, наявності каталізатора та деяких інших зовнішніх факторів.
Залежність швидкості реакції від концентрації реагуючих речовин закон діючих мас
Необхідною умовою перебігу хімічної реакції між двома речовинами є зіткнення їх молекул. Швидкість хімічної реакції залежить від числа таких зіткнень в одиниці об’єму. Ймовірність зіткнення взаємодіючих молекул для гомогенної реакції пропорційна концентраціям реагуючих речовин.
Таким чином, швидкість хімічної реакції пропорційна добутку концентрацій реагуючих речовин у степенях, які дорівнюють коефіцієнтам, що стоять перед формулами речовин у відповідному рівнянні реакції.
Ця закономірність була встановлена експериментально в 1867 р. Гульбер-
бергом і Вааге і називається законом діючих мас (ЗДМ). Діючими масами на той час називали концентрації речовин.
Для взаємодії двох молекул, наприклад водню та йоду, за рівнянням
Н2 + I2 = 2HI,
в елементарному акті якої беруть участь по одній молекулі, ЗДМ у математичній формі має такий вигляд:
v = kC(H2)C(I2).
Для реакції
2NO + Cl2 = 2NOCl
швидкість v = kC2(NO)C(I2).
Для загальної реакції
aA + bB = cC + dD
швидкість дорівнює
v = kCa(A)Cb(B) = k[A]a[B]b.
Величина k – коефіцієнт пропорційності між швидкістю і концентрацією називається константою швидкості реакції. Вона чисельно дорівнює швидкості реакції, якщо концентрація відповідних речовин дорівнює одиниці. Константа швидкості за сталої температури величина стала і характеризує природу реагуючих речовин.
Константа швидкості дорівнює швидкості реакції за умови, що концентрації реагуючих речовин становлять 1 моль/л.
Рівняння, що пов’язує швидкість реакції з концентраціями реагентів, називають рівнянням швидкості або кінетичним рівнянням реакції.
Для більшості хімічних реакцій сумарне стехіометричне рівняння не відображає дійсного механізму процесу (проміжних стадій), а є загальним виразом для вихідних речовин і продуктів реакції. При цьому показники степеня в законі діючих мас не дорівнюють стехіометричним коефіцієнтам і мають формальний характер.
Розглянемо простий приклад. Фотохімічний розклад газоподібного НBr відбувається за стехіометричним рівнянням
2HBr(г) = Н2(г) + Br2(г).
Відомо, що в механізмі цієї реакції немає стадії взаємодії двох молекул HBr. Насправді дана фотохімічна реакція здійснюється таким чином:
HBr +hv = H + Br;
H + HBr = H2 + Br;
Br + Br = Br2.
Отже, ніякого зв’язку між стехіометрією рівняння і механізмом реакції, як і між стехіометричними коефіцієнтами і показниками степенів у кінетичному рівнянні, зовсім немає. Схожість, що спостерігається для деяких реакцій, має ви-падковий характер.
Перебіг більшості хімічних реакцій полягає в тому, що утворення продуктів відбувається через ряд проміжних елементарних стадій (послідовних чи пара-лельних), які можна вважати елементарними реакціями. Кожна з цих реакцій описується кінетичним рівнянням. У таких випадках залежність швидкості від концентрації може виявитися дуже складною. Ситуація спрощується, коли яка-небудь із цих стадій відбувається набагато повільніше інших. Тоді набуває чинності один із найважливіших принципів кінетики – принцип лімітуючої стадії: швидкість складної реакції визначається швидкістю найповільнішої (лімітуючої) елементарної стадії.
Сума показників степенів у рівнянні швидкості хімічної реакції (кінетичному рівнянні) є важливою характеристикою механізму процесу й називається порядком хімічної реакції. Окремі показники ступенів концентрацій реагентів визначають порядок реакції щодо даної речовини.
Елементарний акт реакції відбувається внаслідок зіткнення молекул. Для характеристики механізму реакцій застосовують поняття молекулярності реакції.
Число молекул, які беруть участь в елементарному акті реакції, називають молекулярністю реакції.
Реакція, для перебігу якої необхідна тільки одна молекула, називається мономолекулярною реакцією. Це реакція розкладу чи перегрупування, наприклад:
I2 = 2I;
N2O5 = 2NO2 + 1/2O2.
Для елементарного акту бімолекулярної реакції потрібна наявність двох часток (молекул, іонів, атомів):
H2 + I2 = 2HI.
У ході тримолекулярної реакції взаємодіють одночасно три молекули (такі реакції спостерігаються дуже рідко):
2NO + O2 = 2NO2.
Реакцій, молекулярність яких більше трьох, не буває, оскільки одночасне зіткнення в одній точці чотирьох і більше молекул малоймовірне. Фактично всі реальні хімічні реакції дуже прості, не враховуючи іноді складних сумарних стехіометричних рівнянь. Таким чином, сумарна форма рівняння хімічної реакції не відображає складності й багатостадійності процесу, який може складатися з декількох елементарних реакцій різного порядку.
