
- •Модуль 1 атомно-молекулярне вчення. Класифікація неорганічних сполук
- •1.1. Основні поняття та закони хімії
- •1.1.1. Ключові положення атомно-молекулярного вчення
- •1.1.2. Поняття загальної хімії
- •1.1.3. Фізичні величини, що застосовуються в хімії
- •Моль – це кількість речовини, яка містить стільки часток – структурних елементів, скільки атомів міститься в ізотопі Карбону с12 масою 0,012 кг.
- •1.1.4. Основні закони хімії
- •М.В. Ломоносов
- •Ж. Пруст
- •Наприклад, у реакції
- •А. Авогадро
- •2) Фактор еквівалентності може дорівнювати 1 і бути меншим за 1.
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •1.2. Основні класи неорганічних сполук
- •1.2.1. Класифікація неорганічних сполук
- •1.2.2. Оксиди
- •1.2.3. Основи
- •1.2.4. Кислоти
- •1.2.6. Генетичний зв’язок між класами неорганічних сполук
- •Класами неорганічних сполук
- •Підсумки
- •Задачі для самостійного розв’язування
- •Модуль 2 будова речовини
- •2.1. Будова атома
- •2.1.1. Складність будови атома та її експериментальне доведення
- •2.1.2. Перші моделі атома
- •Е. Резерфорд
- •2.1.3. Атомні спектри
- •2.1.4. Квантова теорія світла
- •2.1.5. Основні положення теорії будови атома Бора
- •2.1.6. Хвильова природа електрона. Електронні хмари
- •2.1.7. Квантові числа
- •Орієнтація s-, p- I d-орбіталей
- •2.1.8. Принцип Паулі
- •2.1.9. Послідовність заповнення електронами енергетичних рівнів у багатоелектронних атомах
- •Підсумки
- •Д. І. Менделєєв
- •2.2.3. Періодичність властивостей хімічних елементів
- •Спорідненістю до електрона (f) називається енергетичний ефект процесу приєднання електрона до нейтрального атома е з перетворенням його на негативний іон е-:
- •Підсумки
- •2.3.1. Іонний зв’язок
- •2.3.2. Ковалентний зв’язок
- •І електронів у молекулі водню н:h
- •Підсумки
- •Задачі для самостійного Розв’язування
- •Модуль 3 Закономірності перебігу хімічних реакцій
- •3.1.Хімічна термодинаміка
- •3.1.1. Теплові ефекти. Внутрішня енергія та ентальпія
- •Термодинаміки
- •Г. І. Гесс
- •1. Тепловий ефект хімічної реакції дорівнює сумі теплових ефектів її проміжних стадій.
- •3. Тепловий ефект хімічної реакції дорівнює різниці між сумою теплот утворення продуктів реакції і сумою теплот утворення вихідних речовин з урахуванням числа молів цих речовин.
- •3.1.2. Напрямленість процесів. Ентропія. Ізобарно-ізотермічний потенціал
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •3.2. Хімічна кінетикА та рівновага
- •3.2.1. Предмет хімічної кінетики
- •3.2.2. Швидкість хімічних реакцій
- •Речовин під час перебігу реакції
- •Залежність швидкості реакції від концентрації реагуючих речовин закон діючих мас
- •3.2.4. Вплив температури на швидкість реакцій. Енергія активації
- •3.2.5. Каталіз
- •3.2.6. Хімічна рівновага
- •Оборотної реакції
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •Приклади розв’язування задач
- •V(t2)моль/лхв.
- •Задачі для самостійного розв’язування
- •Модуль 4 Розчини. Теорія електролітичної дисоціації
- •4.1. Основні поняття про розчини
- •4.1.1. Термінологія, що використовується в теорії розчинів
- •4.1.2. Концентрація розчинів та способи її вираження
- •4.1.3. Колігативні властивості розчинів. Осмос
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •4.2. Теорія електролітичної дисоціації
- •4.2.1. Теорія електролітичної дисоціації Арреніуса
- •4.2.2. Реакції в розчинах електролітів. Іонні рівняння
- •4.2.3.Константа електролітичної дисоціації
- •4.2.4. Властивості розчинів сильних електролітів
- •4.2.5. Добуток розчинності
- •4.2.6. Дисоціація води. Іонний добуток води. Водневий показник
- •Підсумки Необхідно зрозуміти
- •Треба вміти
- •Слід запам’ятати
- •4.3. Гідроліз
- •4.4. Окисно-відновні реакції
- •Практичні заняття приклади розв’язування задач (до розділу 4.14.2)
- •Задачі для самостійного розв’язування
- •Приклади розв’язування задач (до розділу 4.3)
- •4. Розрахувати рН середовища під час взаємодії з водою амоній ціаніду.
- •Задачі для самостійного розв’язування
- •Приклади розв’язування задач (до розділу 4.4)
- •2. Підібрати коефіцієнти у схемі окисно-відновної реакції
- •Задачі для самостійного розв’язування
- •Предметний покажчик
- •Список рекомендованої літератури
2.3.2. Ковалентний зв’язок
Якщо ядра атомів діють на зовнішні електрони з близькою за величиною силою, створюється рівноважна система, у якій має місце збалансоване притягання протилежно заряджених часток і відштовхування однаково заряджених. У цьому випадку реалізовується так званий ковалентний зв’язок.
 Уперше
на прикладі водню В. Гайтлер і Ф. Лондон
розглянули такий варіант взаємодії
атомів. На рис. 12 показана запропонована
ними схема сукупних взаємодій протонів
і електронів у молекулі водню.
Уперше
на прикладі водню В. Гайтлер і Ф. Лондон
розглянули такий варіант взаємодії
атомів. На рис. 12 показана запропонована
ними схема сукупних взаємодій протонів
і електронів у молекулі водню.
Я
Рис.12. Схема взаємодій
протонів
І електронів у молекулі водню н:h
У подальшому уявлення В.Гайтлера і Ф.Лондона щодо механізму утворення ковалентного зв’язку в молекулі водню були застосовані й до більш складних молекул.
Виходячи з такої схеми ковалентний зв’язок спочатку зображали у вигляді двох крапок між символами атомів, які хімічно взаємодіють між собою:
.

,

Залежно від того, які орбіталі (s, p, d, f) і як взаємодіють між собою, можуть утворюватись різні типи ковалентного зв’язку: , чи .
У випадку утворення -зв’язку електронні хмари мають лише одну зону перекриття:

s s (s,s)

p s (p,s)

p p (p,p)

d s (d,s)
У процесі утворення -зв’язку електронні хмари мають дві зони перекриття. Такий варіант взаємодії зі зрозумілих геометричних міркувань можливий для p, d та f електронів:

p p (p,p)

p d (p,d)
Більш складні за формою d і f електронні хмари можуть мати 4 зони перекриття. У цьому випадку утворюється -зв’язок, зумовлений перекриттям усіх пелюстків орбіталей, розміщених у паралельних площинах.
Якщо ковалентний зв’язок утворюють однакові атоми, то сумісна електронна пара симетрично й рівномірно розташовується між їх ядрами (рис. 12, а). Такий зв’язок є неполярний. Коли взаємодіють атоми різних хімічних елементів, то задіяні в утворенні зв’язку валентні електрони з різною силою притягуються ядрами, внаслідок чого відбувається зміщення електронної пари в бік більш активного атома (рис. 12, б). Такий зв’язок називається полярним.
|
Н–Н |
НHCl |
|
|
|
|
|
|
|
q1 = q2 = qe |
q1 q2 |
а б
Рис. 12. Розподіл заряду сумісної електронної пари в молекулах:
а – Н2; б – HСl
Кількісно ступінь полярності ковалентного зв’язку оцінюють, з одного боку, за величиною набутого атомами надлишку електронного заряду, а з іншого – його дефіциту. Для цього застосовують співвідношення
![]()
яке називають ефективним зарядом.
У випадку молекули HCl Н = +0,17, Cl = 0,17. Під час переходу від HCl до молекули H2S полярність одиничного ковалентного зв’язку HS зменшується, а ефективний заряд атома Сульфуру порівняно з атомом Хлору збільшується: Н = +0,1, S = 0,2.
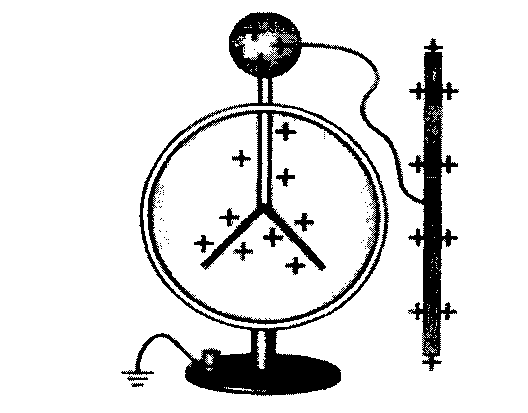
Полярність ковалентного зв’язку впливає, а інколи й дуже суттєво, на геометрію молекули, якщо в ній більше ніж два атоми. Ті атоми, які набувають однакового за знаком заряду, відштовхуються один від одного, як пелюстки в електрометрі (рис. 13). Чим більший заряд локалізується на атомах, тим більшими стають сили відштовхування і валентний кут .
|
а
|
О=
Н= + Н= +
б |
Рис. 13. Ефект електростатичної взаємодії:
а – велектрометрі; б – у молекулі води
Так, в ряді молекул H2Te, H2Se, H2S, H2O величина збільшується від 90 до 104,5 пропорційно збільшенню ефективного заряду на атомах Гідрогену (табл. 6).
Таблиця 6. Значення валентних кутів
|
Сполука |
H2Te |
H2Se |
H2S |
H2O |
|
Кут, |
90 |
91 |
92,2 |
104,5 |
У наведеній групі молекул атоми центрального елемента (Te, Se, S, O) для взаємодії з атомами Гідрогену використовують два валентні р-електрони, а вони, як відомо, розташовані в просторі під кутом 90. Таким чином, якби атоми Гідрогену не відштовхувались один від одного, то валентний кут у молекулах типу H2E становив би 90. Відносно цього кута можна розрахувати збільшення і зіставити з величиною Н.
Слід звернути увагу на те, що відштовхування атомів у складних молекулах не лише збільшує валентний кут, а і впливає на енергетику й геометрію зв’язувальних молекулярних орбіталей, тобто -зв’язків. Інколи деформація буває настільки значною, що форма кінцевої молекулярної орбіталі повністю відрізняється від вихідної. У такому випадку говорять про гібридизацію -зв’язків.
Наочно гібридизаційний ефект можна продемонструвати на класичному прикладі молекули метану. У ній атом Карбону для взаємодії з атомами Гідрогену в збудженому стані використовує один s і три р валентні електрони. У разі відсутності відштовхування полярних фрагментів у молекулі СН4 утворились би три (s,p)-зв’язки і один (s,s)-зв’язок, які мають принципово різну форму (див. схеми різних типів зв’язків). Замість цього утворюються чотири усереднені рівноцінні зв’язки нової форми.
За типом і кількістю валентних атомних електронів, задіяних в утворенні такого виду зв’язків, характеризують тип гібридизації. Так, у молекулі СН4 має місце sp3-гібридизація, у молекулі BF3 sp2-гібридизація, у молекулі BeF2 – sp-гібридизація. Установити факт гібридизації можна за величиною валентного кута (табл. 7)
Таблиця 7. Типи молекулярних структур
|
Тип гібридизації |
sp3 |
sp2 |
sp |
|
Валентний кут |
10928 |
120 |
180 |
|
Структура |
тетраедрична |
плоска трикутна |
лінійна |
|
Приклад |
СH4, NH4+ |
BF3, H3O+ |
BeF2, CO2 |
У тих випадках, коли валентний кут наближається до вказаного в табл. 7, теж говорять про наявність гібридизації зв’язків. Так, у молекулі аміаку =10729 і це дає змогу характеризувати її як тетраедричну структуру, у якій четвертим фрагментом є пара s-електронів атома Нітрогену.
У молекулі РН3 =94, що вказує на деяку деформацію -зв’язків, однак, не настільки сильну, щоб говорити про їх гібридизацію. У зв’язку з цим молекула фосфіну має пірамідальну структуру.








 О
О Н
Н
Н
Н