
- •Самостоятельная работа № 1 по химии
- •§ 1. Методические указания к изучению темы «Основные химические понятия и законы химии»
- •Раздел 2. Обучающие примеры с алгоритмами решения по теме «Основные химические понятия и законы химии» Пример 1. Определение молярной массы вещества и абсолютной массы молекулы вещества
- •Пример 2. Определение эквивалента и молярной массы эквивалента вещества
- •Пример 3. Определение формулы химического вещества
- •Пример 4. Комплексные задачи с использованием большинства законов стехиометрии
- •Раздел 3. Приобретение компетенций и закрепление навыков
- •А) Домашнее задание для закрепления навыков решения задач (Трудоемкость задания – 5 баллов)
Пример 2. Определение эквивалента и молярной массы эквивалента вещества
1. Определите эквиваленты, количество вещества эквивалентов и молярные массы эквивалентов серной кислоты и железа (3) гидроксида в реакциях:
 (1)
(1)
 (2)
(2)
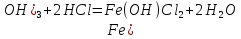 (3)
(3)
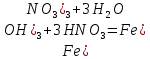 (4)
(4)
 (5).
(5).
Решение. В уравнении (1) в реакцию
нейтрализации вступает один ион молекулы кислоты, следовательно,
молекулы кислоты, следовательно,
 .
.
Количество вещества эквивалентов серной
кислоты в этой реакции и молярная масса
эквивалентов
 определяются по формулам:
определяются по формулам:
 (
( )
=
)
= (
( )
= 1 моль;
)
= 1 моль; (
( )
=
)
= (
( )·
)· (
( ).
).
Учитывая,
что
 (
( )=
2·1 + 32 + 4·16 = 98, и, следовательно,
)=
2·1 + 32 + 4·16 = 98, и, следовательно, (
( )
) ,
получим
,
получим
 (
( )
=
)
= = 98
= 98 .
.
В уравнении (2) в реакцию с металлическим
цинком вступают 2 иона молекулы кислоты, следовательно,
молекулы кислоты, следовательно,
 и
и (
( )
= ½.
)
= ½.
Тогда количество вещества эквивалентов
серной кислоты в этой реакции и молярная
масса эквивалентов
 будут равны:
будут равны:
 (
( )
= ½·1 = ½ моль;
)
= ½·1 = ½ моль; (
( )
= ½·98(
)
= ½·98( )
= 49
)
= 49 .
.
В уравнении (3) в реакцию с двумя
ионами от двух молекул соляной кислоты вступила
одна молекула железа (3) гидроксида,
следовательно,
от двух молекул соляной кислоты вступила
одна молекула железа (3) гидроксида,
следовательно,
 и
и .
.
Тогда
 = ½·1 = ½ моль;
= ½·1 = ½ моль; = ½·
= ½· (
( ).
).
Зная, что
 = 56 + (16+1)·3 = 107 и, следовательно,
= 56 + (16+1)·3 = 107 и, следовательно, = 107 г/моль, получим:
= 107 г/моль, получим: = ½·107(г/моль) = 53,5 г/моль.
= ½·107(г/моль) = 53,5 г/моль.
В уравнении (4) одна молекула железа
(3) гидроксида взаимодействует с тремя
ионами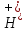 ,
следовательно, Э(
,
следовательно, Э( )
= ⅓
)
= ⅓ и
и (
( )
= ⅓. Тогда
)
= ⅓. Тогда
 (
(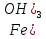 )
= ⅓·1 = ⅓ моль;
)
= ⅓·1 = ⅓ моль; (
( )
= ⅓·107(г/моль) = 36 г/моль.
)
= ⅓·107(г/моль) = 36 г/моль.
В уравнении (5) с двумя ионами одной молекулы серной кислоты
взаимодействуют 2 молекулы железа (3)
гидроксида. Следовательно, в этой реакции
Э(
одной молекулы серной кислоты
взаимодействуют 2 молекулы железа (3)
гидроксида. Следовательно, в этой реакции
Э( )
=
)
= ;
; (
( )
= 1. Зато
)
= 1. Зато и
и (
( )
= ½. Тогда
)
= ½. Тогда
 (
( = 1моль;
= 1моль; = 107 г/моль;
= 107 г/моль;
 (
( )
= ½·1 моль = 0,5 моль;
)
= ½·1 моль = 0,5 моль; (
( )
=
)
=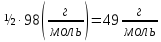 .
.
Ответ: В уравнении (1) Э( )
=
)
=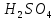 ;
; (
( )
= 1 моль;
)
= 1 моль; (
( )
= 98 г/моль. В уравнениях (2) и (5)
Э(
)
= 98 г/моль. В уравнениях (2) и (5)
Э( )
= ½
)
= ½ ;
; (
( )
= 0,5 моль;
)
= 0,5 моль; (
( = 49 г/моль. В уравнении (3) Э(
= 49 г/моль. В уравнении (3) Э(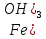 )
= ½
)
= ½ ;
; (
( )
= 0,5 моль;
)
= 0,5 моль; (
( )
= 53,5 г/моль. В уравнении (4) Э(
)
= 53,5 г/моль. В уравнении (4) Э( )
= ⅓
)
= ⅓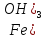 ;
; (
( )
= 0,3 моль;
)
= 0,3 моль; (
( )
= 36 г/моль.
)
= 36 г/моль.
2.Из 3,85 г соли металла нитрата
получено 1,60 г его гидроксида. Определите
молярную массу эквивалентов металла )
в его соединениях.
)
в его соединениях.
Решение. Вспомним следствие из закона эквивалентов: молярная масса эквивалентов химического соединения всегда равна сумме молярных масс эквивалентов составляющих это соединение частей. Следовательно,
 и
и .
.
Ионы
 и
и эквивалентны одному иону водорода
эквивалентны одному иону водорода ,
следовательно,
,
следовательно, ;
; .
.
С другой стороны, согласно закону эквивалентов:
 .
.
Используя значения
 и
и ,
получим:
,
получим:
 .
.
Подставляя в это выражение данные из
условия задачи и значения молярных масс
ионов ( и
и ),
получим окончательное уравнение для
расчета:
),
получим окончательное уравнение для
расчета:
 .
.
Решая уравнение относительно
 ,
получим величину молярной массы
эквивалента металла:
,
получим величину молярной массы
эквивалента металла: .
.
Ответ: .
.
3. Вычислите объем газообразного водорода (при нормальных условиях), который потребуется для получения количества вещества эквивалентов аммиака, равного 4 моль.
Решение.I-й способ.Составим уравнение реакции синтеза аммиака
 .
.
По химическим формулам реагента ( )
и продукта (
)
и продукта ( )
можно определить их молярные объемы
эквивалентов:
)
можно определить их молярные объемы
эквивалентов:
 .
.
Аналогично  .
.
Зная по условию задачи количество вещества эквивалентов аммиака, образовавшегося в реакции, можно определить объем выделившегося аммиака:
 .
.
Применим к химическому уравнению реакции
закон эквивалентов и, заменив массы
реагирующих веществ и продуктов реакции
их объемами, получим выражение:
 .
.
Преобразовав его относительно
 )
и подставив полученные значения остальных
переменных, рассчитаем объем вступившего
в реакцию водорода:
)
и подставив полученные значения остальных
переменных, рассчитаем объем вступившего
в реакцию водорода:
 .
.
II-й способ. Поскольку
вещества взаимодействуют в эквивалентных
количествах, то для образования 4 моль
эквивалентов аммиака понадобилось 4
моль эквивалентов водорода, т.е. .
И тогда
.
И тогда
 .
.
Ответ: .
.
4.Определите, какую массу цинка
растворили в кислоте, если объем
выделившегося водорода при температуре
291 и его парциальном давлении 101,3 кПа
оказался равным 119,4 мл.
и его парциальном давлении 101,3 кПа
оказался равным 119,4 мл.
Решение. Вначале находим объем,
который занимает 119,4 мл водорода при
нормальных условиях, применив объединенный
газовый закон: .
.
Преобразовав его относительно
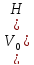 ),
и подставив известные значения, получим:
),
и подставив известные значения, получим:
 .
.
Теперь применим закон эквивалентов к
реакции вытеснения водорода металлом
из кислоты, схема процесса:  ,
,
заменив
массу водорода его объемом при н.у.
Выведем расчетную формулу, позволяющую
определить массу металла цинка,
вступившего в реакцию с кислотой:
 .
.
Зная, что молярный объем эквивалента
водорода
 и
и
 ,
окончательно получим:
,
окончательно получим:
 .
.
Ответ: в кислоте растворили 0,326 г цинка.
5. К раствору, содержащему 1 г азотной кислоты, прибавили 1 г натрия гидроксида. Определите реакцию среды полученного раствора.
Решение. Реакция среды раствора после смешивания кислоты и щелочи будет зависеть от того, какой из компонентов был взят в избытке. Из уравнения реакции нейтрализации

следует, что нейтральная среда будет в том случае, если кислота и щелочь смешаны в эквивалентных количествах.
Используя формулу
 ,
рассчитаем количество вещества
эквивалентов компонентов раствора до
реакции:
,
рассчитаем количество вещества
эквивалентов компонентов раствора до
реакции:
 ;
;
 .
.
Как показывают расчеты,
 был взят в избытке, следовательно,
реакция среды будет оснóвной.
был взят в избытке, следовательно,
реакция среды будет оснóвной.
Ответ: реакция среды оснóвная.
