
- •Частина і. Загальна патологія
- •1. Предмет, завдання і методи патологічної фізіології. Патологічна фізіологія як навчальна дисципліна
- •2 Загальна нозологія
- •8С Роль реактивності в патології
- •IV. За патогенезом:
- •I. Фізіологічний апоптоз відбувається:
- •II. Апоптоз в патологічних умовах може відбуватися:
- •12. Екстремальні стани
- •I. Зменшення об'єму циркулюючої крові:
- •II. Зменшення хвилинного об'єму серця:
- •IV. Порушення реологічних властивостей крові:
- •13. Місцеві розлади кровообігу Порушення мікроциркуляції
- •I. Патогенетична класифікація:
- •I. Периферичні механізми:
- •II. Периферично-центральні механізми:
- •I. Свд може виявлятися:
- •II. Свд може характеризуватися:
I. Фізіологічний апоптоз відбувається:
а) у період ембріогенезу (імплантація, органогенез, онтогенетична інволюція, метаморфоз) відповідно до генетичної програми знищення клітин, які вже більше не потрібні;
б) під час гормон-залежної інволюції органів у дорослих (загибель клітин ен-дометрію під час менструального циклу, атрезія фолікулів яєчника під час менопаузи, зменшення маси молочних залоз після припинення лактації);
в) у популяціях клітин з високою інтенсивністю проліферативних процесів для підтримання сталої кількості клітин (наприклад, у криптах слизової тонкої кишки);
г) у клітинах, що вже виконали свою функцію (у нейтрофілах по завершенню гострого запалення, у лімфоцитах у кінці імунної відповіді;
ґ) у потенційно небезпечних для організму лімфоцитах (клітинах так званих "заборонених клонів'1);
д) під час дії цитотоксичних Т-лімфоцитів (Т-кілерів) на уражені вірусами і пухлинні клітини.
II. Апоптоз в патологічних умовах може відбуватися:
а) унаслідок дії патогенних чинників, що спричиняють необоротне ушкодження ДНК (іонізуюча радіація, протипухлинні препарати);
б) в інфікованих вірусами клітинах (наприклад, при вірусному гепатиті);
в) у паренхіматозних органах у процесі розвитку атрофії, що виникає як наслідок обтурації їхніх вивідних проток (підшлункова і слинні залози);
г) у пухлинах — як під час їхньої регресії, так і в процесі активного росту;
ґ) під впливом чинників, що збільшують проникність мітохондріальних мембран.
11.23. Як здійснюється апоптоз?
Розрізняють три послідовні фази апоптозу. І. Фаза ініціювання. Суть її полягає в послідовній активації так званих "суїцид-них" ферментів — каспаз (їх сьогодні налічують понад 10). Існує два шляхи такої активації: зовнішній і внутрішній.
Зовнішній (рецепторопосередкований) шлях пов'язаний з існуванням на поверхні клітинної мембрани так званих "рецепторів смерті" (із сімейства рецепторів до фактора некрозу пухлин - ФНП). Взаємодія цих рецепторів з ФНП та деякими іншими лігандами спричиняється до появи в цитоплазмі (з внутрішнього боку плазматичної мембрани поблизу активованого рецептора) б ілка-п о середника, який активує протеазу- каспазу-8 (у людини- каспазу-10). Активна каспаза-8 започатковує каскад реакцій (у тому числі і аутокаталітичних), під час яких відбувається перетворення неактивних прокаспаз в активні каспази - ферменти, що "вбивають" клітину.
Внутрішній (мітохондріальний) шлях пов'язаний зі збільшенням проникності мітохондріальних мембран (утворенням "мітохондріальної пори") та виходом із мітохондрій у цитоплазму так званих проапоптичних сполук- цитохрому с,
апоптозіндукуючого фактора (АІФ) та ін. Утворення "мітохондріальної пори " відбувається внаслідок заміни антиапоптичних білків в мембрані мітохондрій на проапоптичні білки. Така заміна має місце тоді, коли припиняється дія на клітину факторів росту та інших стимуляторів клітинної активності. Цитохром с, потрапивши в цитоплазму, разом з білком цитозолю - апоптозактивуючим фактором (ААФ) утворює комплекс, який активує каспазу-9. Зазначена протеаза започатковує процес утворення інших активних каспаз (див. вище).
II. Фаза вбивання ("екзекуції"). У результаті наведених вище подій утворюються активні форми каспаз-екзекуторів (каспаза-3, каспаза-6 та ін.). Ці протеази: а) розщеплюють білки цитоскелета; б) руйнують білки матриксу ядра; в) активують цитоплазматичну ДНК-азу через розщеплення її білкового інгібітора. Унаслідок цього змінюються форма і об'єм клітини, ядро розпадається на окремі фрагменти, а сама клітина на так звані апоптичні тільця — утвори, що зовні мають мембрану, а всередині містять спресовані органели і окремі фрагменти ядра.
Ш. Фаза вилучення загиблих клітин. Здійснюється макрофагами шляхом фагоцитозу мертвих клітин і апоптичних тілець. Цьому сприяє вивільнення клітинами ще на ранніх фазах їхнього апоптозу речовин-хемотаксинів, а також поява на поверхні клітин, що гинуть, білків-маркерів, які дають змогу макрофагам розпізнавати мертві клітини серед ще живих. Важливе значення цього етапу полягає в тому, що своєчасний фагоцитоз загиблих клітин запобігає їхньому некрозу, виходу з клітин лізосомних ферментів і розвитку запалення.
11.24. Які захисно-компенсаторні механізми має ушкоджена клітина?
Все різноманіття захисно-компенсаторних реакцій клітини у відповідь на її ушкодження можна умовно розділити на дві групи.
I. Реакції, спрямовані на відновлення порушеного внутрішньоклітинного гомеостазу:
а) активація механізмів активного транспорту речовин (Na-K-, Са-насосів; Na-Ca-, Na-H-обмінних механізмів, мікровезикулярного транспорту);
б) посилення регенерації антиоксидантів;
в) зв'язування вільних жирових кислот (синтез тригліцеридів);
г) активація синтезу білків, нуклеїнових кислот, фосфоліпідів та ін. Неодмінною умовою реалізації цих механізмів є достатнє енергозабезпечення
клітини. Це досягається підвищенням інтенсивності енергетичного обміну (активація гліколізу, клітинного дихання, пентозного циклу) і перерозподілом наявних у клітин енергетичних ресурсів.
II. Реакції, спрямовані на створення функціонального спокою ушкодженої клітини. їхня мета полягає в тому, щоб усунути можливі додаткові зрушення внутрішньоклітинного гомеостазу при дії фізіологічних збуджувальних факторів (стабілізація ушкодження) і звести до мінімуму енергетичні витрати на виконання специфічних функцій клітини.
До таких реакцій можна віднести:
а) утворення клітиною простагландинів і блокада ними |3-адренорецепторів (рис. 37);
б) інгібування адеі-іілатциклази і підвищення активності фосфодіестерази, що руйнує цАМФ;
в) утворення аденозину - природного блокатора Са-каналів та ін.
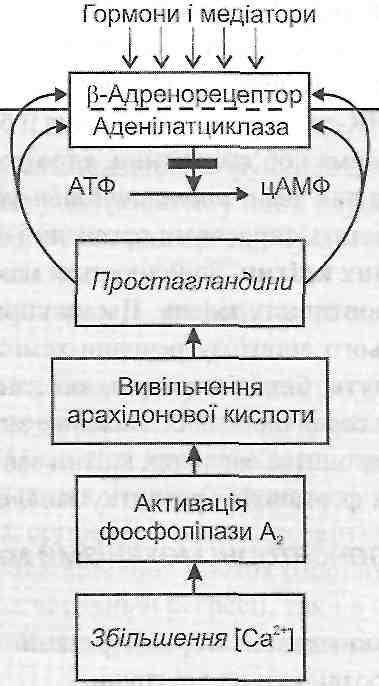
Рис. 37. Захисна роль простагландинів при ушкодженні клітини
11.25. Які існують підходи до патогенетичного лікування ушкоджених клітин?
Основні принципи впливу на ушкоджені клітини:
1) обмеження і пригнічення молекулярних механізмів ушкодження (блокада Са-каналів, застосування антиоксидантів, інгібіторів фосфоліпази А2 і протеаз, активація біосинтезу білків та ін.);
2) створення функціонального спокою (щадний режим, дієта, блокада клітинних рецепторів та ін.);
3) енергетичне й пластичне забезпечення гомеостатичних механізмів клітини (вплив на периферичний кровообіг і мікроциркуляцію з метою поліпшення доставки кисню і поживних речовин до ушкоджених клітин, введення енергетичних і пластичних субстратів).
