
Методы гистологической окраски
.pdf
04-044822
Гримелиус
Срок годности: 1 год Хранить при температуре 4°С
Реактивы
А. Раствор нитрата серебра, 30 мл В. Концентрированный ацетатный буферный раствор рН 5.6, 30 мл
C.Раствор гидрохинона,30 мл
D.Раствор натрия сульфита, 30 мл
E.Буферизированный раствор нитрата серебра, 30 мл
F. Раствор фиксатора, 30 мл |
|
Тонкая кишка |
Применение
Используется с целью выявления аргирофильных элементов в тканевых образцах. Метод основан на способности некоторых тканевых компонентов связывать соли серебра. В дальнейшем серебро переводится в восстановленную форму путем фотографического процесса. Селективность метода обусловлена низкой концентрацией солей серебра в рабочем растворе. Повторная непродолжительная импрегнация используется с целью преципитации дополнительных количеств на объекте окрашивания для его более четкой визуализации.
Внимание:
При всех реакциях с солями серебра необходимо использовать особо чистую стеклянную посуду и не допускать соприкосновения содержащих серебро реактивов с металлическими объектами (пинцетами и т.п.);
Использовать только дистиллированную или деионизированную воду; Не использовать фиксаторы с содержанием солей тяжелых металлов.
Описание метода
Поместить срезы в дистиллированную воду.
Смешать 40 мл дистиллированной воды, 10 капель реактива А и 10 капель реактива В и инкубировать при 60°С 3 ч. После инкубации оставить для охлаждения на 5 мин.
Не смывая, нанести на срез 10 капель реактива С и 10 капель реактива D, оставить на 5 мин.
Промыть срезы в дистиллированной воде.
Нанести на срез 10 капель реактива G, оставить на 5 мин.
Промыть срезы в дистиллированной воде.
Нанести на срез 10 капель реактива Е, оставить на 10 мин.
Не смывая подсушить срез и нанести на срез 10 капель реактива F, оставить на 5 мин.
Промыть в дистиллированной воде и нанести на срез 10 капель реактива G, оставить на 5 мин.
Промыть срезы в дистиллированной воде.
Дегидрировать в спиртах возрастающей концентрации, просветлить в ксилоле и заключить под покровное стекло.
Результаты
Аргирофильные гранулы |
от темно-коричневого до черного |
21

04-043823
Грокотт набор для визуализации мицелия
Срок годности: 1 год Хранить при температуре 4°С
Реактивы
А. Раствор хромовой кислоты, 30 мл В. Раствор натрия бисульфита, 30 мл C. Растворгексаметилентетрамина,30мл D. Раствор нитрата серебра, 30 мл E. Раствор бората натрия, 30 мл
F. Раствор хлорида золота, 30 мл
G. Раствор тиосульфата натрия, 30 мл
H. Раствор светового зеленого, 30 мл
Легкое
Применение
Выявление мицелия в тканевых образцах.
У большинства грибов клеточная стенка состоит из хитина - полимера N-ацетилглюкозамина, полимеров D-глюкозы и D-маннозы, белков и липидов. Хромовая кислота реагирует с гликолевыми и гликоаминными группами полисахаридной цепи, окисляя их до альдегидных групп с последующим разрывом цепи. Вновь образованные альдегиды восстанавливают серебро из хлорида серебра, являющегося частью комплекса серебро-метенамин, до металлического серебра, обеспе-
чивая тем самым его визуализацию.
Внимание:
Избегайте загрязнения образцов непатогенными грибами (работайте в перчатках, не допускать контакта с воздухом);
Используйте только свежую дистиллированную воду;
Используйте только чистую стеклянную посуду;
Избегайте попадания пыли на образец; Избегайте контакта реактивов с металлическими объектами (пинцетами и т.п.).
Описание метода
Поместить срезы в дистиллированную воду.
Нанести на срез 10 капель реактива А, оставить на 20 мин. Промыть срезы под проточной водой в течение нескольких секунд. Нанести на срез 10 капель реактива В, оставить на 1 мин. Промыть срезы в проточной воде в течение 5 мин.
Промыть срезы в четырех порциях дистиллированной воды.
В закрытый контейнер для препаратов налить 17 мл дистиллированной воды и добавить 20 капель реактива С, 10 капель реактива D и 20 капель реактива Е, перемешать стеклянной палочкой, предварительно вымытой в дистиллированной воде.
Поместить образцы в контейнер и инкубировать при 60°С на 1 час. Дать остыть в течение 10 мин.
Промыть срезы в шести порциях дистиллированной воды Нанести на срез 10 капель реактива F, оставить на 3 мин. Промыть срезы в дистиллированной воде.
Нанести на срез 10 капель реактива G, оставить на 5 мин. Промыть срезы под проточной водой.
Нанести на срез 10 капель реактива Н, оставить на 30 сек.
Дегидрировать в спиртах возрастающей концентрации, просветлить в ксилоле и заключить под покровное стекло.
Результаты
Мицелий |
четко выражен, черный |
Скопления крахмала |
темно-серые |
Фон |
зеленый |
22

04-001802
Набор для окраски «азаном» Гейденгайна
Срок годности: 2 год Хранить при температуре 15-25°С
Реактивы
А. Азокармин по Гейденгайну, 100 мл В. Спиртовой раствор анилина, 30 мл
C.Спиртовой раствор кислоты, 30 мл
D.Спиртовой раствор фосфорновольфрамовой кислоты, 100 мл
E.Полихромный раствор по Маллори, 100 мл. с подкрашиванием анили-
новым синим |
|
Яичник |
Применение
Рекомендован для окрашивания соединительной ткани, особенно для выявления мышечных волокон, глиальных волокон, коллагена, ретикулярных волокон, стромы почечных клубочков, эритроцитов и ядерного хроматина в тканевых образцах.
Метод основан на использовании двух кислотных красителей: азокармина и анилинового синего. Окраска азокармином комбинируется с подкрашиванием анилиновым синим после протравливания препаратов фосфорновольфрамовой кислотой. Для получения хорошего результата необходимо передержать препараты в азокармине, а потом медленно дифференцировать в анилиновом спирте для предупреждения перекрашивания мышц, коллагена и т. д.
Инструкция по использованию
Поместить срезы в дистиллированную воду.
Реактив А налить в колбу и инкубировать при t0= 560C 45 мин. Затем дать остыть при комнатной температуре и перелить обратно. Не фильтровать.
Промыть срезы в дистиллированной воде.
Нанести на срез 10 капель реактива В, оставить на 1 мин.
Слить избыток реагента и нанестина срез 10капель реактива С, оставить на 1 мин.
Поместить препараты в реактив D, перелитый в колбу, на 1 час. После использования вылить реактив D в исходную емкость, профильтровав через фильтровальную бумагу.
Повторить предыдущий шаг с реактивом Е.
Промыть срезы в этиловом спирте 95°.
Дегидрировать в спиртах возрастающей концентрации, просветлить в ксилоле и заключить под покровное стекло.
Результаты
Коллаген, ретикулярные волокна, базофильные гранулы клеток гипофиза, |
|
юкстагломерулярные гранулы, строма почечных клубочков |
темно-синий |
Нейроглия |
темно-красный |
Мышечная ткань |
оранжевый |
Хроматин, эритроциты, ацидофильные гранулы клеток гипофиза |
красный |
Цитоплазматические гранулы дельта клеток гипофиза |
голубой |
23

04-040801
Импрегнация серебром
Срок годности: 1 год Хранить при температуре 4°С
Реактивы
А. Раствор перманганата калия, 18 мл В. Активирующийкислотныйбуфер,18мл C. Раствор щавелевой кислоты, 30 мл D. Растворферроаммонийсульфата,30мл E. Раствор аммиачного серебра, 30 мл F. Нейтральныйрастворформалина,30мл G. Фиксирующий раствор гипосульфита
Миокард натрия, 30 мл
Применение
Рекомендован для выявления аргирофильных ретикулярных волокон в соединительной ткани. Четкая импрегнация в данном методе происходит по двум причинам: предварительная импрегнация с солями железа и использование в качестве источника серебра нестабильного диаминного комплекса (аммонийный раствор), который более реактивен, чем нитрат серебра.
Обработка трехвалентным железом: после предварительного окисления с перманганатом калия образец обрабатывается трехвалентным железом (ферроаммоний сульфат). Ионы железа, более реактивные, чем ионы серебра, быстро связываются с аффинными функциональными группами аргирофильных веществ.
Обработка аммонийным раствором: серебро в данном растворе присутствует в виде комплексного растворимого в воде оксида - [Ag(NH3)2]2 O. Катионы серебра из данного комплекса заменяют ионы железа в образцах. Затем муравьиный альдегид путем восстановления приводит к образованию металлического серебра, обеспечивая его отложение на аргирофильных структурах и визуализацию.
[Ag(NH3)2]2 O + HCHO = 2Ag + 4 NH3 + HCOOH
Невосстановленныйкомплексныйкатионудаляетсяприпомощитиосульфатанатрия(Na2S2O3) путем формирования растворимого комплекса, не подлежащего окислению.
Внимание:
Используйте только деионизированную, полностью очищенную от хлора воду;
Используйте особо чистую стеклянную посуду;
 Избегайте попадания пыли на образцы;
Избегайте попадания пыли на образцы;
 Не допускайте контакта реактивов с металлическими объектами (пинцетами и т.п.).
Не допускайте контакта реактивов с металлическими объектами (пинцетами и т.п.).
Описание метода
Поместить срезы в дистиллированную воду.
Нанести на срез 5 капель реактива А и 5 капель реактива В, оставить на 5 мин.
Промыть срезы в дистиллированной воде.
Нанести на срез 10 капель реактива С, оставить на 3 мин.
Нанести на срез 10 капель реактива D, оставить на 3 мин. Промыть срезы в дистиллирован-
ной воде.
Дважды промыть срезы в дистиллированной воде. Нанести на срез 10 капель реактива Е, оставить на 3 мин. Промыть срезы в дистиллированной воде.
Нанести на срез 10 капель реактива F, оставить на 5 мин. Дважды промыть срезы в дистиллированной воде. Нанести на срез 10 капель реактива G, оставить на 5 мин. Промыть срезы в проточной воде в течение 5 мин.
Дегидрировать в спиртах возрастающей концентрации, просветлить в ксилоле и заключить под покровное стекло.
Результаты
Ретикулярные и нервные волокна |
черные |
Соединительная ткань |
коричневая |
Коллаген |
золотисто-желтый |
24

04-170801
Набор по Косса
(демонстрация кальциевых депозитов в гистологических препаратах)
Срок годности: 1 год Хранить при температуре 4°С
Реактивы
А. Насыщенный раствор карбоната лития, 30 мл
В. Раствор нитрата серебра, 30 мл
C.Восстанавливающий раствор, 30 мл
D.Раствор натрия сульфата, 30 мл
E.Кармалаун Майера, 30 мл
Головной мозг
Применение
Демонстрация депозитов кальция в тканевых образцах. Метод основан на реакции замещения. Ткань обрабатывается раствором нитрата серебра; катионы серебра замещают кальций в депозитах с формированием солей серебра. Впоследствии производится восстановление серебра до металла с его визуализацией
CaCO3 + AgNO3 = Ag2CO3 + Ca(NO3)2
Ag2CO3 + 2H+ = 2Ag + H2O + CO2
С ионами серебра реагируют следующие кальциевые соли: карбонаты, фосфаты, оксалаты, сульфаты, ураты, хлориды, сульфоцианиды. Кальций в норме присутствует в тканях млекопитающих в форме карбонатов и фосфатов, поэтому данный метод может быть использован для их выявления. Чтобы избежать ошибочных результатов при нахождении в ткани мочевой кислоты и уратов, данные соли перед началом окрашивания переводятся в растворимую форму под воздействием насыщенного раствора карбоната лития.
Описание метода
Поместить срезы в дистиллированную воду.
Нанести на срез 10 капель реактива А., оставить на 10 мин.
Промыть срезы в дистиллированной воде.
Нанести на срез 10 капель реактива В, оставить на 1 час в темном помещении.
Промыть срезы в дистиллированной воде.
Нанести на срез 10 капель дистиллированной воды и добавить 10 капель реактива С, оставить на 5 мин (до момента почернения солей серебра).
Промыть срезы в дистиллированной воде.
Нанести на срез 10 капель реактива D, оставить на 5 мин.
Промыть срезы в дистиллированной воде.
Нанести на срез 10 капель реактива Е, оставить на 5 мин.
Промыть срезы в дистиллированной воде.
Дегидрировать в спиртах возрастающей концентрации, просветлить в ксилоле и заключить под покровное стекло.
Результаты
Кальциевые депозиты |
черные |
Ядра |
красные |
25
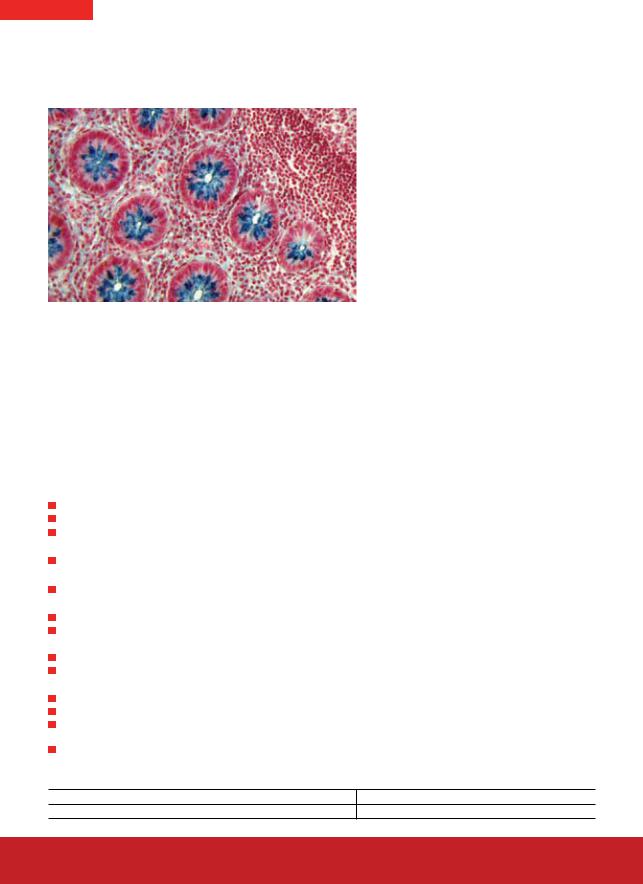
04-180809
Коллоидное железо по Моури
(набор для выявления кислых мукополисахаридов)
Срок годности: 1 год Хранить при температуре 15-25°С
Реактивы
А. Раствор уксусной кислоты, 30 мл В. Кислотный буфер, 18 мл
C. Раствор коллоидного железа, 18 мл D. Раствор уксусной кислоты, 30 мл E. Раствор уксусной кислоты, 30 мл F. Растворферроцианидакалия,12х10мл G. Соляная кислота 5М, 50 мл
H. Раствор ядерного прочного красного,
Аппендикс |
30 мл. |
|
Применение
Выявление кислых мукополисахаридов в тканях. Метод основан на взаимодействии коллоидного железа с кислотными группами мукополисахаридов при низких значениях рН с образованием хелатных соединений. Наглядно это демонстрируется реакцией с образованием берлинской лазури: ферроцианид калия взаимодействует с трехвалентным железом в кислой среде с образованием окрашенной соли.
4 Fe3+ + 3K4Fe(CN)6 = Fe4(Fe(CN)6)3 + 12 K+
берлинская лазурь
Внимание:
Избегайте попадания раствора ферроцианида калия на металлические предметы.
Описание метода
Поместить препараты в дистиллированную воду.
Нанести на препарат 10 капель реактива А, оставить на 2 мин.
Приготовитьинкубационныйконтейнер:надноналить1млдистиллированнойводы, нанестинапре-
парат по 5 капель реагентов В и С, поместить образцы в контейнер, закрыть и инкубировать 1 час. Слить избыток реагента и нанести на препарат 10 капель реактива D, оставить на
1 мин.
Слить избыток реагента и повторно нанести на препарат 10 капель реактива D,
оставить на 1 мин.
Слить избыток реагента и нанести на срез 10 капель реактива Е, оставить на 1мин.
Слить избыток реагента и повторно нанести на срез 10 капель реактива Е, оставить на 1 мин.
Просушить препараты.
В колбу вылить весь реагент F, добавить 30 мл дистиллированной воды и 4 мл реактива G,
осторожно перемешать и поместить туда препараты на 10 мин. Нанести на срезы 10 капель реактива H, оставить на 5 минут Промыть препараты в дистиллированной воде.
Дегидрировать в спиртах возрастающей концентрации, просветлить в ксилоле и заключить
под покровное стекло.
Промыть препараты в дистиллированной воде
Результаты
Кислые мукополисахариды |
синие |
Ядра |
красные |
26
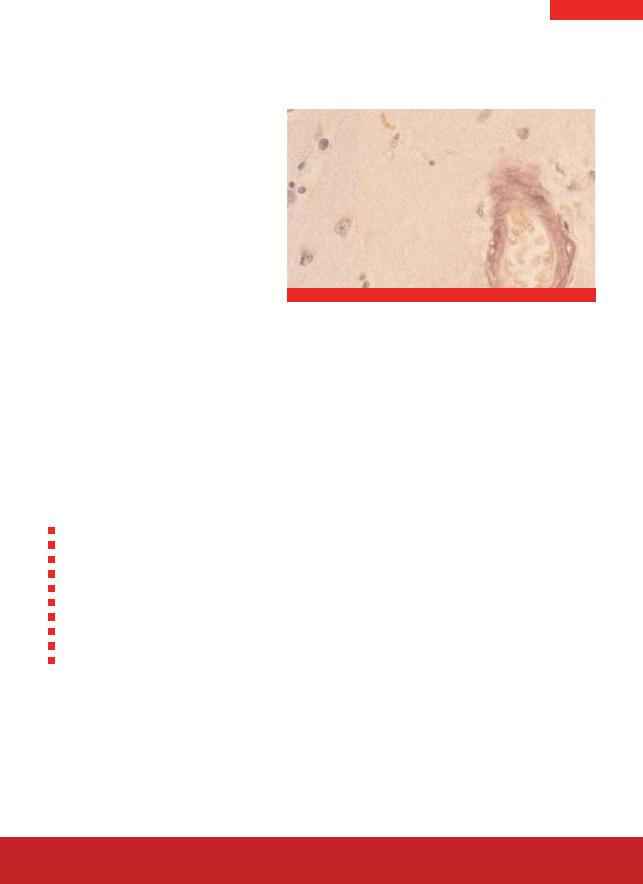
04-210822
Конго красный
Срок годности: 2 года Хранить при температуре 15-20°С
Реактивы
А. Буферный раствор с Конго красным,
30 мл В. Основной фиксирующий буфер 30 мл
C.Спиртовой дифференцирующий буфер 30 мл
D.Гематоксилин Майера, 30 мл
Сосуд с амилоидным депозитом
Применение
Представляет собой эмпирический метод. Неизвестно образуется ли связь амилоида и красителя за счет взаимодействия с белковой или углеводородной частью амилоида или с обоими. Окрашенный Конго красным амилоид демонстрирует способность к двойному лучепреломлению в поляризованном свете. Из наблюдаемой анизотропии можно сделать вывод об упорядоченности молекулярной структуры амилоида.
Описание метода
Поместить срезы в дистиллированную воду.
Нанести на срез 10 капель реактива А, оставить на 30 мин.
Просушить образцы (не промывать), нанести на срез 10 капель реактива В, оставить на 15 мин.
Промыть срезы в дистиллированной воде.
Нанести на срез 10 капель реактива С, оставить на 5 мин.
Промыть срезы в проточной воде в течение 5 мин.
Нанести на срез 10 капель реактива D, оставить на 5 мин.
Промыть срезы в дистиллированной воде.
Подсинить срезы в проточной воде в течение 10 мин.
Дегидрировать в спиртах возрастающей концентрации, просветлить в ксилоле и заключить под покровное стекло.
Результаты
Амилоид |
кирпично-красный, дает двойное |
|
лучепреломление в поляризованном свете |
Ядра |
синие |
27

04-200812
Люксолевый прочный синий по Клюверу-Баррера
Срок годности: 2 года Хранить при температуре 15-25°С
Реактивы
А. Спиртовой раствор Люксолевого прочного, 30 мл
В. Дифференцирующий основной буфер, 30 мл
C. Водный раствор крезил-виолета, 30 мл D. Активирущий кислотный буфер, 30 мл
Нервная ткань: мозжечок
Применение
Выявление миелина и фосфолипидов в гистологических срезах.
Люксол быстрый синий является производным тетрабензотетразо-порфирина. Согласно Клюверу, порфирины демонстрируют селективную аффинность к миелину. Аффинность Люксолевого прочного синего к структурам центральной нервной системы можно объяснить его способностью к образованию связей с фосфолипидами – лецитином и сфингомиелином.
Описание метода
Депарафинизировать срезы и поместить в этиловый спирт 95°.
Поместить препараты во влажную камеру (на дно чашки Петри кладется фильтровальная бумага и капается несколько капель дистиллированной воды), нанести на срез 10 капель реактива А, закрыть контейнер и инкубировать при 56°С ночь.
Промыть препараты в 95° этиловом спирте: кристаллики непрореагировавшего реактива А должны раствориться.
Промыть срезы в дистиллированной воде.
Нанести на срез 10 капель реактива В, оставить на 30 сек.
Дифференцировать в этиловом спирте 70°, пока миелиновые волокна не станут голубыми на бесцветном фоне (иногда дифференциация затруднена; в этом случае повторить но нанести
на срез 10 капель реактива B на 30 сек и снова поместить срезы в этиловый спирт 70°). Промыть срезы в дистиллированной воде как минимум дважды.
Поместить препараты во влажную камеру, нанести на срез 10 капель реактива С и 5 капель реактива D и инкубировать 20 мин в термостате 56°С.
Дифференцировать в этиловом спирте 95° пока тельца Ниссля не станут бледно-розовыми. Дегидрировать в абсолютном этаноле, просветлить в ксилоле и заключить под покровное стекло.
Результаты
Миелин |
бирюзово-синий |
Нейроны и клетки глии |
от розового до фиолетового |
Субстанция Ниссля |
бледно-розовая |
28

04-080802
Май-ГрюнвальдГимза
Срок годности: 2 года Хранить при температуре 15-25°С
Реактивы
А. РастворкрасителяМай-Грюнвальд,500мл В. Фосфатныйбуферныйраствор,500мл C. РастворкрасителяГимза,500мл
Мазок крови
Применение
Рекомендуется для дифференциации клеток крови, выявления паразитов в мазках крови, морфологических особенностей ткани селезенки, лимфатических узлов и костного мозга, выявления бактерий, риккетсий и гранул тучных клеток в мокроте и аспиратах органов. Может быть рекомендован для выявления Trichomonas в вагинальных мазках.
В процессе окрашивания последовательно используются два красителя:
-раствор Май-Грюнвальд, состоящий из эозин-метиленового синего, окрашивающий ядра в синий и цитоплазму базофилов в розово-красный цвет;
-раствор Гимза, в состав которого входят метиленовый синий хлорид, эозин-метиленовый синий и азур II-эозинат, улучшающий интенсивность окрашивания ядер и селективность окрашивания клеточных структур.
Для оценки результатов следует учитывать два фактора: рН воды, используемой для промывки препаратов, и концентрация буферного раствора сильно влияют на окончательную картину окрашивания. Интенсивность окрашивания зависит также от времени дифференциации.
Описание метода
В колбу объемом 1000 мл налить 100 мл реактива В (концентрированный буферный раствор) и разбавить водой до объема колбы (рабочий буферный раствор). Хранить при температуре 4-6°С.
Нанести на образец 10 капель реактива А, оставить на 5 мин.
N.B. Окрашивание препарата можно проводить и в стаканчике без изменения времени окрашивания. В таком случае реагент можно сохранить для последующего использования.
Промыть под проточной водой в течение 1 мин.
В колбе смещать 10 мл реактива С и 90 мл рабочего буферного раствора В; в полученный раствор поместить образцы на 15 мин.
Промыть срезы в проточной воде в течение 1-2 мин.
Просушить образцы фильтровальной бумагой, затем в течение 5 мин на воздухе.
Результаты
Ядра |
красно-фиолетовые/розовые |
Цитоплазма базофилов |
от голубой до темно-синей |
Цитоплазма эозинофилов |
от бледно-красной до розовой |
Полихроматофильная цитоплазма |
от серой до фиолетовой |
Ацидофильные гранулы |
оранжевые |
Нейтрофильные гранулы |
темно-коричневые/розовые |
Базофильные гранулы |
темно-фиолетовые |
Азурофильные гранулы |
от пурпурных до пурпурно-фиолетовых |
29

04-020802
Набор для окраски по Маллори
Срок годности: 2 года Хранить при температуре 15-25°С
Реактивы
А. Карболфуксин по Цилю, 30 мл В. Кислотный буфер, 30 мл
C. Раствор фосфорномолибденовой кислоты, 30 мл
D. Раствор фосфомолибденовой кислоты, 30 мл
E. Полихромный раствор
по Маллори, 30 мл
Предстательная железа
Применение
Стандартное окрашивание соединительной ткани: выявление коллагена, ретикулярных волокон, хряща, кости, амилоида.
В этом методе применяются 3 различных красителя: карболфуксин для окрашивания ядер, оранж G для цитоплазмы и анилиновый синий для избирательного окрашивания коллагена. Центральную роль играет фосфомолибденовая кислота, действие которой связано с тканевыми структурами(коллагеном, клеточной мембраной) и анилином голубым (амфотерный краситель). Оранж G, который является вторым компонентом полихромного раствора по Маллори, который не имеет сродства с фосфомолибденовой кислотой и таким образом применяется для окраски всех оставшихся структур, несвязанных с фосфорномолибденовой кислотой.
Описание метода
Поместить срезы в дистиллированную воду.
Нанести на срезы 10 капель реагента А: оставить на 10 мин.
Промыть срезы в дистиллированной воде.
Нанести на срез 10 капель реактива В, оставить на 10 сек.
Быстро промыть в воде и нанести на срезы 10 капель реагента С, оставить на 5 мин.Не промывая нанести 10 капель реактива, оставить на 1 мин. Промыть срезы в дистиллированной воде Дегидрировать в спиртах возрастающей концентрации, оставить на 1 мин. В абсолютном этано-
ле, просветлить в ксилоле и заключить под покровное стекло.
Результаты
Коллагеновые волокна |
темно-синий |
Хрящи, кости, слизь, амилоид |
от бледно-голубого до темно-синего |
Ядра, миофибриллы, нейроглия, аксоны, фибрин |
бледно-розовые |
Эритроциты, миелин |
насыщенно-желтый |
Эластические волокна |
желтый или не окрашивается |
30
