
МЕТОДИЧКА_1_семестр
.pdfхолодные предметы!
Для взвешивания химических веществ необходимо использовать специальную посуду: бюксы, часовые стекла, тигли, стаканы. Посуда должна быть сухая и чистая. Летучие и гигроскопичные вещества следует взвешивать только в закрытых бюксах!
Дверки весов во время взвешивания должны быть закрыты.
Все взвешивания для данного анализа следует проводить на одних и тех же весах.
Во время взвешивания оберегать весы от толчков, не облокачиваться на подставку весов.
Находиться в весовой комнате следует только во время взвешивания.
После работы сдать весы и разновесы дежурному или лаборанту.
Ход работы
а) Взвешивание на технохимических весах Взвесить стеклянный стакан. Затем шпателем перенести в
стакан столько хлорида натрия, чтобы соль покрыла дно стакана. Произвести взвешивание стакана с солью и по разности установить массу NaCl с погрешностью 0,02 г.
б) Взвешивание на аналитических весах
Повторить работу (а), установить массу навески NaCl с точностью 0,0002 г.
Лабораторная работа № 2
Мерная посуда. Титрование
Мерная посуда предназначена для измерения объема газа или жидкости. К мерной посуде относятся: пипетки, бюретки, мерные колбы, мерные цилиндры, мензурки, мерные стаканы, градуированные пробирки.
1. Работа с мерной пробиркой и мерным цилиндром. Гра-
дуированной пробиркой трижды отмерить по 10 мл дистиллированной воды, выливая каждый раз жидкость в мерный цилиндр. Установить объем воды в цилиндре и оценить точность калиб-
11
ровки цилиндра.
2. Работа с пипеткой. Пипетки применяются для точного измерения определенного объема раствора и перенесения его из одного сосуда в другой. В химической практике наиболее часто используют два вида пипеток: пипетки Мора, предназначенные для отмеривания строго определенного объема жидкости, и градуированные пипетки, позволяющие отмерять произвольный объем жидкости.
Пипетки Мора представляют собой длинные стеклянные трубки с расширением в середине. Один конец пипетки оттянут. Пипетка снабжена кольцевой меткой. На пипетке указана емкость и температура ее измерения. Вместимость пипеток Мора
1,0–100,0 мл.
Градуированные (измерительные) пипетки - стеклянные трубки с нанесенными делениями шкалы. Они обычно имеют вместимость 1,0–10,0 мл и используются для отбора любого объема в пределах вместимости.
При работе с пипеткой необходимо руководствоваться следующими правилами:
Пипетку держать большим и средним пальцем, закрывая отверстие указательным пальцем.
При заполнении пипетки не допускать попадания реактива в рот. Для этого следить за тем, чтобы носик пипетки был глубоко погружен в жидкость.
Концентрированные растворы кислот, щелочей, токсичных и летучих соединений засасывать в пипетку только с помощью резиновой груши.
В пипетку засасывается жидкость в таком количестве, чтобы уровень ее был на 2-3 см выше метки, после чего жидкость медленно выпускается, до тех пор, пока нижний край мениска не сравняется с меткой.
Жидкости из пипетки дают свободно вытекать; если есть необходимость удалить последнюю каплю жидкости, нужно пальцем закрыть отверстие и нагреть пипетку рукой. Дуть в пипетку запрещается.
Перед работой пипетку необходимо ополоснуть раствором, с
12
которым предстоит работать, набирая небольшие порции этого раствора в пипетку и ополаскивая стенки. После работы пипетку следует промыть дистиллированной водой, несколько раз набирая воду в пипетку.
Ход работы
а) Поупражняйтесь в заполнении пипетки дистиллированной водой и установлении мениска на нулевую отметку.
б) Из стакана с дистиллированной водой отмерить в коническую колбу градуированной пипеткой 10,0; 5,0; 1,0 мл воды.
3. Работа с мерной колбой. Мерные колбы - плоскодонные сосуды вместимостью 25,0 2000,0 мл с узким длинным горлом и нанесенной на нем кольцевой меткой. Метка соответствует указанной емкости колбы при 20 С. Мерная колба служит для приготовления растворов определенных концентраций путѐм растворения точно взятой навески вещества в фиксированном объѐме раствора.
Ход работы. Пинцетом перенести 2 гранулы NaOH в мерную колбу ѐмкостью 50 мл. Колбу до половины заполнить дистиллированной водой и растворить вещество, периодически встряхивая колбу. После растворения довести объѐм раствора до метки, закрыть колбу пробкой и тщательно перемешать содержимое. Полученный раствор сохранить для работы 5.
4. Работа с бюреткой. Бюретки используют для отмеривания заданных объѐмов жидкости и для титрования растворов. Они представляют собой градуированные стеклянные трубки вместимостью 10,0-100,0 мл с краном, зажимом или другим затвором в нижней еѐ части. Нулевое деление находится в верхней части бюретки.
Бюретки следует содержать в особой чистоте. Из чистой бюретки жидкость вытекает равномерно, не оставляя на стенках капель. Вымытые бюретки не сушат, они должны быть заполнены дистиллированной водой.
При работе с бюреткой следует соблюдать следующую последовательность операций:
Выпустить из бюретки воду.
Ополоснуть бюретку рабочим раствором. Для этого вставить
13
в бюретку воронку, налить по стенкам 5-10 мл раствора и выпустить его в сливной стакан.
Заполнить бюретку рабочим раствором и удалить воздух из носика. Для этого поднять к верху кончик бюретки и, нажимая на зажим, выпустить немного жидкости.
Снять воронку и установить уровень жидкости в бюретке на нулевую отметку.
После работы слить из бюретки раствор, промыть еѐ и заполнить дистиллированной водой.
Ход работы. Наполнить бюретку дистиллированной водой,
и, нажимая на зажим, довести уровень жидкости до нулевого деления. Отмерить в стакан 10,0; 5,0 и 1,0 мл воды. Мягко надавливая на зажим, добиться вытекания жидкости по каплям.
5. Титрование растворов. Титрование – процесс определения концентрации исследуемого раствора. Титриметрический метод анализа основан на измерении объема раствора реактива известной концентрации (титранта), израсходованного для реакции с исследуемым раствором.
Титрование проводят с помощью бюретки, заполненной титрантом до нулевой отметки.
Ход работы
Заполнить бюретку раствором HCl известной концентрации (титрант).
В коническую колу отмерить пипеткой 10 мл раствора NaОH, приготовленного в работе 3. Для этого перелить часть раствора из мерной колбы в сухой стакан и отбирать раствор оттуда. Добавить две капли индикатора метилового оранжевого.
Оттитровать раствор NaOH, добавляя титрант по каплям при перемешивании. Конечную точку титрования определить по изменению цвета индикатора от желтого до розового.
Записать объем пошедшей на титрование кислоты и убедится, что раствор не перетитрован. Для этого капельной пипеткой добавить к оттитрованной пробе по каплям раствор щелочи. Первоначальная окраска индикатора должна восстановиться при добавлении 1-2 капель раствора щелочи.
14
Опыт повторить 2-3 раза. Допустимые расхождения при параллельных титрованиях не должны превышать 0,1 мл. Обработка результатов. Рассчитать нормальность приго-
товленного раствора NaOH, используя формулу:
NNaOH VNaOH NHCl VHCl ,
где N и V - объѐмы и нормальности растворов соответствующих веществ. При расчете в качестве VHCl взять среднее арифметическое объѐмов кислоты, пошедших на титрование раствора щелочи.
Контрольное титрование. Получить у преподавателя колбу с неизвестным объемом раствора NaOH известной нормальности. Оттитровать пробу раствором соляной кислоты и рассчитать, какой объѐм раствора щѐлочи взят для титрования. Проверить правильность полученного результата у преподавателя.
Тема: АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
Вопросы для самоподготовки
1.Основные положения атомно-молекулярной теории.
2.Атомные и молекулярные частицы. Вещества с молекулярной и надмолекулярной структурой. Формульная единица.
3.Атомная и молекулярная масса.
4.Моль – мера количества вещества. Число Авогадро. Молярная масса и формульная масса.
5.Закон сохранения массы веществ.
6.Закон постоянства состава. Дальтониды и бертоллиды.
7.Эквивалент и эквивалентная масса. Закон эквивалентов.
8.Закон Авогадро. Закон объѐмных отношений.
9.Методы определение молекулярных масс.
10.Методы определение атомных масс.
15
Лабораторная работа № 3
Определение молярной массы оксида углерода(IV)
Молярную массу оксида углерода(IV) можно определить, измерив его относительную плотность по воздуху:
М(СО2) = Мвозд·D,
где Mвозд - средняя молярная масса воздуха, равная 29 г/моль, D - относительная плотность оксида углерода(IV) по воздуху, рав-
ная отношению масс одинаковых объѐмов углекислого газа и воздуха при одинаковых условиях.
Для расчѐта молярной массы оксида углерода(IV) нужно использовать следующие экспериментальные данные:
Величина |
Обозначение |
Размерность |
|
|
|
|
|
Масса колбы с воздухом и |
m1 |
г |
|
пробкой |
|||
|
|
||
Масса колбы с CO2 и пробкой |
m2 |
г |
|
Давление |
P |
Па |
|
Температура |
T |
К |
|
Объѐм газа в колбе |
V |
мл |
Ход работы
Взять сухую плоскодонную колбу емкостью 100 мл с хорошо пригнанной пробкой и с помощью резинового кольца или карандаша по стеклу сделать отметку на горлышке колбы в том месте, где кончается пробка.
Взвесить колбу с пробкой и находящимся в ней воздухом на аналитических весах.
Наполнить колбу оксидом углерода(IV) из аппарата Киппа,
пропуская CO2 через промывную склянку с концентрированной серной кислотой. Газоотводную трубку следует опускать до дна колбы.
Убедиться, что колба заполнена диоксидом углерода, поднеся к ее горлышку горящую спичку. Медленно вынуть газоотводную трубку, закрыть колбу пробкой (пробка должна до-
16

ходить до метки на горлышке колбы) и взвесить.
Довести колбу с оксидом углерода(IV) до постоянной массы. Для этого нужно добавить в колбу оксида углерода(IV) и снова взвесить. Если результат второго взвешивания будет отличаться от первого не более чем на 0,001 г, то можно считать, что воздух в колбе полностью замещен на оксид угле-
рода(IV).
Наполнить колбу водой до метки, перелить воду в мерный цилиндр и определить объем колбы. Измерить температуру и давление в помещении.
Обработка результатов
1. Привести объѐм воздуха в колбе к нормальным условиям по формуле:
V = PVTo .
o
PoT
2.Вычислить массу воздуха в объѐме колбы (mвозд), учитывая, что 1 л воздуха при нормальных условиях весит 1,293 г.
3.Вычислить массу пустой колбы:
mколбы = m1 - mвозд.
4. Вычислить массу оксида углерода(IV) в объѐме колбы:
m(CO2) = m2 – mколбы
5. Вычислить относительную плотность оксида углерода(IV) по воздуху:
D = m(CO2 )
mвозд
6. Рассчитать молярную массу оксида углерода(IV), сравнить найденное значение с теоретической величиной и определить погрешность эксперимента:
= Мтеор Мэксп ·100%
Мтеор
17
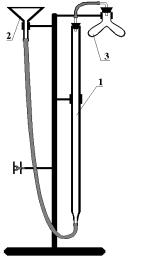
Лабораторная работа № 4
Определение молярной массы эквивалента магния
Определение молярной массы |
|
||||
эквивалента магния |
основано |
на |
|
||
измерении объема водорода, вы- |
|
||||
деляющегося при взаимодействии |
|
||||
определенной |
навески |
магния |
с |
|
|
разбавленной |
серной |
кислотой, |
|
||
взятой в избытке. Для измерения |
|
||||
объема водорода |
используется |
|
|||
газовая бюретка - прибор, состо- |
|
||||
ящий из бюретки (1), соединенной |
|
||||
с уравнительной воронкой (2) и |
|
||||
сосудом Ландольта (3). |
|
|
|
||
Для расчета молярной массы |
|
||||
эквивалента магния необходимы |
|
||||
следующие данные: |
|
|
Рис. 3. Установка для |
||
|
|
|
|
||
|
|
|
|
|
|
Величина |
|
|
Обозначение |
Размерность |
|
|
|
|
|
|
|
Навеска магния |
|
|
|
m(Mg) |
г |
Температура |
|
|
|
T |
К |
Давление |
|
|
|
P |
Па |
Давление водяного пара |
|
P(Н2О) |
Па |
||
Уровень воды в бюретке до ре- |
a1 |
мл |
|||
акции |
|
|
|
||
|
|
|
|
|
|
Уровень воды в бюретке после |
a2 |
мл |
|||
реакции |
|
|
|
||
|
|
|
|
|
|
Ход работы
Проверить прибор на герметичность. Для этого соединить бюретку с сосудом Ландольта и поднять воронку. Если уровень воды в бюретке непрерывно повышается, прибор не герметичен, в этом случае нужно найти и устранить причину утечки газа.
Взвесить на пергаментной бумаге кусочек магния с точно-
18

стью до 0,0002 г (аналитические весы). Масса магния должна составлять 0,02-0,03 г.
Навеску поместить в одно колено сосуда Ландольта, в другое колено отмерить пипеткой 5,0 мл 2 н. раствора серной кислоты.
Перемещая уравнительную воронку, установить уровень жидкости в бюретке чуть ниже нулевой отметки. Затем присоединить к бюретке сосуд Ландольта.
Замерить значение уровня воды в бюретке (a1). При замерах обязательно уровень воды в бюретке и воронке должен совпадать!
Перелить кислоту в колено с магнием. По мере выделения водорода опускать воронку так, чтобы уровень жидкости в ней и бюретке был приблизительно одинаковым.
После окончания реакции дать прибору остыть (10-15 мин.) и замерить уровень воды (a2).
Измерить температуру и давление в помещении. По справочнику найти давление насыщенного пара воды при данных условиях.
Обработка результатов
1. Найти парциальное давление водорода в приборе:
Р(Н2) = Р – Р(Н2О)
2. Вычислить объѐм водорода при температуре T и давлении P:
V = a2 - a1
3. Привести объѐм водорода к нормальным условиям по формуле:
V0 V P(H 2 ) T0 , где Tо = 273 К, Pо = 1,013 105 Па.
P0 T
4.Вычислить массу водорода - m (H2), зная, что при нормальных условиях один моль водорода занимает объѐм 22414 мл.
5.Рассчитать молярную массу эквивалента магния, исходя из закона эквивалентов:
19

m(H2 ) МЭ (Н2 ) . m(Mg) MЭ (M g)
6. Сравнить найденное значение молярной массы эквивалента магния с теоретической величиной и рассчитать относительную погрешность опыта:
|
Мтеор Мэксп |
|
|
δ(%) |
э |
э |
100%. |
|
Мтеор |
||
|
|
|
|
|
|
э |
|
Тема: ХИМИЧЕСКАЯ КИНЕТИКА
Вопросы для самоподготовки
1.Предмет химической кинетики. Скорость химической реакции.
2.Влияние концентрации на скорость химической реакции. Закон действующих масс.
3.Влияние температуры на скорость химической реакции.
4.Энергия активации. Активированный комплекс. Энтропия активации.
5.Кинетическая классификация реакций. Молекулярность и порядок реакции.
6.Катализаторы и катализ.
7.Гомогенный катализ. Теория промежуточных соединений.
8.Обратимые и необратимые процессы. Условия наступления химического равновесия. Константа химического равновесия и факторы, на нее влияющие.
9.Принцип Ле Шателье. Смещение химического равновесия.
Лабораторная работа № 5
Влияние концентрации и температуры на скорость химической реакции
1. Изучение влияния концентрации на скорость химической реакции
Методика выполнения работы. Исследуется кинетика рас-
пада тиосерной кислоты:
H2S2O3 S + SO2 + H2O
20
