
- •Глава 13
- •13.1. Классификация, номенклатура и Строение спиртов
- •13.1.1. Классификация спиртов
- •13.1.2. Номенклатура спиртов
- •13.1.3. Строение спиртов
- •13.1.4. Изомерия
- •13.2. Физические свойства спиртов
- •13.2.1. Спектроскопия спиртов
- •13.3. Получение одноатомных спиртов в промышленности
- •13.4. Методы синтеза одноатомных спиртов в лаборатории
- •13.5. Химические свойства одноатомных спиртов
- •13.5.1. Разрыв связи с–он
- •13.5.2. Разрыв связи о–н
- •13.6. Отдельные представители одноатомных спиртов
- •13.7. Непредельные спирты и их эфиры
- •13.7.1. Енолы
- •13.7.2. Получение производных енолов
- •13.7.3. Аллиловый спирт
- •13.7.4. Высшие непредельные спирты
- •13.7.5. Ацетиленовые спирты и простые эфиры
- •13.8. Гликоли
- •13.8.1. Физические свойства гликолей
- •13.8.2. Методы синтеза гликолей
- •13.8.3. Химические свойства гликолей
- •А) реакции окисления с сохранением углеродной цепи;
- •13.8.4. Применение гликолей
- •13.9. Многоатомные спирты
- •13.9.1. Получение глицерина
- •13.9.2. Химические свойства глицерина
- •13.9.3. Применение глицерина
- •13.9.4. Многоатомные спирты
- •13.9.5. Жиры и масла
А) реакции окисления с сохранением углеродной цепи;
б) реакции окисления цис-гликолей с расщеплением углеродной цепи.
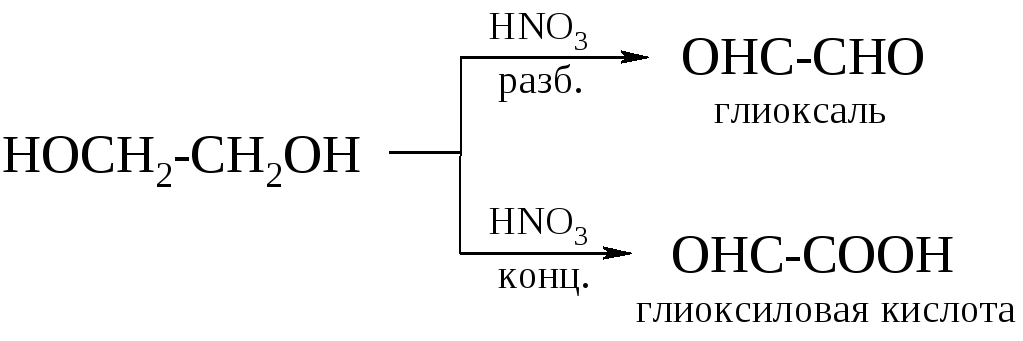
При действии на этиленгликоль азотной кислотой в зависимости от концентрации получают глиоксаль или глиоксиловую кислоту.
Окисление этиленгликоля пероксидом водорода в присутствии солей железа(II) приводит к гликолевой кислоте – НОСН2СООН, а окисление перманганатом калия – к щавелевой кислоте НООС-СООН.
Второй тип реакций ведет к расщеплению углерод-углеродной связи. Так, при обработке иодной кислотой соединений, содержащих две или большее число гидроксильных групп, находящихся у соседних атомов углерода (-гликоли), протекает окисление с расщеплением углерод-углеродной связи. Аналогично протекает реакция и для соответствующих -гидроксикарбонильных и -дикарбонильных соединений.
![]()
![]()
![]()
![]()
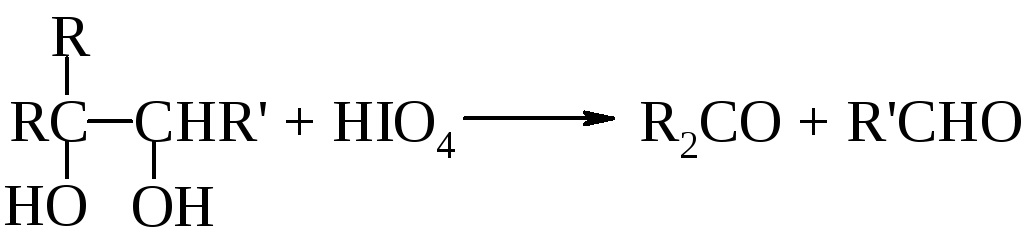
![]()
Эта реакция особенно важна при определении структуры сахаров. Качественно окисление иодной кислотой можно обнаружить по образованию белого осадка при добавлении нитрата серебра к образовавшейся в ходе реакции иодноватой кислоте (HIO3). Поскольку реакция обычно протекает количественно, то можно получить очень ценную информацию на основании данных о природе и количестве образовавшихся продуктов реакции и количестве израсходованной иодной кислоты.
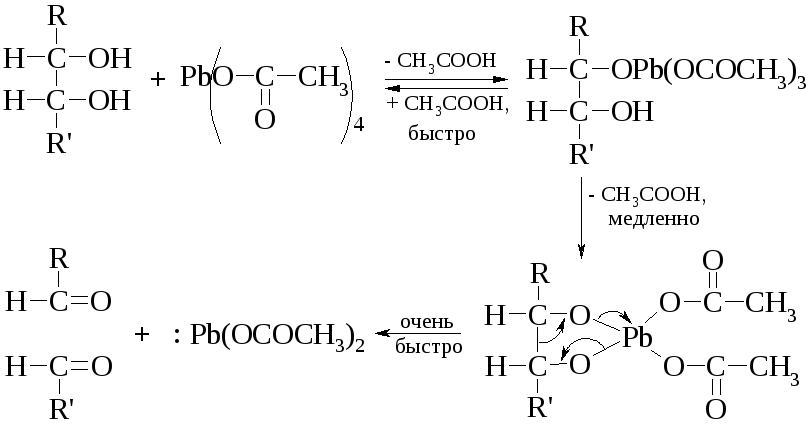
Метод окисления 1,2-гликолей иодной кислотой, разработанный Л. Малапраде в 1928 г., удачно дополняется окислением гликолей тетраацетатом свинца, предложенным в 1931 г. Р. Криге: если первая реакция протекает только в водных средах, то вторую можно проводить в бензоле или уксусной кислоте.
Обе реакции протекают через циклические эфиры, образованные гликолем с окислителем. Этим объясняется тот факт, что цис-гликоли разрушаются быстрее, чем транс-изомеры. Предполагается следующий механизм окисления гликолей. Кинетические измерения показывают, что образование цикла является наиболее медленной стадией реакции.
Получение циклических ацеталей. Альдегиды в кислой среде ацеталируют 1,2-гликоли с образованием циклических ацеталей.
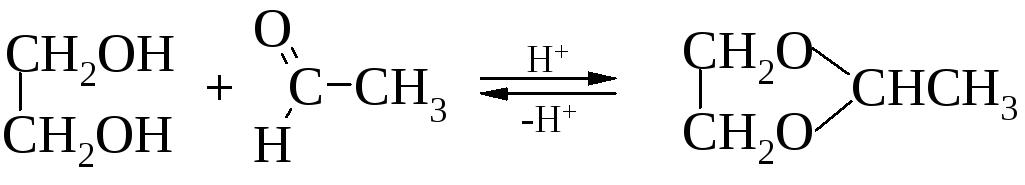
При обработке их кислотами регенерируются исходные вещества. В щелочных условиях ацетали весьма устойчивы.
1,3-Гликоли способны реагировать подобным образом, давая шестичленные циклические ацетали. Для осуществления реакций ацеталирования необходимым условием является нахождение гидроксильных групп в цисоидной конфигурации.
13.8.4. Применение гликолей
Из представителей гликолей наибольшего внимания заслуживает сам этиленгликоль, а также ряд соединений, синтезированных на его основе.
Этиленгликоль - вязкая бесцветная жидкость, сладкая на вкус. Сильно понижает температуру замерзания воды, и этим свойством этиленгликоля пользуются для приготовления антифриза. Этиленгликоль весьма гигроскопичен, поэтому его применяют при изготовлении печатных красок
Азотнокислый эфир этиленгликоля – динитроэтиленгликоль – сильное взрывчатое вещество, заменяющее нитроглицерин.
Полиэфиры этиленгликоля широко применяются в различных отраслях промышленности: как пленкообразующие вещества для лаков и красок, в производстве пластмасс и особенно синтетических волокон, например, лавсана.
Среди производных этиленгликоля одним из важнейших является этиленхлоргидрин, применяемый для разнообразных синтезов. Он используется для получения новокаина, индиго и горчичного газа (иприта) (ClCH2CH2)2S. Название иприт связано с тем, что в 1917 г. немцы применили этот отравляющий газ против французов у г. Ипр.
С аммиаком и аминами хлоргидрин образует аминоспирт этаноламин (коламин), входящий в состав гликолипидов.
HOCH2CH2Cl + 2NH3 → HOCH2CH2NH2 + NH4Cl
коламин
При действии сильных щелочей этиленхлоргидрин превращается в этиленоксид.
Диэтиленгликоль представляет собой жидкость, применяющуюся как растворитель и для заполнения тормозных гидравлических приспособлений.
Диоксан – жидкость, смешивающаяся с водой в любых соотношениях. Обычно его получают взаимодействием этиленгликоля с дихлорэтаном. Применяется в основном в качестве растворителя, в том числе, для эфиров целлюлозы, масел и жиров.
Бутандиол-1,4 – исходное вещество для получения бутадиена в странах, бедных нефтью, и для синтеза тетрагидрофурана.
Тетрагидрофуран применяется в качестве апротонного растворителя природных и синтетических смол, эфиров целлюлозы и ацетилена, для получения бутадиена.
