- •Таврический национальный университет
- •Лекция № 1. Водород
- •Соединения водорода
- •Литература: [1] с. 330 - 338, [2] с. 411 - 415, [3] с. 262 - 270 Лекция № 2. Элементы VII-a-подгрупы (галогены)
- •Cоединения галогенов
- •Лекция № 3. Элементы via-подгруппы
- •3.1. Кислород
- •Соединения кислорода
- •2Hso4- - 2e- h2s2o8
- •Соединения серы
- •3.3. Подгруппа селена
- •Соединения селена и теллура
- •Литература: [1] с. 359 - 383, [2] с. 425 - 435, [3] с. 297 - 328 Лекция № 4. Элементы va-подгруппы
- •Соединения азота
- •4.2. Фосфор
- •Соединения фосфора
- •4.3. Элементы подгруппы мышьяка
- •Соединения мышьяка, сурьмы и висмута
- •Литература: [1] с. 383 - 417, [2] с. 435 - 453, [3] с. 328 - 371 Лекция № 5. Элементы iva-подгруппы
- •5.1. Углерод
- •Соединения углерода
- •5.2. Кремний
- •Соединения кремния
- •5.3. Германий, олово, свинец
- •Соединения германия
- •Соединения олова
- •Соединения свинца
- •Литература: [1] с. 417 - 435, 491 - 513, [2] с. 453 - 472, [3] с. 371 - 409 Лекция № 6. Элементы iiia-подгруппы
- •Соединения бора
- •6.2. Алюминий
- •Соединения алюминия
- •6.3. Подгруппа галлия
- •Соединения элементов подгруппы галлия
- •Литература: [1] с. 608 - 619, [2] с. 472 - 481, [3] с. 412 - 446 Лекция № 7. Элементы iia-подгруппы
- •7.1. Бериллий
- •Соединения бериллия
- •7.2. Магний
- •Соединения магния
- •7.3. Щелочноземельные металлы
- •Соединения щелочноземельных металлов
- •Литература: [1] с. 587 - 599, [2] с. 481 - 486, [3] с. 447 - 460
- •7.4. Элементы ia-подгруппы (щелочные металлы)
- •Соединения щелочных металлов
- •Литература: [1] с. 543 - 551, [2] с. 486 - 489, [3] с. 461 - 470 Лекция № 8. Общая характеристика d-элементов. Элементы iiiв - vb подгрупп (подгруппы скандия,титана и ванадия)
- •8.1. Общая характеристика d-элементов
- •8.2. Элементы iiiв подгруппы (подгруппа скандия)
- •Соединения элементов подгруппы скандия
- •8.3. Элементы ivв подгруппы (подгруппа титана)
- •Соединения титана, циркония и гафния
- •8.4. Элементы vв подгруппы (подгруппа ванадия)
- •Соединения ванадия, ниобия и тантала
- •Литература: [1] с. 619 - 633, [2] с. 489 - 523, [3] с. 478 - 481, 499 - 520 Лекция № 9. Элементы viв- и viiв-подгрупп
- •9.1 Элементы viв-подгруппы (подгруппа хрома)
- •Соединения хрома, молибдена и вольфрама
- •9.2. Элементы viiв-подгруппы (подгруппа марганца)
- •Соединения маргнаца, технеция и рения
- •Литература: [1] с. 633 - 645, [2] с. 523 - 539, [3] с. 521 - 548 Лекция № 10. Элементы viiib-подгруппы
- •10.1. Элементы триады железа
- •Соединения железа
- •Соединения кобальта
- •Соединения никеля
- •Литература: [1] с. 650 - 679, [2] с. 540 - 550, [3] с. 548 - 584
- •10.2. Платиновые металлы
- •Соединения рутения и осмия
- •Соединения родия и иридия
- •Соединения палладия и платины
- •Лекция № 11. Элементы ib- и iib-подгрупп
- •11.1 Элементы ib-подгруппы (подгруппы меди)
- •Соединения меди
- •Соединения серебра
- •Соединения золота
- •11.2. Элементы iib-подгруппы (подгруппа цинка)
- •Соединения цинка и кадмия
- •Соединения ртути
- •Литература: [1] с. 551 - 563, 599 - 608, [2] с. 550 - 554, [3] с. 585 - 602
- •Лекция № 12. Химия f-элементов
- •12.1. Лантаниды
- •Соединения лантанидов
- •12.2. Актиниды
- •Соединения актинидов
- •Лекция № 13. Инертные газы
- •13.1. Гелий. Неон. Аргон
- •13.2. Элементы подгруппы криптона
- •Соединения криптона, ксенона и радона
- •Список рекомендуемой литературы
- •Содержание
Литература: [1] с. 359 - 383, [2] с. 425 - 435, [3] с. 297 - 328 Лекция № 4. Элементы va-подгруппы
Главная подгруппа V группы (подгруппа VA) включает азот - N, фосфор - P, мышьяк - As, сурьму - Sb и висмут - Bi, объединенные общей электронной формулой - ns2np3. В своих соединениях азот и фосфор проявляют все возможные степени окисления от -3 до +5 (наиболее характерны -3, +3 и +5). Отсутствие энергетически доступных d-орбиталей не позволяет азоту проявлять валентность выше 4, в то время как фосфор способен проявляет валентность 5 и даже 6 за счет привлечения орбиталей 3d-подуровня.
При увеличении порядкового номера в пределах VА-подгруппы усиливаются металлические признаки химических элементов (мышьяк и сурьма - полупроводники, висмут - металл) и уменьшается устойчивость соединений в высшей степени окисления.
4.1. Азот
Азот - распространенный элемент земной коры (0,03 мол.%), представлен в природе двумя изотопами - 14N (99,6%) и 15N. Основная масса азота входит в состав атмосферы (78% по объему). Кроме этого азот образует несколько минералов, основными из которых являются: чилийская селитра - NaNO3 и индийская селитра - KNO3. Азот входит в состав живых организмов в основном в виде аминокислот, полипептидов, белков и азотистых оснований.
Образует простое вещество, состоящее из двухатомных молекул N2. Азот - бесцветный газ, без вкуса и запаха, не поддерживающий жизнедеятельность. Очень плохо растворим в воде, но под давлением растворимость азота в воде и биологических жидкостях сильно увеличивается. Растворенный под давлением азот оказывает наркотическое действие и вызывает глубоководное опьянение у водолазов. Быстрое выделение азота из крови при уменьшении давления вызывает кессонную болезнь. При охлаждении до -196 С (77 К) азот сжижается, образуя бесцветную подвижную жидкость, кристаллизующуюся при - 210 С. В кристаллическом состоянии существует в двух полиморфных модификациях.
В промышленности азот получают фракционной перегонкой жидкого воздуха. Лабораторный метод получения азота основан на термическом разложении нитрита аммония:
t
NH4NO2 N2 + 2H2O
Химические свойства. По электроотрицательности азот уступает только фтору и кислороду, однако чрезвычайная устойчивость молекулы N2 обуславливает высокую химическую инертность азота. При комнатной температуре с азотом реагирует только литий:
6Li + N2 = 2Li3N
нитрид лития
При сильном нагревании азот реагирует с другими щелочными и щелочноземельными металлами, бором и алюминием.
t
N2 + 2Al = 2AlN
При повышенных температурах азот реагирует с водородом и кислородом:
450 C, p 3000-4000 C
N2
+ 3H2
![]() 2NH3;
N2
+ O2
2NH3;
N2
+ O2
![]() 2NO
2NO
Соединения азота
Соединения со степенью окисления –3. Соединения азота в степени окисления -3 представлены аммиаком и нитридами металлов.
Аммиак - NH3 - бесцветный газ с характерным резким запахом. Молекула аммиака имеет геометрию тригональной пирамиды с атомом азота в вершине. Атомные орбитали азота находятся в sp3-гибридном состоянии. Три орбитали задействованы в образовании связей азот-водород, а четвертая орбиталь содержит неподеленную электронную пару, молекула имеет пирамидальную форму. Отталкивающее действие неподеленной пары электронов приводит к уменьшению валентного угла от ожидаемого 109,5 до 107,3 .

При температуре -33,4 С аммиак конденсируется, образуя жидкость с очень высокой теплотой испарения, что позволяет использовать его в качестве хладагента в промышленных холодильных установках.
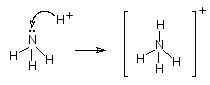
Наличие у атома азота неподеленной электронной пары позволяет ему образовать еще одну ковалентную связь по донорно-акцепторному механизму. Таким образом в кислой среде происходит образование молекулярного катиона аммония - NH4+. Образование четвертой ковалентной связи приводит к выравниванию валентных углов (109,5 ) за счет равномерного отталкивания атомов водорода.
Жидкий аммиак хороший самоионизирующийся растворитель:
2NH3
![]() NH4+
+ NH2-
NH4+
+ NH2-
амид-анион
В нем растворяются щелочные и щелочноземельные металлы, образуя окрашенные токопроводящие растворы. В присутствии катализатора (FeCl3) растворенный металл реагирует с аммиаком c выделением водорода и образованием амида, например:
2Na + 2NH3 = 2NaNH2 + H2
амид натрия
Аммиак очень хорошо растворим в воде (при 20 С в одном объеме воды растворяется около 700 объемов аммиака). В водных растворах проявляет свойства слабого основания.
NH3
+ H2O
NH3H2O
![]() NH4+
+ OH-
NH4+
+ OH-
 =
1,85·10-5
=
1,85·10-5
В атмосфере кислорода аммиак горит с образованием азота, на платиновом катализаторе аммиак окисляется до оксида азота(II):
t t
4NH3 + 3O2 = 2N2 + 6H2O; 4NH3 + 5O2 = 4NO + 6H2O
Pt
Как основание аммиак реагирует с кислотами, образуя соли катиона аммония, например:
NH3 + HCl = NH4Cl
Соли аммония хорошо растворимы в воде и слабо гидролизованы. В кристаллическом состоянии термически нестойки. Состав продуктов термолиза зависит от свойств кислоты, образующей соль:
t t
NH4Cl NH3 + HCl; (NH4)2SO4 NH3 + (NH4)HSO4
t
(NH4)2Cr2O7 N2 + Cr2O3 + 4H2O
При действии на водные растворы солей аммония щелочей при нагревании выделяется аммиак, что позволяет использовать данную реакцию как качественную на соли аммония и как лабораторный метод получения аммиака.
t
NH4Cl + NaOH = NaCl + NH3 + H2О
В промышленности аммиак получают прямым синтезом.
p, t
N2
+ 3H2
![]() 2NH3
2NH3
Kat
Поскольку реакция сильно обратима, синтез ведут при повышенном давлении (до 100 мПа). Для ускорения процесс проводят в присутствии катализатора (губчатое железо, промотированное добавками) и при температуре около 500 С.
Нитриды образуются в результате реакций многих металлов и неметаллов с азотом. Свойства нитридов закономерно изменяются в периоде. Например, для элементов третьего периода:
|
Na3N Mg3N2 |
AlN |
Si3N4 P3N5 S3N4 Cl3N |
|
Основные нитриды |
Амфотерный |
Кислотные нитриды |
Нитриды s-элементов I и II групп представляют собой кристаллические солеподобные вещества, легко разлагающиеся водой с образованием аммиака.
Li3N + 3H2O = 3LiOH + NH3
Из нитридов галогенов в свободном состоянии выделен только Cl3N, кислотный характер проявляется в реакции с водой:
Cl3N + 3H2O = 3HClO + NH3
Взаимодействие нитридов разной природы приводит к образованию смешанных нитридов:
Li3N + AlN = Li3AlN2; 5Li3N + Ge3N4 = 3Li5GeN3
нитридоалюминат нитридогерманат(IV) лития
Нитриды ВN, AlN, Si3N4, Ge3N4 – твердые полимерные вещества с высокими температурами плавления (2000-3000 С), они полупроводники или диэлектрики. Нитриды d-металлов - кристаллические соединения переменного состава (бертолиды), очень твердые, тугоплавкие и химически устойчивые, проявляют металлические свойства: металлический блеск, электропроводность.
Соединения со степенью окисления –2. Гидразин - N2H4 - наиболее важное неорганическое соединение азота в степени окисления -2.
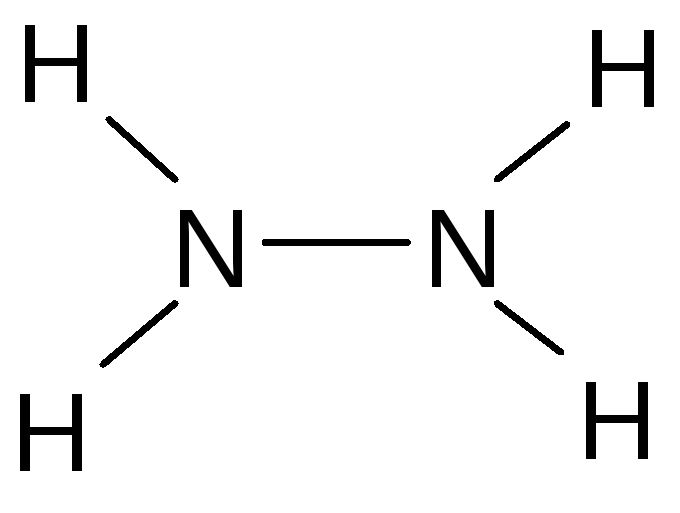
Гидразин представляет собой бесцветную жидкость, с температурой кипения 113,5 С, дымящуюся на воздухе. Пары гидразина чрезвычайно ядовиты и образуют с воздухом взрывообразные смеси. Получают гидразин, окисляя аммиак гипохлоритом натрия:
2N-3H3 + NaCl+1O = N2-2H4 + NaCl-1 + H2O
Гидразин смешивается с водой в любых соотношениях и в растворе ведет себя как слабое двухкислотное основание, образуя два ряда солей.
N2H4
+ H2O
![]() N2H5+
+ OH-,
Kb
= 9,310-7;
N2H5+
+ OH-,
Kb
= 9,310-7;
катион гидрозония
N2H5+
+ H2O
![]() N2H62+
+ OH-,
Kb
= 8,510-15;
N2H62+
+ OH-,
Kb
= 8,510-15;
катион дигидрозония
N2H4
+ HCl ![]() N2H5Cl;
N2H5Cl
+ HCl
N2H5Cl;
N2H5Cl
+ HCl ![]() N2H6Cl2
N2H6Cl2
хлорид гидрозония дихлорид дигидрозония
Гидразин сильнейший восстановитель:
4KMn+7O4 + 5N2-2H4 + 6H2SO4 = 5N20 + 4Mn+2SO4 + 2K2SO4 + 16H2O
Несимметричный диметилгидразин (гептил) широко применяется в качестве ракетного топлива.
Соединения со степенью окисления –1. Гидроксиламин - NH2OH - основное неорганическое соединение азота в степени окисления -1.

Получают гидроксиламин восстановлением азотной кислоты водородом в момент выделения при электролизе:
HNO3 + 6H = NH2OH + 2H2O
Это бесцветное кристаллическое вещество (т.пл. 33 С), хорошо растворимое в воде, в которой проявляет свойства слабого основания. С кислотами дает соли гидроксиламмония – устойчивые бесцветные вещества, растворимые в воде.
NH2OH
+ H2O
![]() [NH3OH]+
+ OH-,
Kb
= 210-8
[NH3OH]+
+ OH-,
Kb
= 210-8
ион гидроксиламмония
Атом азота в молекуле NH2OН проявляет промежуточную степень окисления (между -3 и +5) поэтому гидроксиламин может выступать как в роли восстановителя, так и в роли окислителя:
2N-1H2OH + I2 + 2KOH = N02 + 2KI + 4H2O;
восстановитель
2N-1H2OH + 4FeSO4 + 3H2SO4 = 2Fe2(SO4)3 + (N-3H4)2SO4 + 2H2O
окислитель
NH2OН легко разлагается при нагревании, подвергаясь диспропорционированию:
3N-1H2OH = N02 + N-3H3 + 3H2O;
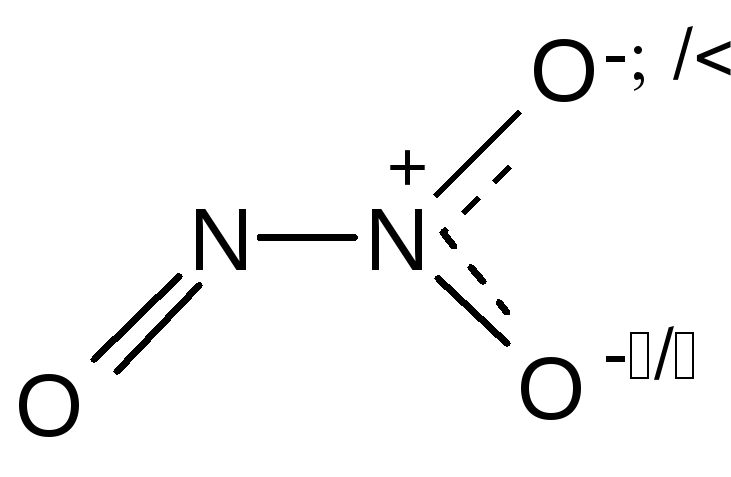
Соединения со степенью окисления +1. Оксид азота(I) - N2O (закись азота, веселящий газ). Строение его молекулы можно передать резонансом двух валентных схем, которые показывают, что рассматривать это соединение как оксид азота(I) можно только формально, реально это оксонитрид азота(V) - ON+5N-3.
![]()
N2O - бесцветный газ со слабым приятным запахом. В малых концентрациях вызывает приступы безудержного веселья, в больших дозах оказывает общее анестезирующее действие. Смесь закиси азота (80%) и кислорода (20%) использовалась в медицине для наркоза.
В лабораторных условиях оксид азота(I) можно получить разложением нитрата аммония. N2O, полученный данным методом, содержит примеси высших оксидов азота, которые чрезвычайно токсичны!
t
NH4NO3 N2O + 2H2O
По химическим свойствам оксид азота(I) типичный несолеобразующий оксид, с водой, кислотами и щелочами не реагирует. При нагревании разлагается с образованием кислорода и азота. По этой причине N2O может выступать в роли окислителя, например:
t
N2O + H2 = N2 + H2O
Соединения со степенью окисления +2. Оксид азота(II) - NO - бесцветный газ, чрезвычайно токсичен. На воздухе быстро окисляется кислородом с образованием не менее токсичного оксида азота(IV). В промышленности NO получают окислением аммиака на платиновом катализаторе или, пропуская воздух через электрическую дугу (3000-4000 С).
Рt t
4NH3 + 5О2 = 4NО + 6H2О; N2 + O2 = 2NO
Лабораторным методом получения оксида азота(II) является взаимодействие меди с разбавленной азотной кислотой.
3Cu + 8HNO3(разб.) = 3Cu(NO3)2 + 2NO + 4H2O
Оксид азота(II) - несолеобразующий оксид, сильный восстановитель, легко реагирует с кислородом и галогенами.
2NO + O2 = 2NO2; 2NO + Cl2 = 2NOCl
хлористый нитрозил
В то же время, при взаимодействии с сильными восстановителями NO выполняет функцию окислителя:
t t
2NO + 2H2 = N2 + 2H2O; 10NO + 4Р = 5N2 + 2Р2O5
Соединения со степенью окисления +3. Оксид азота(III) - N2O3 - жидкость интенсивно синего цвета (т.кр. -100 С). Устойчив только в жидком и твердом состоянии при низких температурах. По-видимому, существует в двух формах:
Получают оксид азота(III) совместной конденсацией паров NO и NO2. В жидкости и в парах диссоциирует.
NO2
+ NO ![]() N2O3
N2O3
По свойствам типичный кислотный оксид. Реагирует с водой, образуя азотистую кислоту, с щелочами образует соли - нитриты.
N2O3 + H2O = 2HNO2; N2O3 + 2NaOH = 2NaNO2 + H2O
Азотистая кислота - кислота средней силы (Ka = 110-4). В чистом виде не выделена, в растворах существует в двух таутомерных формах (таутомеры - изомеры, находящиеся в динамическом равновесии).
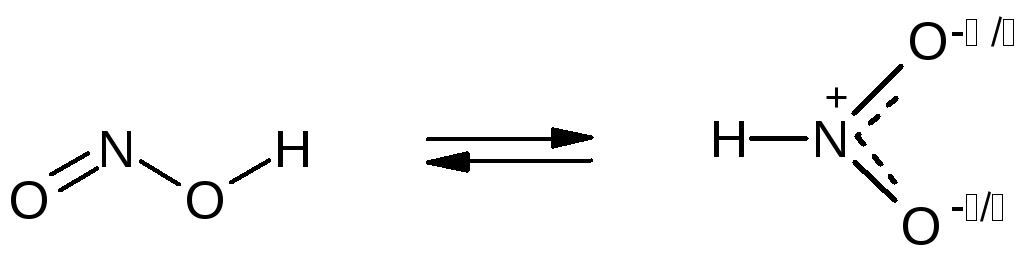
нитрито-форма нитро-форма
Соли азотистой кислоты устойчивы. Нитрит-анион проявляет ярко выраженную окислительно-восстановительную двойственность. В зависимости от условий он может выполнять как функцию окислителя, так и функцию восстановителя, например:
2NaNO2 + 2KI + 2H2SO4 = I2 + 2NO + K2SO4 + Na2SO4 + 2H2O
окислитель
KMnO4 + 5NaNO2 + 3H2SO4 = 2MnSO4 + 5NaNO3 + K2SO4 + 3H2O
восстановитель
Азотистая кислота и нитриты склонны к диспропорционированию:
t
3HN+3O2 = HN+5O3 + 2N+2O + H2O
Соединения со степенью окисления +4. Оксид азота(IV) - NO2 - бурый газ, с резким неприятным запахом. Чрезвычайно токсичен! В промышленности NO2 получают окислением NO. Лабораторным методом получения NO2 является взаимодействие меди с концентрированной азотной кислотой, а также термическое разложение нитрата свинца.
Cu + 4HNO3(конц.) = Cu(NO3)2 + 2NO2 + 2H2O;
t
2Pb(NO3)2 = 2PbO + 4NO2 + O2
Молекула NO2 имеет один неспаренный электрон и является стабильным свободным радикалом, поэтому оксид азота легко димеризуется.
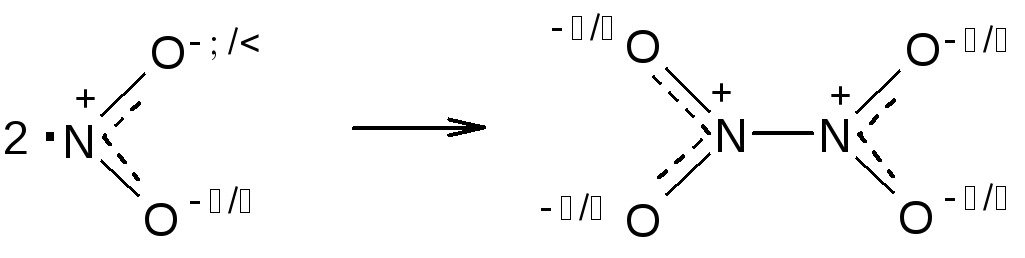
Процесс димеризации обратим и очень чувствителен к температуре:
-11 C
2NO2
![]() N2O4
N2O4
+150 C
парамагнитен, диамагнитен,
бурый бесцветен
Диоксид азота - кислотный оксид, взаимодействует с водой, образуя смесь азотной и азотистой кислоты (смешанный ангидрид).
2NO2 + H2O = HNO2 + HNO3; 2NO2 + 2NaOH = NaNO3 + NaNO2 + H2O
Соединения со степенью окисления +5. Оксид азота(V) - N2O5 - белое кристаллическое вещество. Получается дегидратацией азотной кислоты или окислением оксида азота(IV) озоном:
2HNO3 + P2O5 = N2O5 + 2HPO3; 2NO2 + O3 = N2O5 + O2
В кристаллическом состоянии N2O5 имеет солеподобное строение - [NO2]+[NO3]-, в парах (т.возг. 33 С) - молекулярное.

N2O5 - кислотный оксид - ангидрид азотной кислоты:
N2O5 + H2O = 2HNO3
Азотная кислота - HNO3 - бесцветная жидкость с температурой кипения 84,1 С, при нагревании и на свету разлагается.
4HNO3 = 4NO2 + O2 + 2H2O
Примеси диоксида азота придают концентрированной азотной кислоте желто-бурую окраску. С водой азотная кислота смешивается в любых соотношениях и является одной из сильнейших минеральных кислот, в растворе нацело диссоциирует.
Строение молекулы азотной кислоты описывается следующими структурными формулами:

Сложности с написанием структурной формулы HNO3 вызваны тем обстоятельством, что, проявляя в данном соединении степень окисления +5, азот, как элемент второго периода, может образовать только четыре ковалентные связи.
Азотная кислота - один из сильнейших окислителей. Глубина ее восстановления зависит от многих факторов: концентрация, температура, восстановитель. Обычно при окислении азотной кислотой образуется смесь продуктов восстановления:
HN+5O3 N+4O2 N+2O N+12O N02 [N-3H4]+
Превалирующим продуктом окисления концентрированной азотной кислотой неметаллов и неактивных металлов является оксид азота(IV):
I2 + 10HNO3(конц) = 2HIO3 + 10NO2 + 4H2O;
Pb + 4HNO3(конц) = Pb(NO3)2 + 2NO2 + 2H2O
Концентрированная азотная кислота пассивирует железо и алюминий. Алюминий пассивируется даже разбавленной азотной кислотой. Азотная кислота любой концентрации не действует на золото, платину, тантал, родий и иридий. Золото и платина растворяется в царской водке - смеси концентрированной азотной и соляной кислот в соотношении 1 : 3.
Au + HNO3 + 4HCl = H[AuCl4] + NO + 2H2O
Сильное окисляющее действие царской водки обусловлено образование атомарного хлора при распаде хлористого нитрозила - продукта взаимодействия азотной кислоты с хлороводородом.
HNO3 + 3HCl = Cl2 + NOCl + 2H2O;
NOCl = NO + Cl
Эффективным растворителем малоактивных металлов является смесь концентрированной азотной и плавиковой кислот.
3Ta + 5HNO3 + 21HF = 3H2[TaF7] + 5NO + 10H2O
Разбавленная азотная кислота при взаимодействии с неметаллами и малоактивными металлами восстанавливается преимущественно до оксида азота(II), например:
3P + 5HNO3(разб) + 2H2O = 3H3PO4 + 5NO;
3Pb + 8HNO3(разб) = 3Pb(NO3)2 + 2NO + 4H2O
Активные металлы восстанавливают разбавленную азотную кислоту до N2O, N2 или NH4NO3, например,
4Zn + 10HNO3(разб) = 4Zn(NO3)2 + NH4NO3 + 3H2O
Основная масса азотной кислоты идет на производство удобрений и взрывчатых веществ.
Получают азотную кислоту в промышленности контактным или дуговым способом, которые отличаются первой стадией - получением оксида азота(II). Дуговой способ основан на получении NO при пропускании воздуха через электрическую дугу. В контактном способе NO получают окислением аммиака кислородом на платиновом катализаторе. Далее оксид азота(II) окисляется до оксида азота(IV) кислородом воздуха. Растворяя NO2 в воде в присутствии кислорода получают азотную кислоту с концентрацией 60-65%.
4NO2 + O2 + 2H2O = 4HNO3
При необходимости азотную кислоту концентрируют перегонкой с концентрированной серной кислотой. В лаборатории 100 %-ную азотную кислоту можно получить действием концентрированной серной кислоты на кристаллический нитрат натрия при нагревании.
t
NaNO3(кр) + H2SO4(конц) = HNO3 + NaHSO4
Соли азотной кислоты - нитраты - хорошо растворимы в воде, термически неустойчивы. Разложение нитратов активных металлов (исключая литий), стоящих в ряду стандартных электродных потенциалов левее магния, приводит к образованию нитритов. Например:
t
2KNO3 = 2KNO2 + O2
При разложении нитратов лития, магния, а также нитратов металлов, расположенных в ряду стандартных электродных потенциалов правее магния, вплоть до меди, выделяется смесь оксида азота(IV) и кислорода. Например:
t
2Cu(NO3)2 = 2CuO + 4NO2 + O2
Нитраты металлов, расположенных в конце ряда активности, разлагаются до свободного металла:
t
2AgNO3 = 2Ag + 2NO2 + O2
Нитраты натрия, калия и аммония широко используются для производства пороха и взрывчатых веществ, а также в качестве азотных удобрений (селитры). В качестве удобрений используют также сульфат аммония, аммиачную воду и карбамид (мочевину) - полный амид угольной кислоты:

Азид водорода (динитридонитрат) - HN3 (HNN2) – бесцветная летучая жидкость (т.пл. –80 С, т.кип. 37 С) с резким запахом. Центральный атом азота находится в sp-гибридизации, степень окисления +5, соседние с ним атомы имеют степень окисления –3. Структура молекулы:

Водный раствор HN3 – азотистоводородная кислота по силе близка к уксусной, Ka = 2,610-5. В разбавленных растворах устойчива. Её получают взаимодействием гидразина и азотистой кислоты:
N2Н4 + HNO2 = HN3 + 2Н2О
По окислительным свойствам HN3 (HN+5N2) напоминает азотную кислоту. Так, если при взаимодействии металла с азотной кислотой образуются оксид азота(II) и вода, то с азотистоводородной кислотой – азот и аммиак. Например,
Cu + 3HN+5N2 = Cu(N3)2 + N20 + NH3
Смесь HN3 и HCl ведет себя подобно царской водке. Соли азотистоводородной кислоты - азиды. Относительно устойчивы только азиды щелочных металлов, при температуре > 300 С они разрушаются без взрыва. Остальные распадаются со взрывом при ударе или нагревании. Азид свинца используют в производстве детонаторов:
Pb(N3)2 = Pb + 3N20
Исходным продуктом для получения азидов является NaN3, который образуется в результате реакции амида натрия и оксида азота(I):
NaNH2 + N2O = NaN3 + H2O