
- •Глава 1. Химическая кинетика
- •1. Основные понятия и постулаты химической кинетики
- •2. Кинетика простых реакций
- •3. Методы определения порядка реакции
- •4. Влияние температуры на скорость химических реакций
- •5. Кинетика сложных реакций
- •6. Приближенные методы химической кинетики
- •7. Ферментативный катализ
- •8. Фотохимические реакции
- •9. Теории химической кинетики
- •2Ab линейный комплекс(ответ)
- •Глава 2. Электрохимия
- •10. Электропроводность растворов электролитов
- •11. Активность электролитов
- •12. Гальванический элемент
6. Приближенные методы химической кинетики
Для большинства сложных реакций, включающих несколько элементарных стадий, кинетические уравнения обычно настолько сложны, что их можно точно решить только численным интегрированием. В то же время, разные константы скорости, входящие в эти уравнения, отличаются друг от друга во много раз, что позволяет при решении кинетических уравнений использовать приближенные методы.
Мы рассмотрим два основных метода - метод квазистационарных (иногда просто - стационарных) концентраций и квазиравновесное приближение - на примере кинетической схемы:
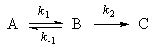
1. Приближение квазистационарных концентрацийприменяют в том случае, когда в ходе реакции образуются неустойчивые промежуточные вещества. Если скорость распада этих веществ намного превышает скорость их образования, то концентрация веществ в любой момент времени мала. Раз мала концентрация, то мала и скорость ее изменения, которую приближенно принимают равной 0. Условие квазистационарности позволяет выражать концентрацию промежуточных веществ через концентрации исходных веществ и тем самым упрощать кинетические уравнения.
Для приведенной выше схемы система кинетических уравнений имеет вид:

Если k2>>k1, то B - неустойчивое промежуточное вещество, концентрацию которого можно считать квазистационарной:
![]() ,
,
откуда
![]() .
Скорость образования продукта равна:
.
Скорость образования продукта равна:
![]() .
(6.1)
.
(6.1)
Таким образом, мы выразили скорость реакции через концентрацию исходного вещества, установили порядок реакции (первый) и выразили эффективную константу скорости через константы скорости отдельных элементарных реакций.
Приближение квазистационарных концентраций обычно применяется к реакциям с участием свободных радикалов, которые представляют собой реакционноспособные неустойчивые частицы.
2. Квазиравновесное приближениеприменяют в том случае, когда одна из реакций - обратимая, причем равновесие быстро устанавливается и медленно разрушается. Для приведенной выше схемы это означает, чтоk2<<k-1. Тогда концентрацию промежуточного продукта B можно выразить через константу равновесия:
![]() .
.
Скорость реакции равна:
![]() .
(6.2)
.
(6.2)
Опять, как и в приближении квазистационарных концентраций, мы получили реакцию первого порядка, однако с несколько отличающейся эффективной константой скорости. Уравнение (6.1) сводится к уравнению (6.2) при условии, что k2<<k-1.
Из рассмотрения данной схемы следует, что приближение квазистационарных концентраций и квазиравновесное приближение в некотором смысле противоположны друг другу: первое приближение применимо тогда, когда промежуточное вещество распадается быстро, а второе - когда оно распадается медленно.
ПРИМЕРЫ
Пример 6-1.Реакция конверсиипара-водорода ворто-водород протекает по следующему механизму (M - инертная частица):
п-H2+ M![]() H.+ H.+ M (k1)
H.+ H.+ M (k1)
H.+п-H2![]() H.+о-H2(k2)
H.+о-H2(k2)
H.+ H.+ M![]() п-H2+ M (k3)
п-H2+ M (k3)
Используя метод стационарных концентраций, получите выражение для скорости конверсии пара-водорода.
Решение.Из второго уравнения следует, что скорость образованияорто-водорода равна:
w=k2. [H.].[п-H2].
Для того, чтобы решить задачу, надо исключить из этого выражения концентрацию неустойчивого вещества - атомов водорода. Это можно сделать, приняв, что она не изменяется со временем:
![]() ,
,
откуда
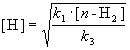 .
.
При оценке скорости изменения концентрации [H] мы учли, что в первой и третьей реакциях образуются и расходуются по два атома H, а во второй реакции число атомов H не изменяется. Подставляя концентрацию [H] в выражение для скорости реакции, получаем окончательный результат:
 .
.
Из этого результата мы видим, как в сложной реакции может получиться дробный порядок.
Пример 6-2.Механизм ренатурации ДНК из двух ветвей спирали имеет вид:

Предполагая, что первая стадия - быстрая, а вторая - медленная, выведите уравнение для скорости образования устойчивой двойной спирали и выразите общую константу скорости реакции через константы скорости элементарных стадий.
Решение.Условия задачи позволяют применить квазиравновесное приближение. Концентрация неустойчивой двойной спирали в этом приближении равна:
![]() .
.
Скорость реакции определяется скоростью второй стадии:
![]() .
.
Образование устойчивой двойной спирали ДНК - реакция второго порядка с эффективной константой скорости k=k1. k2/k-1.
ЗАДАЧИ
6-1.Механизм некоторой ферментативной реакции имеет вид:
![]()
Используя метод квазистационарных концентраций для комплекса фермента с субстратом, выразите скорость образования продукта через текущиеконцентрации фермента, субстрата и продукта.(ответ)
6-2.Для реакции NO2Cl![]() NO2+ 1/2Cl2предложен следующий
двухстадийный механизм:
NO2+ 1/2Cl2предложен следующий
двухстадийный механизм:
NO2Cl
![]() NO2
+ Cl.
(k1)
NO2
+ Cl.
(k1)
NO2Cl
+ Cl.
![]() NO2+ Cl2(k2)
NO2+ Cl2(k2)
Используя метод квазистационарных концентраций, выведите уравнение для скорости разложения NO2Cl.(ответ)
6-3.Для реакции синтеза иодоводорода
из простых веществ H2+ I2![]() 2HI
предложен следующий механизм:
2HI
предложен следующий механизм:
I2
![]() 2I.
(k1)
2I.
(k1)
2I.
![]() I2
(k2)
I2
(k2)
2I.
+ H2
![]() 2HI
(k3)
2HI
(k3)
Используя квазиравновесное приближение, выведите уравнение для скорости образования HI и покажите, что данная реакция имеет второй порядок.(ответ)
6-4.В одной из теорий мономолекулярных реакций предложен следующий механизм активации молекул (схема Линдемана):
активация: A + A ![]() A*
+ A, (k1)
A*
+ A, (k1)
дезактивация: A + A* ![]() A
+ A, (k-1)
A
+ A, (k-1)
распад: A*
![]() продукты.
(k2)
продукты.
(k2)
Используя метод квазистационарных концентраций, выведите уравнение для скорости мономолекулярной реакции и определите порядок реакции при больших и малых концентрациях [A].(ответ)
6-5.Для тримолекулярной реакции 2NO
+ O2![]() 2NO2предложен следующий механизм:
2NO2предложен следующий механизм:
2NO ![]() (NO)2,
(k1,
k-1)
(NO)2,
(k1,
k-1)
(NO)2
+ O2
![]() 2NO2.
(k2)
2NO2.
(k2)
Определите порядок суммарной реакции, предполагая, что первая стадия - быстрая, а вторая - медленная.(ответ)
6-6.Конденсация ацетона (CH3)2CO в водном растворе катализируется основаниями, которые обратимо реагируют с ним с образованием карбаниона C3H5O-. Карбанион реагирует с молекулой ацетона и дает продукт реакции. Упрощенный механизм выглядит так:
AH + B ![]() A-
+ BH+
(k1)
A-
+ BH+
(k1)
A-
+ BH+
![]() AH
+ B (k2)
AH
+ B (k2)
A-+ AH![]() продукт
(k3)
продукт
(k3)
Используя метод стационарных концентраций, найдите концентрацию карбаниона и выведите уравнение для скорости образования продукта.(ответ)
6-7.Составьте кинетические уравнения для следующего механизма газофазной реакции:
A
![]() B,
B + C
B,
B + C![]() D
D
Определите скорость образования продукта в приближении квазистационарных концентраций. Покажите, что при высоких давлениях реакция может протекать по первому порядку, а при низких давлениях - по второму порядку.(ответ)
6-8.Химическая реакция N2O![]() N2+ 1/2O2протекает по следующему
механизму (M - инертная частица):
N2+ 1/2O2протекает по следующему
механизму (M - инертная частица):
N2O
+ M ![]() N2O*
+ M (k1)
N2O*
+ M (k1)
N2O*
![]() N2
+ O.
(k2)
N2
+ O.
(k2)
N2O*
+ M ![]() N2O
+ M (k3)
N2O
+ M (k3)
N2O
+ O.
![]() N2+ O2(k4)
N2+ O2(k4)
Считая концентрации N2O* и O.стационарными, найдите выражение для скорости распада N2O.(ответ)
6-9.Составьте кинетическое уравнение
для скорости разложения оксида азота
(V) по суммарному уравнению 2N2O5(г)![]() 4NO2(г)
+ O2(г) при следующем механизме
реакции:
4NO2(г)
+ O2(г) при следующем механизме
реакции:
N2O5
![]() NO2
+ NO3,
(k1)
NO2
+ NO3,
(k1)
NO2
+ NO3
![]() N2O5,
(k-1)
N2O5,
(k-1)
NO2
+ NO3
![]() NO2
+ O2 +
NO, (k2)
NO2
+ O2 +
NO, (k2)
NO + N2O5
![]() 3NO2,
(k3)(ответ)
3NO2,
(k3)(ответ)
6-10.Составьте кинетическое уравнение
для скорости разложения оксида азота
(V) по суммарному уравнению 2N2O5(г)![]() 4NO2(г)
+ O2(г) при следующем механизме
реакции:
4NO2(г)
+ O2(г) при следующем механизме
реакции:
N2O5
![]() NO2
+ NO3,
(k1)
NO2
+ NO3,
(k1)
NO2
+ NO3
![]() N2O5,
(k-1)
N2O5,
(k-1)
NO2
+ NO3
![]() NO2
+ O2 +
NO, (k2)
NO2
+ O2 +
NO, (k2)
NO + NO3
![]() 2NO2,
(k3)
2NO2,
(k3)
Указание. Интермедиаты - NO и NO3.(ответ)
6-11.Дана схема цепной реакции:
AH
![]() A.+ H., (k1)
A.+ H., (k1)
A.
![]() B.
+ C, (k2)
B.
+ C, (k2)
AH + B.
![]() A.
+ D, (k3)
A.
+ D, (k3)
A.+ B.![]() P.
(k4)
P.
(k4)
Назовите стадии зарождения, развития и обрыва цепи. Используя метод квазистационарных концентраций, покажите, что образование продукта P описывается кинетическим уравнением первого порядка.(ответ)
6-12.Дана кинетическая схема:
CH4+ M![]() CH3.
+ H.+ M, (k1)
CH3.
+ H.+ M, (k1)
CH3.
+ CH4
![]() C2H6
+ H. ,
(k2)
C2H6
+ H. ,
(k2)
H.
+ CH4
![]() H2
+ CH3.
, (k3)
H2
+ CH3.
, (k3)
H.+ CH3. + M![]() CH4+ M, (k4)
CH4+ M, (k4)
(M - инертная молекула). Используя метод квазистационарных концентраций, выразите скорость образования этана через концентрацию метана.(ответ)
6-13.Реакция разложения бромметана
2CH3Br![]() C2H6+ Br2может протекать по следующему
механизму:
C2H6+ Br2может протекать по следующему
механизму:
CH3Br
![]() CH3.
+ Br.
, (k1)
CH3.
+ Br.
, (k1)
CH3.
+ CH3Br
![]() C2H6
+ Br.
, (k2)
C2H6
+ Br.
, (k2)
Br.
+ CH3Br
![]() CH3.
+ Br2,
(k3)
CH3.
+ Br2,
(k3)
2CH3. ![]() C2H6.
(k4)
C2H6.
(k4)
Используя метод стационарных концентраций, найдите выражение для скорости образования этана.(ответ)
6-14.Термическое разложение углеводорода R2протекает по следующему механизму:
R2![]() 2R.(k1)
2R.(k1)
R.
+ R2
![]() PB
+ R'.
(k2)
PB
+ R'.
(k2)
R'.
![]() PA
+ R.
(k3)
PA
+ R.
(k3)
2R.
![]() PA
+ PB
(k4)
PA
+ PB
(k4)
где R2, PA, PB- устойчивые углеводороды, R.и R'.- радикалы. Найдите зависимость скорости разложения R2от концентрации R2.(ответ)
6-15.Дана кинетическая схема разложения ацетальдегида:
CH3CHO![]() CH3.
+ CHO (k1)
CH3.
+ CHO (k1)
CH3.
+ CH3CHO
![]() CH4
+ CH2CHO.
(k2)
CH4
+ CH2CHO.
(k2)
CH2CHO.
![]() CO
+ CH3.
(k3)
CO
+ CH3.
(k3)
CH3.
+ CH3.
![]() C2H6(k4)
C2H6(k4)
Используя приближение стационарных концентраций, получите выражение для скорости образования метана и скорости расходования ацетальдегида.(ответ)
6-16.Реакцию радикального дегидрирования этана можно описать с помощью механизма Райса-Герцфельда, который включает следующие стадии:
инициирование: CH3CH3![]() 2CH3.
, (k1)
2CH3.
, (k1)
развитие цепи: CH3. +
CH3CH3
![]() CH4
+ CH3CH2.
, (k2)
CH4
+ CH3CH2.
, (k2)
CH3CH2.
![]() CH2=СH2
+ H. ,
(k3)
CH2=СH2
+ H. ,
(k3)
H.
+ CH3CH3
![]() H2
+ CH3CH2.
, (k4)
H2
+ CH3CH2.
, (k4)
обрыв цепи: H.
+ CH3CH2.
![]() CH3CH3.
(k5)
CH3CH3.
(k5)
Найдите уравнение для скорости образования этилена, если константа k1мала. Как можно изменить условия, чтобы изменился порядок?(ответ)
6-17.Дана кинетическая схема дегидрирования этана:
C2H6
![]() 2CH3.
(k1)
2CH3.
(k1)
CH3.
+ C2H6
![]() CH4
+ C2H5.
(k2)
CH4
+ C2H5.
(k2)
C2H5. ![]() H.+ C2H4(k3)
H.+ C2H4(k3)
H.+ C2H5. ![]() C2H6(k4)
C2H6(k4)
Используя приближение стационарных концентраций, получите выражение для скорости образования этилена.(ответ)
6-18.Химическая реакция 2C2H6![]() C4H10+ H2протекает по следующему
механизму:
C4H10+ H2протекает по следующему
механизму:
C2H6
![]() C2H5.
+ H.
(k1)
C2H5.
+ H.
(k1)
H.
+ C2H6
![]() C2H5.
+ H2(k2)
C2H5.
+ H2(k2)
C2H5. + C2H6![]() C4H10+ H.(k3)
C4H10+ H.(k3)
2C2H5. ![]() C4H10(k4)
C4H10(k4)
Используя метод стационарных концентраций, получите выражение для скорости образования бутана.(ответ)
6-19.Дана кинетическая схема радикального хлорирования тетрахлорэтилена в растворе CCl4:
Cl2![]() 2Cl.(k1)
2Cl.(k1)
Cl.
+ C2Cl4
![]() C2Cl5.
(k2)
C2Cl5.
(k2)
C2Cl5.
+ Cl2
![]() Cl.
+ C2Cl6
(k3)
Cl.
+ C2Cl6
(k3)
2C2Cl5.
![]() C2Cl6+ C2Cl4(k4)
C2Cl6+ C2Cl4(k4)
Используя приближение стационарных концентраций, получите выражение для скорости образования гексахлорэтана.(ответ)
6-20.Реакция образования фосгена CO
+ Cl2![]() COCl2может протекать по следующему механизму:
COCl2может протекать по следующему механизму:
Cl2
![]() 2Cl.
, (k1)
2Cl.
, (k1)
2Cl.
![]() Cl2,
(k2)
Cl2,
(k2)
CO + Cl.
![]() COCl.
, (k3)
COCl.
, (k3)
COCl.
![]() CO
+ Cl., (k4)
CO
+ Cl., (k4)
COCl.+ Cl2![]() COCl2+ Cl.. (k5)
COCl2+ Cl.. (k5)
Используя метод стационарных концентраций, найдите выражение для скорости образования фосгена.(ответ)
