
химия методичка / Конспекты по химии
.pdf
o V0 – объём газа при н.у., то есть при P0 = 101,325 кПа и T0 = 273K; o V – объём газа при давлении Р и температуре Т.
Если известно количество вещества или масса газа, а нужно вычислить объём, то применяют
уравнение Клапейрона – Менделеева:
PV =mRT / M или PV = nRt
Где R – универсальная газовая постоянная, равная 8,31 Дж/ моль × град.
СЕРА И ЕЁ СВОЙСТВА
Сера – S (Sulphur) – элемент №16, находится в VIА группе в 3 малом периоде. Вместе с кислородом относится к так называемым «халькогенам» или «руды рождающим» элементам: PbS – свинцовый блеск, CuFeS2 – медный колчедан, ZnS – цинковая обманка и др. Электронная конфигурация её атома 1s22s22p63s23p43d0.
Вневозбуждённом состоянии атом серы имеет 2 неспаренных электрона, при возбуждении их число становится равным 4, затем 6. В связи с этим сера бывает II, IV и VI – валентна и приобретает при этом степени окисления соответственно -2, +2, +4, +6.
Вприроде встречается в виде сульфидных руд, о которых уже упоминалось, и сульфатов (Na2SO4 10H2O – глауберовой соли и
CaSO4 2H2O – гипса). Встречается и самородная сера – обычно в районах активной вулканической деятельности. Сера есть в составе нефти, каменного угля и некоторых природных газов. Входит в состав белков живого организма.
Физические свойства
Образует несколько аллотропных модификаций. Среди них наиболее обычными являются: S8 – хрупкие золотисто-жёлтые кристаллы со стеклянным блеском, легко размалываются в
тончайший порошок (сера молотая), абсолютно не смачиваются водой, всплывая на её поверхность (флотация). Плавится уже при температуре +113оС.
Sn – коричневато-чёрное эластичное вещество, получается из расплавленной кристаллической серы при охлаждении водой; довольно быстро превращается в S8.
S2 - удушливый газ жёлтого цвета, образуется при испарении кипящей серы, обычно в области действующих вулканов.
Химические свойства
В зависимости от того, с какими веществами реагирует, сера может выступать и как окислитель, и как восстановитель:
Сера – окислитель
2S0 + C0 → С+4S-22
S+ H2 → H2S
S+ Fe → FeS
S+ Hg → HgS
Сера ─ восстановитель
S0 + O02 → S+4O-22
2S + Cl2 → S2Cl2
S+ 2H2SO4 → 3SO2+ 2H2O
S+ 4HNO3 → SO2 + 4NO2 + 2H2O
Соединения серы
H2S – сероводород, смертельно ядовитый газ, имеет зловонный запах тухлых яиц, немного растворяется в воде, образуя раствор очень слабой сероводородной кислоты (соли – сульфиды, гидросульфиды); восстановитель.
2H2S +3O2 → 2SO2 + 2H2O
2H2S + O2 → 2S + 2H2O (на холоде)
11

H2S + H2SO4 → SO2 + S + 2H2O
В лаборатории этот газ получают (тяга!) при действии соляной кислоты на сульфид железа или при нагревании смеси серы с парафином:
2HCl + FeS → H2S + FeCl2
Большинство солей сероводородной кислоты нестойкие, в воде разлагаются вследствие гидролиза. Применяются в аналитической химии; CdS – жёлтый, HgS – красный, PbS – чёрный, ZnS – белый, - пигменты.
SO2 − сернистый газ или диоксид серы, тяжёлый бесцветный газ с резким запахом, хорошо растворяется в воде:
SO2 + H2O → H2SO3 ↔ H+ + HSO3- ↔ 2H+ + SO32- 2SO2 + O2 кат→ 2SO3
SO2, H2SO3 и её соли – сульфиты, являются восстановителями, хорошо отбеливают материалы. SO3 – триоксид серы, тяжёлая бесцветная жидкость с toкип= + 45оС, гидрофильна:
SO3 + H2O → H2SO4
SO3 – промежуточный продукт сернокислотного производства, на последней стадии которого образуется олеум:
mSO3 + nH2SO4 → nH2SO4 • mSO3
АЛКАНЫ. SP3 - ГИБРИДИЗАЦИЯ
Алканами называются углеводороды с общей формулой
CnH2n+2
Их также называют парафинами или насыщенными углеводородами.
Углерод в их молекулах находится в валентном состоянии sp3—гибридизации.
В результате такой гибридизации каждый атом углерода может образовать 4 совершенно одинаковые s - связи.
Составляют гомологический ряд, в котором каждый последующий член отличается от предыдущего на метиленовую группу – СН2 - , называемую гомологической
разностью.
Физические свойства
С1 – С4 газы, С5 – С15 жидкости, С16 и выше – твёрдые вещества. При отщеплении 1 атома водорода образуют короткоживущие, но очень агрессивные частицы – радикалы.
Химические свойства
Сами по себе алканы довольно инертны (долгое время считалось, что кроме горения, они не дают других химических реакций). Однако при нагревании или в присутствии катализаторов алканы подвергаются пиролизу, окисляются, нитруются, с галогенами на свету – взрываются.
CH4 + 2O2 → CO2 + 2H2O
CH4 + Cl2 → CH3Cl + HCl … (цепная реакция)
C4H10 + HO-NO2 → C4H9NO2 + H2O (реакция Коновалова) СH4 → C + 2H2 ↑ или 2СH4 → C2H2↑ + 3H2↑
2C15H32 + 3O2 → 2C14H29-COOH + 2H2O
Наиболее характерная для алканов реакция – реакция замещения с галогенами, которая носит цепной свободнорадикальный характер. На воздухе алканы горят некоптящим пламенем
12

(газообразные алканы – синим пламенем, а жидкие и твёрдые, входящие в состав бензина, керосина, парафина, − желтоватым). Типичный представитель – метан.
СН4 − метан: газ без цвета и запаха, лёгкий, не растворяется в воде. Молекула СН4 имеет форму
тетраэдра.
Химические свойства метана
метан горит синеватым пламенем, смеси его с воздухом и кислородом взрываются, от вспышки света взрывается смесь метана с хлором, при нагревании без доступа воздуха происходит термическое разложение – пиролиз; при нагревании в присутствии сильных окислителей, например HNO3, также происходит химическая реакция.
Применение метана
как высококалорийное экологически чистое топливо, химическое сырьё для производства технического углерода (сажи), ацетилена, водорода, растворителей, лекарств и других полезных веществ.
Получение метана
метан получают из природного газа, в котором его может быть до 80% . При ректификации природного газа также получаются этан, пропан и бутан. Остальные алканы выделяют в основном из нефти.
ХИМИЧЕСКИЙ ЭЛЕМЕНТ, ЗНАКИ, ФОРМУЛЫ
Одно из основных понятий химии – понятие о химическом элементе. Под химическим элементом понимается определенный вид атомов с
одинаковым положительным зарядом ядра. Сейчас известно 114 химических элементов (многие получены ядерным синтезом). Из них в природе найдено 88. Элементы принято обозначать
химическими знаками или символами,
состоящими только из первой или из первой и одной из последующих букв латинского наименования. Такие символы
введены в науку в 1813 г. шведским химиком Берцелиусом. Химический знак обозначает не только название, но также 1 атом и 1 моль атомов данного элемента. Из химических элементов состоят все вещества, которые подразделяются на
13

простые и сложные. Простые вещества состоят из атомов, молекул или кристаллов,
образованных одним химическим элементом.
Сложные вещества состоят из молекул или кристаллов, образованных разными химическими элементами. Если один элемент образует несколько простых веществ, такое явление называется аллотропией (О2 и О3; Р4 и Рn…). Элементарный состав веществ обозначают химической формулой. При этом вещества с атомным строением (металлы, некоторые неметаллы – C, Si, В) обозначают как и элемент символом.
Химическая формула – это условная запись химического состава вещества, выполненная при
помощи химических символов и индексов: H2O, NaOH, H3PO4…
Она обозначает:
1). Химический состав вещества;
2). 1 молекулу вещества;
3). 1 моль вещества.
По химической формуле можно определить массовую долю ω (или w) каждого элемента в веществе: В природе распространены не чистые вещества, а в основном смеси: воздух, вода, горные породы… Смеси могут быть гомогенными (однородными) – воздух, сплавы металлов или гетерогенными (неоднородными) – дым, туман, суспензии… Как чистые вещества, так и смеси находят разнообразное применение в хозяйстве.
СЕРНАЯ КИСЛОТА – H2SO4
При растворении в воде оксида серы (VI) образуется серная кислота: SO3 + H2O → H2SO4
Физические свойства
Чистая H2SO4 – бесцветная сиропообразная (вязкая) жидкость, без запаха (нелетучая), ρ = 1,84 г ⁄ см3; t0кип. = 3380C, при кипении начинает разрушаться. Очень гидрофильна, поэтому ее применяют для осушения веществ, например газов. Смешивается с водой в любых отношениях. При этом следует наливать только кислоту тонкой струей в воду:
m H2SO4 + n H2SO4 → m H2SO4 • n H2O + Q кдж,
чтобы не происходило закипания более легкой воды и разбрызгивания кислотного раствора.
Химические свойства
Очень сильная, двухосновная кислота, сильный окислитель (особенно концентрированная), при контакте с органическими веществами обезвоживает их, обугливает или вступает в этерификацию:
H2SO4 → H+ + HSO4- → 2H+ + SO42- H2SO4 + NaCl → NaHSO4 + HCl↑ H2SO4 + 2NaCl → Na2SO4 + 2HCl↑
H2SO4 + Zn → ZnSO4 + H2↑
2H2SO4 + Сu → CuSO4 + 2H2O + SO2↑ C2H5OH + H2SO4 → C2H5O-SO2OH + H2O C12H22O11 + H2SO4 → 12C + H2SO4 • 11H2O
Для распознавания серной кислоты и ее солей применяют хлорид или нитрат бария:
SO42- + Ba2+ → BaSO4↓
Образуется однородный белый, нерастворимый в кислотах осадок.
Применение
В производстве кислот, солей, минеральных удобрений, химических волокон, эфиров, взрывчатых веществ, СМС, травления металлов, лекарств, как электролит в свинцовых аккумуляторах. По уровню прва H2SO4 в стране можно судить об уровне экономического развития.
Получение
Практически всю H2SO4 получают контактным способом.
Стадии производства серной кислоты: o Обжиг серосодержащего сырья;
o Очистка и осушение сернистого газа;
14
o Окисление SO2 до SO3;
o Поглощение SO3 с образованием олеума.
Оптимальными условиями контактного процесса являются: o Применение катализатора V2O5;
o t = 4500C;
o Повышенное давление;
o Непрерывность производства;
o Автоматизация, безотходность, комбинирование с другими отраслями – научные принципы. Сернокислотные заводы выпускают олеум (H2SO4 • SO3), который разбавляют до 96 – 98 % раствора.
ЦИКЛОПАРАФИНЫ ИЛИ НАФТЕНЫ
Это полиметиленовые углеводороды циклического строения с общей формулой
CnH2n
выделенные впервые из кавказской нефти В. В. Марковниковым. По химическим свойствам сходны с алканами (парафинами), но в отличии от последних могут вступать в реакцию присоединения за счет разрыва цикла.
Физические свойства
C3H6 – C4H8,– газы;
С5H10 – C7H14, – жидкости; далее – твердые вещества.
Химические свойства
2C3H6 + 9O2 → 6CO2↑ + 6H2O +Q C6H12 +Cl2 → C6H11Cl + HCl C6H12 + H2 → С6H14
C6H12 → C6H6 + 3H2↑
Применение
производство растворителей, СМС, лекарств, красителей, повышают октановое число бензина.
Получение
при перегонке нефти и искусственным путем.
ЭЛЕКТРОЛИЗ. КОРРОЗИЯ МЕТАЛЛОВ
Электролиз – окислительно-восстановительный процесс, протекающий на электродах при прохождении постоянного электрического тока через расплав или раствор электролита. Установка для электролиза называется электролизер или электролитическая ванна.
Рассмотрим электролиз расплава и раствора в ванне с инертными (угольными) электродами.
а) Э. расплава NaCl (t0пл. = 8010 С).
NaCl = Na+ + Cl−
Na+ + e- = Na0 ;
Cl- - e- = Cl0 2 Cl0 = Cl02 Суммарное уравнение:
2 NaCl ток → 2Na + Cl2
б) Электролиз раствора NaCl (принимает участие и вода)
NaCl = Na+ + Cl-
HOH =H+ + OH-
H+ + e- = H0 , 2H0=H02↑ ; Cl- - e- = Cl0 , 2Cl0 = Cl02↑
В растворе:
Na+ + OH- = NaOH
Суммарное уравнение:
2NaCl + 2HOH ток→ H2 + Cl2 + 2NaOH
15
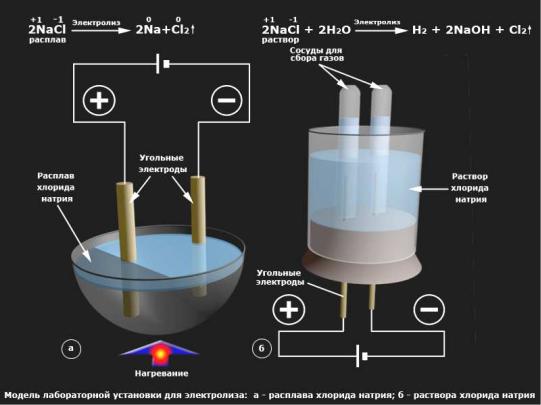
Электролиз применяется для гальванического покрытия одних металлов (Fe) другими (Ni , Cr …) – гальваностегия, в гальванопластике – изготовлении точных металлических копий предметов, для получения металлов (щелочных, щелочноземельных, Al, лантаноидов), рафинирование металлов, например, меди.
Другой важный окислительно-восстановительный процесс – коррозия металлов: это разрушение металла под воздействием окружающей среды. По механизму протекания различают два типа коррозии:
а) Химическая коррозия – окисление металла под влиянием воды, воздуха, кислот, щелочей…без возникновения электрического тока.
Fe0 + H+12 SO3 → H02↑ + Fe+2 SO3 Fe0 + 2H+1Cl → H02↑ + Fe+2 Cl2
2Fe0 + 2HOH + O02↑ → 2 Fe+2 (O-2 H)2 4Fe+2(OH)2 + 2HOH + O02→ 4Fe+3(O-2 H)3 или в общем виде:
Fe0 – 2e- → Fe+2
Fe+2 – e- → Fe+3
б) электрохимическая коррозия – окисление металла в среде электролита с возникновением электрического тока[всегда при контакте разных металлов ( гальваническая пара ) Fe – Zn , Fe – Sn , Fe – Cu и т.д.
2HOH=2H++ 2OH-
Fe2+ + 2OH- → Fe(OH)2 2H+ + 2e- → H02↑
Лучше протекает в кислой среде при избытке ионов H+ (воздух промышленных городов). Прямые потери железа от коррозии составляют 10 % ежегодной выплавки. Поэтому человечество вынуждено все время защищать металлические конструкции. Основные меры защиты следующие:
o неметаллическая поверхностная защита ( смазка, лак, краска, полимер). o металлическая поверхностная защита (покрытие Zn, Cr, Ni, Cu, Sn).
oсоздание коррозионно-устойчивых сплавов, которые хорошо пассивируются (хромоникелевые, ванадиевые, кобальтовые).
16

oпротекторная защита (создание на поверхности конструкции гальванической пары из более активного металла, например Mg, Al, Zn).
o изменение состава среды (распыление ингибиторов, введение их в среду).
ФОСФОР, ЕГО СВОЙСТВА. СОЕДИНЕНИЯ ФОСФОРА
Элемент №15 – фосфор, расположен в VА группе в 3 периоде. Аналог азота. Энергия ионизации значительно меньше, чем у азота, а радиус атома больше. Поэтому чаще всего фосфор бывает V - валентным (+ 5) и реже III --валентным (+ 3 и – 3). В природе только в виде соединений, в основном – фосфорит
Ca3(PO4)2.
Имеет несколько аллотропных модификаций (белый, красный, черный…)
а) P4 - белый фосфор, желтоватое, воскоподобное вещество,
чрезвычайно ядовит, светится в темноте, растворяется в CS2 , может самовоспламеняться.
б) Pn или P – красный фосфор, цвет варьирует от алого до краснофиолетового, не ядовит, устойчив, не растворяется в CS2 и H2O
Белый фосфор химически более активен:
4P + 3O2 → 2P2O3
4P + 5O2 → 2P2O5
2P + 3Cl2 → 2PCl3
2P + 5Cl2 → 2PCl5
2P +3H2 → 2PH3( фосфин – газ очень ядовитый с запахом чеснока ) 2PH3 + 4O2 → P2O5 + 3H2O( самовоспламенение )
PH3 + HJ → PH4J( иодид фосфония ) 3Mg + 2P → Mg3P2( фосфиды )
Mg3P2 + 6HOH → 3Mg(OH)2 + 2PH3↑( гидролиз)
Фактически фосфин получается только таким способом или при гниении белков, разложении трупов.
P2O3 + 3H2O → 2H3PO3 - фосфористая кислота, соли - фосфиты
P2O5 + H2O → 2HPO3 - метафосфорная кислота – метафосфаты
P2O5 + 3H2O → 2H3PO4 - ортофосфорная кислота – ортофосфаты Ортофосфаты – фосфорные удобрения.
АЛКАДИЕНЫ. КАУЧУК
Углеводороды с двумя двойными связями
CnH2n - 2
Атомы углерода при двойных связях находятся в состоянии sp2 - гибридизации. Поэтому свойства очень похожи на свойства алкенов.
CH2 = C = CH2 пропадиен (аллен ), кумулированные двойные связи
1CH2 = 2CH - 3CH = 4CH2 бутадиен -1,3
1CH2 = 2CH - 3CH = 4CH - 5CH3 пентадиен -1,3.
В последних двух веществах сопряжённые двойные связи. Такие алкадиены присоединяют, например, галогены в 2 стадии. Горят ярким коптящим пламенем . Наибольшее значение имеют алкадиены (- C = C – C = C -) с сопряженными связями.
а) Бутадиен-1,3 или дивинил – мономер для синтетического каучука.
Бутадиеновый каучук синтезирован впервые в мире в СССР (1932 г) коллективом учёных под руководством С.В. Лебедева:
17
n CH2 = CH – CH = CH2 Na → n CH2 - CH – CH – CH2 → ( - CH2 – CH = CH – CH2 - ) - полибутадиен Сырьём для получения такого каучука раньше служил дивинил, производимый из картофельного или хлебного спирта, поэтому производство СК было достаточно дорогим:
б) 2-метилбутадиен-1,3 или изопрен – мономер натурального и синтетического каучуков.
В настоящее время стремятся производить каучуки стереорегулярного строения с определенным расположением боковых радикалов в макромолекуле – они не уступают по качеству натуральному каучуку.
Для того, чтобы улучшить качество полимера – его превращают в резину – вулканизируют и добавляют наполнитель, например, сажу (технический углерод). При избытке серы все молекулы «сшиваются» по месту разрыва p-связей. Образуется пластмасса эбонит.
При вулканизации каучуков липкий и непрочный полимер превращается в упругую эластичную резину. В настоящее время получены многие десятки синтетических каучуков (СК) – хлоропреновый, бутадиен-стирольный, бутадиен-акрилонитрильный и др.
ЭЛЕКТРОЛИТИЧЕСКАЯ ДИССОЦИАЦИЯ
Основные положения теории электролитической диссоциации сформулированы в 1887г. шведским химиком Сванте Аррениусом. Важную роль в разработке этой теории сыграли русские ученые Менделеев, Каблуков, Кистяковский:
1) вещества делятся на электролиты (их водные растворы и расплавы проводят электрический ток) – с ионными и ковалентными сильнополярными связями, и неэлектролиты (растворы и расплавы не проводят электрического тока) – с ковалентными неполярными или малополярными связями.
2)электролиты в водных растворах и расплавах распадаются (диссоциируют) на положительные и отрицательные ионы.
3)под действием электрического поля ионы приобретают направленное движение: положительные идут к отрицательному электроду – катоду (катионы), а отрицательные к положительному аноду (анионы).
4)диссоциация – обратимый процесс:
параллельно с распадом молекул на ионы (диссоциация) протекает процесс соединения ионов
(ассоциация).
5) причинами электролитической диссоциации являются:
-ослабление химических связей между ионами в молекуле или кристалле дипольными молекулами воды и последующая гидратация ионов.
-ослабление химических связей при возрастании кинетической энергии ионов при нагревании (расплавлении).
С точки зрения теории электролитической диссоциации:
а) кислоты – электролиты, образующие при диссоциации катионы только H+ (ионы гидроксония
H3O+);
б) основания – электролиты, образующие при диссоциации анионы только ОН (гидроксид-ионы); в) соли – электролиты, образующие при диссоциации катионы металлов или NH4+ и анионы кислотных остатков.
Примечание: кислые соли дают также Н+
Основные соли дают также OH-
Сила электролитов определяется его степенью диссоциации – α
α= nдис • 100% / Nобщ
α< 2% - слабые электролиты (H2O, H2S)
30% >α> 2% - средней силы электролиты (H2SO3)
α >> 30% ( ≈100%) - cильные электролиты (NaOH, HCl , NaCl и др.) Большинство солей, основания щелочных, щелочноземельных металлов,
TlOH, многие кислоты, диссоциируют практически полностью и являются сильными электролитами.
18

МИНЕРАЛЬНЫЕ УДОБРЕНИЯ
Вещества, главным образом соли, содержащие необходимые для растений элементы питания, называются минеральными удобрениями. Их вносят в почву для повышения её плодородия. а) Макроудобрения или просто удобрения – содержат N, P, K и также Cа, Mg, Fe, S:
простые (1 питательный элемент): KCl, NH4NO3.
сложные (2 и более питательных элементов): KNO3, K3PO4, Ca(NO3)2
смешанные (тукосмеси из простых и сложных удобрений, часто с добавками микроудобрений): нитрофоска, нитроаммофос и др.
б) Микроудобрения содержат микроэлементы – Cu, Zn, Mn, B, Co, Mo; их образно называют витамины полей – CuSO4, KMnO4, ZnSO4, CoSO4 и др.
По содержанию основного питательного элемента удобрения подразделяются: азотные (N) – синтез белка, рост вегетативных органов
NH4NO3 – аммиачная селитра
(NH2)2CO – карбамид или мочевина, самое питательное азотное удобрение фосфорные (P2O5) – синтез белка, развитие плодов и семян
Ca(H2PO4)2 – двойной суперфосфат Ca3(PO4)2 – фосфоритная мука CaHPO4 · 2H2O – преципитат
калийные(K2O) – цветение и плодоношение К2СО3 – поташ (в золе)
KCl – калийная соль (хлористый калий) К2SO4 – сульфат калия
Определение питательной ценности фосфорных и калийных удобрений - это определение содержания P2O5 или K2O, носит условный характер. Питательная ценность азотных удобрений определяется по реальному содержанию N в процентах.
ГЕНЕТИЧЕСКИЕ СВЯЗИ УГЛЕВОДОРОДОВ
Между основными классами углеводородов существуют генетические связи, которые можно реализовать, если знаешь химические свойства этих соединений.
РЕАКЦИИ ИОННОГО ОБМЕНА
Реакции между электролитами в растворах – это реакции между ионами, образовавшимися при
их диссоциации. Такие реакции называют ионными.
Рассмотрим поведение двух электролитов в растворе. Допустим, что мы налили в пробирку немного раствора бромида калия и начали приливать к нему раствор сульфата натрия. Поскольку мы взяли растворы солей, то в пробирке теперь находится два вида катионов К+ и Na+ и два вида анионов Br – и SO42-. Ионы в растворе движутся хаотично, сталкиваясь друг с другом своими гидратными оболочками, в результате такого взаимодействия протекает следующая реакция:
19

2KBr + Na2SO4 ↔ K2SO4 + 2NaBr
2K+ + 2Br - + 2Na+ + SO2-4 ↔ 2Na+ + 2Br – + 2K+ + SO42-
Из уравнения видно, что образовавшиеся вещества K2SO4 и NaBr также диссоциируют и вновь взаимодействуют, поэтому реакция никогда не завершится. Ионы сколь угодно долго могут находиться в растворе, не образуя устойчивых связей друг с другом.
Реакции ионного обмена проходят необратимо, если в результате образуется малорастворимое или малодиссоциирующеее соединение, в том числе и вода. Продукт
реакции может выделяться в виде осадка или газа.
Например:
Ba(OH)2 + 2HCI → BaCI2 + 2H2O
Ba2+ + 2OH- + 2H+ + 2CI- → Ba2+ + 2CI- + 2HOH 2H+ + 2OH- → 2HOH
H+ + OH- → H2O
AgNO3 + HCI → HNO3 + AgCI↓
Ag+ + NO-3 + H+ + CI- → H+ + NO-3 + AgCI↓
Ag+ + CI- → AgCI↓
K2CO3 + H2SO4 → K2SO4 + H2CO3 (CO2↑ + H2O)
2K+ + CO32- + 2H+ + SO42- → 2K+ + SO42- + CO2↑ + H2O
2H+ + CO32- → CO2↑ + H2O
При составлении уравнений ионных реакции вещества нерастворимые в воде, а также вещества, не диссоциирующие или слабо диссоциирующие записывают в молекулярной форме ( в том числе и летучие соединения), а все остальные – в ионной.
Обменные реакции между любыми кислотами и основаниями называют реакциями
нейтрализации. Продуктами нейтрализации являются соли и вода.
KOH + HNO3 → KNO3+H2O
K+ + OH- + H+ + NO3- → K+ + NO3- + H2O H+ + OH-→ H2O
В некоторых реакциях нейтрализации наряду с водой выпадает осадок, т.е. малорастворимая или нерастворимая соль, например:
Ba(OH)2 + H2SO4 → BaSO4↓+ 2H2O
Тогда полное ионное уравнение будет иметь следующий вид:
Ba2+ + 2OH- + 2H+ + SO42- → BaSO4↓ + 2H2O
Реакции ионного обмена используются в аналитической химии для определения ионов в неизвестных растворах.
Реакции, с помощью которых можно установить, какие ионы находятся в растворе, называются
качественными реакциями.
Например, качественная реакция на ионы Ag+, SO42- и так далее.
ПОДГРУППА УГЛЕРОДА
Главная подгруппа IV группы периодической системы включает следующие элементы: углерод, кремний, германий, олово, свинец. Формула внешнего энергетического уровня:
n s2p2
Для элементов IV А группы характерны степени окисления +2;+;4, реже реализуется степень окисления -4.
При перемещении вниз по группе происходит возрастание атомного радиуса элементов и ослабление связи между атомами.
20
