
химия методичка / Конспекты по химии
.pdf
Полетаев Олег Николаевич, учитель химии и биологии средней общеобразовательной школы №2 г. Пошехонье Ярославской области
Конспекты по химии
ПРЕДМЕТ И ЗАДАЧИ ХИМИИ
Окружающий нас мир образован различными видами материи, которая находится в состоянии непрерывного движения, изменения и развития. При этом одни формы движения могут переходить
вдругие. Так механическое движение переходит в тепловое, тепловое – в химическое, химическое –
вэлектрическое и т.д. Отдельные формы движения материи изучаются различными естественными науками: физикой, химией, биологией и др.
Химия – наука о веществах, их свойствах, строении и взаимных превращениях. Предметом химии являются химические элементы и их соединения, а также закономерности, которым
подчиняются различные химические реакции.
Под химической реакцией (химическим изменением) понимается процесс образования из одних веществ, других, новых веществ. При этом происходят такие физические изменения как: выпадение или растворение осадков, выделение газов, изменение цвета, температуры, образование пламени, взрыв. Поэтому химия тесно связана с физикой. Химия также связана и с биологией, поскольку жизненные процессы сопровождаются непрерывными химическими реакциями.
Современная химия настолько обширная область естествознания, что многие её разделы по существу являются самостоятельными науками, хотя и тесно взаимосвязанными: неорганическая
химия, органическая химия, биохимия, физическая химия, аналитическая химия, фармацевтическая химия и др.
В современной жизни, особенно в производстве, химия играет очень важную роль, решая при этом следующие задачи:
—изучение строения веществ;
—описание веществ (выявление их свойств);
—определение для веществ области применения;
—разработка способов получения веществ.
Отсюда важнейшая задача химии – всемерное развитие химической промышленности, полное использование во всех областях достижений современной химии.
1

Химические методы исследования и химические теории находят применение в физике, биологии, медицине, – в разрешении их проблем.
VII А ГРУППА ─ ГАЛОГЕНЫ
Элементы главной подгруппы VII группы – F, Cl, Br, J, [At] называются галогенами, что буквально означает «солероды». Это название связано со способностью галогенов взаимодействовать с металлами с образованием типичных солей (NaCl, KJ, AlBr3, CaF2 и т.д.).
Их атомы легко присоединяют к себе недостающий до октета электрон, превращаясь в однозарядный отрицательный ион.
Склонность к присоединению электрона характеризует галогены как типичные неметаллы. F в соединениях имеет степень окисления –1, остальные – от –1 до +7, при этом низшая и высшая степени окисления наиболее устойчивы.
В свободном состоянии галогены в природе не встречаются, а лишь в виде соединений. Обычно это галогениды щелочных и щелочноземельных металлов – NаСl, КСl, СаСl2 и др. Искусственно получаемые простые вещества чрезвычайно ядовиты и реакционноспособны, состоят из двухатомных молекул: F2 (желтый газ), Сl2 (желто-зеленый газ), Вr2 (красно-бурая тяжелая, но легкокипящая жидкость), J2(серые кристаллы с металлическим блеском, при незначительном нагревании возгоняются в фиолетовый газ). Водородные соединения НF, НСl, НВr, НJ в водных
2

растворах являются кислотами, сила которых увеличивается от НF к НJ, но при этом уменьшается прочность молекул. Кроме F, остальные галогены имеют высший оксид R2О7, которому соответствуют сильные кислородсодержащие кислоты НRО4. С увеличением порядкового номера галогенов сверху вниз увеличивается радиус атомов, уменьшается электроотрицательность, ослабляются неметаллические и окислительные и усиливаются восстановительные свойства; F – самый электроотрицательный элемент, самый сильный окислитель, вытесняет все галогены, азот и даже кислород из их соединений
2F2 + KCl → 2KF + Cl2↑
2F2 + 2H2O → 4HF + O2↑
Иод самый пассивный среди галогенов, с признаками металла ( J2 – слабо проводит электрический ток, имеет металлический блеск). Все галогены, как уже упоминалось, летучи, ядовиты и из-за высокой активности в природе встречаются лишь в виде соединений.
В незначительных количествах содержатся в организме человека и играют важную физиологическую роль.
F- CaF2 (плавиковый шпат); Ca5(PO4)3F (фторапатит) – производство тефлона, негорючей смазки, жидкостей – хладагентов, необходим для развития зубной эмали (0,01% в человеческом организме).
Cl – KCl (калийная соль), NaCl (поваренная соль); KCl • MgCl2 • 6H2O (карналлит) – производство HCl и её солей, хлорной извести, отбеливателей, стерилизация питьевой воды, пищевая промышленность, производство бертолетовой соли, органических растворителей, пестицидов, каучуков и т.д. В организме человека 0,1% ( больше всего в желудочном соке и крови).
Br - KBr, NaBr (в морской воде и подземных рассолах) производство лекарств, фотоматериалов. J – (в красных и бурых морских водорослях, в подземных рассолах). Производство лекарств, фотоматериалов. Содержится в щитовидной железе и надпочечниках, регулирует уровень окислительных процессов и дыхания в клетках (при недостатке – зобная болезнь, при избытке - базедова болезнь).
ТЕОРИЯ А.М. БУТЛЕРОВА
Фундаментом органической химии является теория строения органических соединений, основные идеи, которой высказал русский профессор Александр Михайлович Бутлеров в докладе «О химическом строении вещества», сделанном им в 1861 году на научной конференции.
Впоследствии теория была дополнена трудами В.В.Марковникова и др. учёных. Основные положения её таковы:
1.Все атомы в молекулах органических соединений связаны в определённой последовательности в соответствии со своей валентностью (C – IV, H – I, O – II, галогены – I) Порядок соединения атомов в молекулах Бутлеров назвал химическим строением.
2.Все особенности органических соединений определяются свойствами элемента углерода, атомы которого могут образовывать, соединяясь последовательно, открытые цепи и замкнутые циклы:
3.Свойства веществ зависят не только от
химического состава, но и от химического строения – отсюда явление изомерии
4.По свойствам вещества можно определить строение его молекулы, а по химическому строению – предсказать свойства.
5.Атомы и атомные группы в молекулах взаимно влияют друг на друга.
Подобно Менделееву, Бутлеров не только изложил теорию, но и исходя из неё предсказал существование новых веществ и сам их синтезировал.
3

АТОМНО-МОЛЕКУЛЯРНОЕ УЧЕНИЕ
Основы этого учения заложил и впервые применил в химической практике русский учёныйэнциклопедист М.В.Ломоносов. Главные положения учения изложены в его работе «Элементы математической химии», вышедшей в 1741 году. Сущность учения можно свести к следующему:
1.все вещества состоят из молекул (по Ломоносову «корпускул»);
2.молекулы состоят из атомов (по Ломоносову – из «элементов»);
3.частицы вещества, то есть молекулы и атомы, находятся в непрерывном хаотическом движении; тепловое состояние тел есть результат движения этих частиц;
4.молекулы простых веществ состоят из одинаковых атомов, а молекулы сложных веществ – из разных атомов.
Лишь через 67 лет после М.В.Ломоносова атомно-молекулярное учение стало известно в зарубежной Европе благодаря трудам английского учёного Джона Дальтона. Окончательно же оно утвердилось в науке в середине 19 века. Велики заслуги в развитии учения таких учёных как Амедео Авогадро, Жозеф Пруст, Д.И. Менделеев и других. В 1860 на Международном химическом съезде были приняты определения понятий «молекула» и «атом».
Молекула – наименьшая частица данного вещества, обладающая его химическими свойствами. Химические свойства молекулы определяются её составом и строением. Атом – это наименьшая электронейтральная частица химического элемента, состоящая из
положительного ядра и отрицательно заряженных электронов.
Молекулы в химических реакциях разрушаются и образуются вновь, а атомы остаются неизменными.
Согласно современным представлениям из молекул состоят лишь газообразные и жидкие (в парах) вещества, а твёрдые – только имеющие молекулярную кристаллическую решётку. Большинство же твёрдых неорганических веществ имеют немолекулярное строение и состоят из ионов или атомов, образуя макротела (обычно – кристаллы).
В 1808 году французский учёный Жозеф Пруст сформулировал закон постоянства состава – один из основных законов химии:
«Всякое чистое вещество молекулярного строения имеет постоянный качественный и
количественный состав независимо от способа получения и местонахождения».
Понятно, что этот закон неприменим к веществам в ионном, металлическом и атомном состоянии. Например, оксид урана (+6) обычно записывают UO3, на деле же его простейшая формула лежит в пределах от UO2,5 до UO3. На основании этого закона, учитывая валентность элементов, составляют и записывают химические формулы веществ: Н2О, СО2, С2Н5 ОН и другие.
ХЛОР И ЕГО СВОЙСТВА
Химический элемент №17 – хлор (Сl) расположен в VIIА группе, в 3 малом периоде; галоген. Электронная конфигурация его атома : 1s2 2s2 2p6 3s2 3p5 3d0. Таким образом, на внешнем энергетическом уровне находится 7 электронов и 1 вакантное место. При возбуждении атома парные электроны с s-орбиталей и p-орбиталей могут переходить на незаселённые d-орбитали и валентные возможности атома расширяются. Валентности: от I до VII, но чаще нечётные, то
есть I,III,V,VII. Степени окисления:–1,+1,+3,+4,+5,+6,+7.
Формулы важнейших соединений: HCl(-1), Cl2O(+1), Cl2O3(+3), Cl2O5(+5), Cl2O7(+7). Эти оксиды являются неустойчивыми взрывоопасными веществами и кислотообразующие, им соответствуют кислоты: HOCl – хлорноватистая или хлорная (+1); HClO2 – хлористая или хлорная (+3); HClO3 – хлорноватая или хлорная (+5); HClO4 – хлорная или хлорная (+7). В природе
самый распространённый галоген и как все галогены находится только в связанном состоянии (NaCl, KCl и другие соединения). Свободный хлор впервые получен в 1774 году шведским химиком
Шееле.
4
Физические свойства
Cl2 – жёлто-зелёный газ с удушающим запахом, тяжёлый, немного растворим в воде, негорючий. Вдыхание хлора приводит к удушью, разрушению лёгких и смерти. В 1915 году кайзеровская Германия применила Cl2 , COCl2 (фосген) и другие ядовитые газы на реке Ипр в Бельгии в качестве БОВ.
Химические свойства
Хлор очень агрессивное вещество, сильный окислитель. Многие металлы, неметаллы, органические вещества ( в том числе красители ) и даже золото разрушаются в атмосфере хлора:
Cu + Cl2 → CuCl2
H2 + Cl2 → 2HCl
CH4 + Cl2 → CH3 Cl + HCl 2Au +3Cl2 → 2AuCl3 HOH + Cl2 → HCl +HOCl
6KOH + Cl2 → 5KCl + KClO3 +3H2O
Реакции с хлором – экзотермические, многие из них сопровождаются появлением пламени или взрывом.
Применение
Хлор применяется для производства хлороводорода и соляной кислоты, хлоридов, хлорной извести, отбеливателей, растворителей, пластмасс и каучуков, ядохимикатов.
Получение
1.В промышленности электролиз расплава или раствора хлорида натрия:
2NaCl ток→ 2Na + Cl2↑
2NaCl + 2HOH ток→ 2NaOH + Cl2↑ + H2↑
2.В лаборатории выделяют из различных хлорсодержащих соединений, обычно для этого применяют соляную кислоту:
4HCl + MnO2 → 2H2O + MnCl2 + Cl2
Соединения хлора
HCl – хлороводород; водный раствор его до 40% -- соляная кислота. AgCl – в фотографии.
KCl – калийное удобрение в сельском хозяйстве. CaCl2 – в медицине.
NaCl – в пищевой и химической промышленности.
HOCl и её соли Ca(OCl)2 и CaCl(OCl) – гипохлориты, -- отбеливатели и дезинфекторы. KClO3 – бертолетова соль в производстве спичек и в пиротехнике.
HClO4 – хлорная кислота, -- одна из самых сильных из всех известных кислот, самопроизвольно взрывается, применяется как сильнейший окислитель и только в водных растворах.
ИЗОМЕРИЯ
Одно из положений теории Бутлерова гласит:
Свойства веществ зависят не только от химического состава, но и от химического строения (иными словами, свойства веществ зависят не только от того, какие атомы и в каком
количестве входят в состав молекулы, но и от того, в каком порядке эти атомы соединены друг с другом). Это утверждение объясняет существование явления изомерии, то есть такого явления, когда при одинаковом химическом составе образуется несколько веществ с различными свойствами, так как в их молекулах атомы соединены по-разному. Существует несколько видов изомерии:
5

1)Изомерия структурная (углеродного скелета, положения заместителей, функциональных групп, кратных связей, межклассовая).
2)Изомерия пространственная или стереоизомерия (цис-транс, оптическая).
Этот вид изомерии связан с различным расположением в пространстве атомных групп. Явление изомерии во много раз увеличивает и без того большое количество органических соединений.
ЗАКОН СОХРАНЕНИЯ МАССЫ ВЕЩЕСТВ
Современные методы исследования позволяют определить очень малые массы атомов с большой точностью. Так m A(Н) = 1,674 × 10 -27 (кг), m A(С) = 1,993 × 10 -26 (кг). Естественно, что такими малыми величинами пользоваться неудобно, поэтому в химии традиционно применяются не абсолютные значения атомных масс, а относительные. С 1961 г. за единицу атомной массы стали
применять 1/12 массы атома ¹²С.
Аr – относительная атомная масса –это величина, которая показывает во сколько раз масса данного атома больше 1/12 массы атома ¹²С.В периодической системе указаны точные значения Аr с учетом распространенности в природе разных изотопов данного элемента. При расчетах принято их округлять:
Ar (H) = 1; Ar(C) = 12 ; Ar (O) = 16; Ar(Fe) = 56. Лишь Аr(Cl) = 35,5. Аr – одна из главных характеристик химического элемента. Молекулы веществ состоят из атомов и их массы также ничтожно малы. Поэтому в расчетах применяют относительную молекулярную массу.
Мr – относительная молекулярная масса – это величина, которая показывает во сколько раз масса данной молекулы больше 1/12 массы атома 12С. Мr численно равна сумме Аr всех атомов, входящих в состав молекулы, поэтому ее легко сосчитать по формуле вещества, например:
6

Мr(H2SO4) = 1 2+ 32 + 16 4 =98; Mr(CaCO3) = 40 + 12 + 16 3 = 100.
В химических реакциях молекулы разрушаются и образуются вновь. В 1748 году М.В.Ломоносов открыл закон, характеризующий количественную сторону химических реакций. Этот закон был назван законом сохранения массы веществ Ломоносов экспериментально подтвердил его в 1756 году. Современная формулировка этого закона такова:
Масса исходных веществ равна массе продуктов реакции.
С точки зрения атомно-молекулярного учения этот закон можно объяснить так. В химических реакциях атомы не исчезают и не возникают вновь, они лишь группируются в новые молекулы.
Общее число атомов каждого элемента до реакции и после нее остается неизменным (отсюда необходимость коэффициентов). А поскольку атомы имеют постоянную массу – не изменяется их суммарная масса до реакции (т.е. масса исходных веществ), и суммарная масса после реакции, (т.е. масса продуктов реакции).
2 Cu + O2 → 2 CuO
2 атома 1 молекула 2 молекулы ( 2 атома) (2 атома) (4 атома)
64 · 2 + 16 · 2 = 2· ( 64 + 16) 128 +32 = 160 160 = 160
Закон сохранения массы лишь частный случай общего закона сохранения массы веществ и энергии, который выражается уравнением Эйнштейна:
Е = mс2
Закон сохранения массы – материальная основа для составления уравнений химических реакций, он позволяет производить по ним количественные расчеты.
VІА ГРУППА ─ ХАЛЬКОГЕНЫ ИЛИ ПОДГРУППА КИСЛОРОДА. КИСЛОРОД
ВVІА группе расположены элементы О, S, Sе, Те, Ро. Их называют также «халькогенами», т.е. «рудообразующими».
На примере электронной формулы атома серы, видно какие степени окисления и валентности могут иметь халькогены: -2 , +2 , +4 , +6 (II,IV,VI).
Кислород в этом отношении является исключением (- 2 , +2 в соединениях с фтором; валентность всегда II) Сходством внешнего энергетического уровня объясняется сходство их химических свойств. Так все они образуют летучие водородные соединения
состава Н2R: Н2О, Н2S, Н2Sе, Н2Те, Н2Ро ; высший оксид имеет состав RО3, ему соответствуют кислородосодержащие кислоты.
По сравнению с галогенами, халькогены более слабые окислители; встречаются в природе как в связанном, так и в свободном виде (О2, S).
Вгруппе сверху вниз закономерно увеличивается атомный радиус, ослабляются неметаллические окислительные и усиливаются металлические восстановительные свойства (О – активный неметалл, [Ро] – типичный металл). Наиболее
распространенными и важными являются кислород и сера .
Кислород – самый распространенный на Земле элемент: 47% - земная кора; 88,9 % - вода; 21 % -
воздух, в живых организмах (человек – 62 %). Элемент кислород образует два простых вещества:
7

О2 ─ кислород, и О3 ─ озон. Эти вещества являются
аллотропными модификациями.
О2 ↑─ газ без цвета и запаха, немного тяжелее воздуха, слабо растворим в воде, при t° < 183°С является жидкостью голубого цвета. Впервые был получен в 1770 году шведским химиком Шееле:
2 КNО3 → 2 КNО2+ О2↑
Сейчас кислород в лаборатории получают:
2Н2О2 → 2 Н2О + О2↑
2КСlО3 → 2КСl + 3О2↑
2КмnО4 → К2МnО4 + МnО2 + О2↑ В промышленности:
2Н2О → 2Н2↑ + О2↑ А также поэтапным испарением сжиженного воздуха.
О3↑ ─ озон, синеватый газ с острым запахом свежести. Более сильный окислитель, чем кислород. Образуется на высоте 25 км под действием радиации (озоновый экран) и вблизи высоковольтных источников тока:
3О2 → 2О3 Кислород окисляет большинство простых и сложных веществ, при этом в большинстве случаев
выделяется большая энергия: О2 + 2Nа → Nа2О2
О2 + 2Zn → 2ZnО
5О2 + 4Р → 2Р2О5
3О2 + 2Н2S → 2SО2↑ + 2Н2О 2О2 + СН4 → СО2↑ + 2Н2О О2 + 2F2 → 2ОF2
О2 + N2 → 2NO – Q кДж
Как сильный окислитель О2 имеет большое значение: горение топлива, коррозия металлов, гниение органических остатков, дыхание - везде участвует кислород. Поэтому его глобальный расход очень велик.
Лишь благодаря фотосинтезу, осуществляемому зелеными растениями, содержание О2 в атмосфере остается пока неизменным:
6СО2 + 6Н2О ↔ С6Н12О6 + 6О2↑ Фотосинтез поставляет в атмосферу О2, а в процессах дыхания, горения и гниения образуется
СО2.
ХИМИЧЕСКИЕ СВЯЗИ В ОРГАНИЧЕСКИХ ВЕЩЕСТВАХ
Подавляющая часть химических связей в органических соединениях – ковалентные. Упрощенно говоря – это связи, образованные общими парами электронов. Квантовая механика дает такое объяснение ковалентной связи.
На внешних энергетических уровнях атомов имеются
неспаренные электроны, которые могут образовывать ковалентные связи.
Области пространства, в которых наиболее вероятно нахождение электронов, называются электронными облаками или орбиталями ( s-, р-, d -, f – орбитали ). Чаще всего валентными являются s (шарообразные) и p
8
(гантелеобразные) орбитали.
Образование ковалентной связи происходит при взаимном перекрывании электронных облаков двух атомов, там, где эти облака накладываются друг на друга, возникает область повышенной электронной плотности, она и связывает электростатически ядра атомов. Основу органических молекул составляют атомы углерода. Для них характерны 3 валентных состояния:
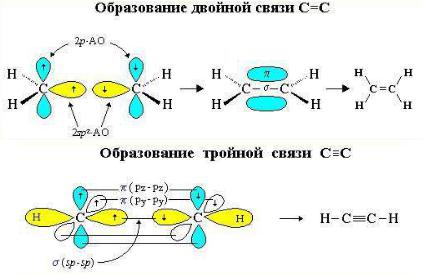
Sp3 - гибридизация (гибридизация-выравнивание формы облаков) – образуются 4 гибридных облака, которые, отталкиваясь друг от друга на максимальный угол 109º 28', образуют в пространстве тетраэдр. В этом состоянии углерод образует молекулы предельных углеводородов, т.е. алканов и циклоалканов. Образующиеся при этом химические связи называют σ(сигма)-связи. Sp2 - гибридизация. Такое валентнoе состояниe имеют атомы углерода при кратных связях в непредельных углеводородах алкенах, алкадиенах с сопряжёнными и изолированными двойными связями и в ароматическом кольце. Образуются 3 гибридных электронных облака и остаётся 1 негибридизованное р-облако. В таком состоянии углерод образует три σ-связи и одну π(пи)-связь.
Sp - гибридизация. Это валентное состояние у атомов углерода при тройной связи в молекулах алкинов. Образуются 2 гибридных облака и остаются негибридизованными 2 р-облака. В этом валентном состоянии атом углерода образует две σ-связи и две π-связи.
s - связи более прочные, чем π – связи и в химических реакциях разрушаются в первую очередь π – связи. Но при этом надо помнить , что суммарная прочность связи возрастает от одинарной к двойной и далее к тройной.
В процессе химических реакций старые связи разрушаются, и образовавшиеся фрагменты
молекул соединяются по-новому: возникают новые химические связи и новые вещества. Ход химических реакций напрямую зависит от того, каким способом разрушились исходные молекулы, и какие частицы при этом получились. Существует два способа разрыва химических связей: гомолитический и гетеролитический.
1)гомолитический («гомейос» - одинаковый, подобный; «лизис» - разрушение) разрыв связи: в результате такого разрыва образуются атомы или радикалы ─ очень агрессивные частицы.
Реакции с их участием носят цепной характер, т.е. однажды начавшись, реакция идёт до конца, пока не израсходуется хотя бы один реагент. Часто они протекают очень быстро, с взрывной скоростью, например, взаимодействие метана и хлора. Эти реакции называются свободнорадикальными:
Cl •• Cl hν→ Cl • + • Cl
Cl • + CH4 → HCl + • CH3 Cl • + • CH3 → CH3Cl
Cl • + CH3Cl → HCl + • CH2Cl … и так далее
2)гетеролитический («гетерос» - неравный, неодинаковый) разрыв связи:
при таком способе разрыва связей образуются органические ионы, обычно
9
реакции с их участием протекают спокойно и называются ионными нуклеофильными и электрофильными.
МОЛЬ, МОЛЯРНАЯ МАССА. ЗАКОН АВОГАДРО
Наряду с широко известными характеристиками вещества – массой и объёмом в химии используется и такая специфическая величина как количество вещества – n (другое применяемое обозначение-n). Имеется в виду «вещество» в широком понимании, т.е. материя.
Единицей измерения количества вещества служит м о л ь. 1 моль любого вещества содержит 6,02 ´ 1023 структурных единиц данного вещества (атомов, молекул, ионов …). Эта величина носит название постоянной Авогадро и обозначается Na :
o 1 моль Na содержит 6,02 ´ 1023 атомов натрия; o 1 моль Na+ содержит 6,02 ´ 1023 ионов натрия;
o 1 моль NaCl содержит по 6,02 ´ 1023 ионов как натрия, так и хлора; o 1 моль Cl2 содержит 6,02 ´ 1023 молекул хлора.
1 моль – это такое количество вещества, в котором содержится столько же структурных
единиц, что и в 12 г изотопа 12С.
Масса 1 моль вещества, выраженная в граммах, называется молярной массой и обозначается М(г/моль). Численное значение молярной массы легко определить, для этого используют Периодическую систему. М численно равна:
−у веществ с атомным строением – Ar;
−у веществ с молекулярным строением – Mr.
Можно записать, что {Ar} = M (г/моль) и {Mr} = M (г/моль), где г/моль — обычная в химии единица измерения молярных масс:
М(Сu) = 64 г/моль; М(H2O) = 18 г/моль; М(C6H12O6) = 180 г/моль.
Изучение свойств газов позволило итальянскому учёному Амедео Авогадро в 1811 году выдвинуть гипотезу, которая впоследствии была подтверждена опытными данными и стала называться
законом Авогадро:
«В равных объёмах разных газов при одинаковых условиях (температуре и давлении) содержится
одинаковое число молекул».
Поскольку 1 моль любого вещества, в том числе и газа, содержит одинаковое число частиц, следовательно, при одинаковых условиях 1 моль любого газа занимает одинаковый объём. При нормальных условиях (н.у.), то есть температуре 273 К (0о С) и давлении 101,325 кПа (760 мм рт. ст.), этот объём легко рассчитать.
Vm(O2) = 32г/моль : 1,43г/л = 22,4 л/моль.
Тот же результат получаем и для других газов: Vm(H2) = 2г/моль : 0,09г/л = 22,4 л/моль;
Vm(N2) = 28г/моль : 1,25 г/л = 22,4 л/моль.
Итак, при н.у. молярный объём газов составляет:
Vm = 22,4 л/моль
Если вещество газообразное, то его молярная масса может быть определена с помощью закона Авогадро. Следствие из закона гласит:
массы двух газов, взятых в одинаковых объёмах, относятся как их молярные массы
m1 / m2 = M1 / M2
Другое следствие из закона может быть применено для определения объёма газа: объёмы участвующих в реакции газов относятся друг к другу как небольшие целые числа(численно равные стехиометрическим коэффициентам)
V1 / V2 = n1 / n2
Отношение массы одного газа к массе другого газа (при одинаковом объёме) называется относительной плотностью первого газа по второму. Измерения газов обычно производят при условиях, отличных от стандартных. В этом случае для приведения газа к н.у. можно воспользоваться объединённым газовым законом Бойля – Мариотта и Гей – Люссака:
PV / T = P0V0 / T0 => V = P0V0T / PT0
Где
10
