
- •Билет №3
- •Билет №4
- •Билет №5
- •Билет №6
- •Билет №7
- •Билет №8
- •Тимоловая проба
- •Билет №11
- •Высаливание белков
- •Исследование денатурации белков
- •Билет №12
- •Билет №13
- •Биуретовая реакция
- •Ксантопротеиновая реакция
- •Реакция Миллона
- •Билет №14
- •Тимоловая проба
- •Билет №15
- •Влияние активаторов и ингибиторов на активность амилазы
- •Билет №16
- •Билет №17
- •Билет №18
Тимоловая проба
Принцип Сывороточные р-, у-глобулины и липопротеины осаждаются при рН 7,55 тимоловым реактивом вследствие образования глобулин-тимол-липидного комплекса.
Реактивы Тимоловый буфер, рН 7,55-7,6.
Практическое значение Как и все коагуляционные тесты, тимоловая проба является неспецифической реакцией. Вместе с тем, она гораздо более специфична для функционального исследования печени, чем другие коллоидные пробы. В 90-100% случаев тимоловая проба положительна при болезни Боткина (уже в преджелтушной стадии или при безжелтушной форме) и при токсическом гепатите. При механической желтухе тимоловая проба отрицательна.
Оформление работы Отмечают принцип методов, регистрируют результаты анализа и делают вывод.
Билет №15
1)
По строению бокового радикала – неполярные (алифатические, аромати-
ческие) и полярные (незаряженные, отрицательно и положительно заряжен-
ные);
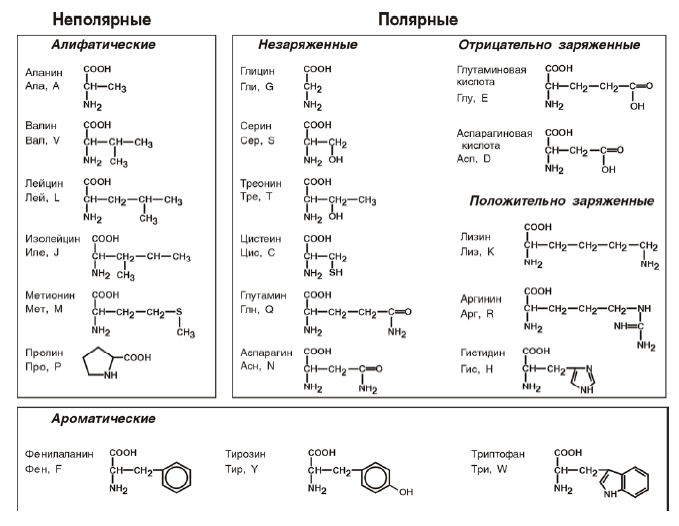
По необходимости для организма (физиологическая классификация) – не-
заменимые (Лей, Иле, Вал, Фен, Три, Тре, Лиз, Мет) и заменимые. Две ами-
нокислоты являются условно незаменимыми (Арг. Гис)
2)
Давно выяснено, что все ферменты являются белками и обладают всеми свой-
ствами белков. Подобно белкам они делятся на простые исложные.
Простые состоят только из аминокислот – пепсин, трипсин, лизоцим.
Сложные ферменты имеют в своем составе белковую часть, состоящую из ами-
нокислот – апофермент, и небелковую часть –кофактор. Кофактор может назы-
ваться коферментом, если он легко отделяется от апобелка, илипростетической
группой, если он связан с белком прочно.
N.B. Для осуществления катализа
необходим комплекс апобелка и ко-
фактора, по отдельности они катализ
осуществить не могут.
В составе апофермента выделяют
несколько участков, выполняющих раз-
личную функцию.
1. Активный центр – комбинация
аминокислотных остатков, обеспечи-
вающая непосредственное связывание
с молекулой субстрата и осуществ-
ляющая катализ. Аминокислотные ра-
3
дикалы в активном центре могут находиться в любом сочетании. При разворачива-
нии пептидной цепи аминокислоты активного центра могут значительно удаляться
друг от друга.
У сложных ферментов в активном центре обязательно расположены функцио-
нальные группы кофактора.
В свою очередь в активном центре выделяют два участка:
• Якорный (или контактный, или связывающий) – отвечает за связывание и
ориентацию субстрата в активном центре
• Каталитический – отвечает непосредственно за осуществление реакции.
2. Аллостерический центр (allos - чужой) – регуляторный центр, пространствен-
но отделен от активного, имеется не у всех ферментов и осуществляет регуляцию
активности фермента. Связывание с ним какой-либо молекулы, называемой эффек-
тором, модулятором, регулятором, активатором или ингибитором, вызывает измене-
ние конфигурации белка и, как следствие, скорости ферментативной реакции. В ка-
честве такого регулятора чаще всего выступает продукт данной реакции или одной
из последующих реакции.
3)
Влияние активаторов и ингибиторов на активность амилазы
Принцип Метод основан на сравнении скорости гидролиза крахмала под действием амилазы слюны до и после добавления ионов Ch и Си2*. Действие фермента на субстрат выявляется при помощи реакции с йодом.
Реактивы 1)1% раствор CuS04,
раствор Люголя,
0,9% раствор NaCI.
Материал исследования Слюна, разведенная 1:10 (источника-амилазы). Проведение реакции
Приготовление разведенной слюны 1:10: собирают 1 мл слюны в центрифужную пробирку и доводят дистиллированной водой до метки 10 мл, хорошо перемешивают.
Берут три пробирки. В первую добавляют 10 капель дистиллированной воды, во вторую - 10 капель раствора NaCI, в третью - 10 капель раствора CuS04.
Добавляют в каждую пробирку по 10 капель разбавленной слюны, перемешивают.
Добавляют по 10 капель раствора крахмала.
Ставят в водяную баню (37 °С) на 5 минут.
Готовят три пробирки с водой по 1 мл в каждой, добавляют 1-2 капли реактива Люголя и прибавляют по 5 капель содержимого опытных пробирок. Сравнивают окраску в пробирках. Если су-г щественной разницы в окраске нет, то инкубацию опытных проб увеличивают до 10-15 минут.
