
- •Оглавление
- •ВВЕДЕНИЕ
- •РАЗДЕЛ II. МАТЕРИАЛОВЕДЕНИЕ СТАЛЕЙ И ЧУГУНОВ
- •РАЗДЕЛ III. МАТЕРИАЛОВЕДЕНИЕ ЦВЕТНЫХ МЕТАЛЛОВ И СПЛАВОВ
- •8.3. Композиционные материалы
- •8.4. Металлические стекла
- •9.1. Природные каменные материалы
- •9.2. Минеральные неорганические вяжущие вещества
- •9.4. Каменные плавленые материалы
- •11.1. Полупроводниковые материалы
- •БИБЛИОГРАФИЧЕСКИЙ СПИСОК

Электронный |
учебно-методический комплекс |
МАТЕРИАЛОВЕДЕНИЕ
Учебная программа дисциплины «Металлургия» Учебная программа дисциплины «Горное дело» Учебная программа дисциплины «Машиностроение» Учебное пособие Лабораторный практикум «Материаловедение»
Лабораторный практикум «Структура железоуглеродистых и цветных сплавов» Методические указания по практическим занятиям
Методические указания по самостоятельной работе Банк тестовых заданий в системе UniTest
Красноярск ИПК СФУ
2008
УДК 620.22 ББК 30.3
М34
Авторы:
В. С. Биронт, Т. А. Орелкина, Т. Н. Дроздова, Л. А. Быконя, Л. С. Цурган
Электронный учебно-методический комплекс по дисциплине «Материаловедение» подготовлен в рамках инновационной образовательной программы «Материаловедческое образование при подготовке бакалавров, инженеров и магистров по укрупненной группе образовательных направлений и специальностей «Материаловедение, металлургия и машиностроение» в СФУ», реализованной в ФГОУ ВПО СФУ в 2007 г.
Рецензенты:
Красноярский краевой фонд науки; Экспертная комиссия СФУ по подготовке учебно-методических комплексов дисциплин
М34 |
Материаловедение. Версия 1.0 [Электронный ресурс] : электрон. учеб. по- |
|||
|
собие / |
В. С. Биронт, Т. А. Орелкина, Т. Н. Дроздова и др. – Электрон. дан. |
||
|
(9 Мб). – Красноярск : ИПК СФУ, 2008. – (Материаловедение : УМКД № 12- |
|||
|
2007 / рук. творч. коллектива |
Л. С. Цурган, Л. А. Быконя, Т. А. Орелкина). – |
||
|
1 электрон. опт. диск (DVD). – Систем. требования : Intel Pentium (или анало- |
|||
|
гичный процессор других производителей) 1 ГГц ; 512 Мб оперативной памя- |
|||
|
ти ; 9 Мб свободного дискового пространства ; привод DVD ; операционная |
|||
|
система |
Microsoft Windows |
2000 SP 4 / |
XP SP 2 / Vista (32 бит) ; Adobe |
|
Reader 7.0 (или аналогичный продукт для чтения файлов формата pdf). |
|||
|
ISBN 978-5-7638-1039-4 (комплекса) |
|
||
|
ISBN 978-5-7638-1532-0 (пособия) |
|
||
|
Номер гос. регистрации |
в ФГУП |
НТЦ «Информрегистр» 0320802377 |
|
от 24.11.2008 г. (комплекса)
Настоящее издание является частью электронного учебно-методического комплекса по дисциплине «Материаловедение», включающего учебные программы по направлениям «Металлургия», «Машиностроение», «Горное дело» и «Технология геологической разведки», практикум «Материаловедение. Металлические материалы», лабораторные практикумы «Структура железоуглеродистых и цветных сплавов» и «Материаловедение», методические указания по практическим занятиям «Механические свойства сплавов и фазовые превращения», методические указания по самостоятельной работе, контрольно-измерительные материалы «Материаловедение. Банк тестовых заданий», наглядное пособие «Материаловедение. Презентационные материалы».
Изложены основные положения о строении, свойствах материалов и методах их исследования. Представлены сведения о конструкционных и инструментальных материалах, наиболее широко используемых в промышленности. Изложена классификация и основные сведения о цветных металлах и сплавах, композиционных и неметаллических материалах. Рассмотрены фазовые превращения в сталях, чугунах, цветных сплавах.
Предназначено для студентов направления подготовки бакалавров 150100.62 «Металлургия», 150300.62 «Машиностроение» укрупненной группы 150000 «Материаловедение, металлургия и машиностроение», 130300.62 «Горное дело», 130200.62 «Технология геологической разведки» укрупненной группы 130000 «Геология, разведка и разработка месторождений полезных ископаемых».
© Сибирский федеральный университет, 2008
Рекомендовано Инновационно-методическим управлением СФУ в качестве учебного пособия
Редакторы: Л. Г. Семухина, И. Н. Байкина
Разработка и оформление электронного образовательного ресурса: Центр технологий электронного обучения информационно-аналитического департамента СФУ; лаборатория по разработке мультимедийных электронных образовательных ресурсов при КрЦНИТ
Содержимое ресурса охраняется законом об авторском праве. Несанкционированное копирование и использование данного продукта запрещается. Встречающиеся названия программного обеспечения, изделий, устройств или систем могут являться зарегистрированными товарными знаками тех или иных фирм.
Подп. к использованию 01.09.2008 Объем 9 Мб
Красноярск: СФУ, 660041, Красноярск, пр. Свободный, 79

Оглавление |
|
Введение.................................................................... |
6 |
Раздел I. Основы физического металловедения 11 |
|
Глава 1. Строение, свойства и методы исследования металлов и сплавов.. |
11 |
1.1. Типы химической связи...................................................................................... |
11 |
1.2. Характеристика металлического состояния..................................................... |
13 |
1.3. Характеристика полимерных и композиционных материалов ....................... |
25 |
1.4. Методы исследования в материаловедении................................................... |
29 |
1.5. Физические, химические и эксплуатационные свойства материалов........... |
35 |
1.6. Механические свойства материалов................................................................ |
42 |
Контрольные вопросы и задания............................................................................. |
51 |
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом |
|
состоянии...................................................................................................................... |
52 |
2.1. Фазовые превращения I и II рода...................................................................... |
52 |
2.2. Плавление чистых металлов............................................................................. |
53 |
2.3. Термодинамические основы процесса кристаллизации................................. |
54 |
2.4. Гомогенная и гетерогенная кристаллизация, зарождение кристаллов......... |
57 |
2.5. Механизмы и формы роста кристаллов........................................................... |
60 |
2.6. Размер зерна литого металла. Строение металлического слитка................. |
65 |
2.7. Фазовые превращения в твердом состоянии................................................... |
67 |
2.8.Изменение структуры и свойств металлов при пластической деформации 72
2.9.Структура и свойства металлов при нагреве после пластической
деформации............................................................................................................... |
78 |
Контрольные вопросы и задания............................................................................. |
84 |
Глава 3. Фазовые равновесия в двойных и тройных системах........................ |
86 |
3.1. Основные термины и понятия........................................................................... |
86 |
3.2. Фазы в металлических системах и системах металлов и неметаллов......... |
87 |
3.3. Понятия о диаграммах фазового равновесия.................................................. |
91 |
3.4. Диаграмма состояния с неограниченной растворимостью в жидком и |
|
твердом состояниях................................................................................................... |
94 |
3.5. Диаграммы состояния эвтектического типа..................................................... |
98 |
3.6. Диаграммы состояния систем перитектического типа.................................. |
113 |
3.7. Диаграммы состояния систем с промежуточными фазами.......................... |
118 |
3.8. Диаграммы фазового равновесия с расслоением жидких растворов ....... |
128 |
3.9. Диаграммы состояния систем на основе полиморфных компонентов....... |
132 |
3.10. Диаграммы фазового равновесия в трехкомпонентных системах............ |
137 |
3.11. Зависимость свойств сплавов от их состава ............................................... |
148 |
3.12. Неравновесная кристаллизация сплавов..................................................... |
151 |
Контрольные вопросы и задания........................................................................... |
156 |
Материаловедение. Учеб. пособие |
-3- |

ОГЛАВЛЕНИЕ |
|
Раздел II. Материаловедение сталей |
|
и чугунов................................................................ |
159 |
Глава 4. Стали, сплавы системы железо–углерод. Маркировка, структура, |
|
свойства сплавов....................................................................................................... |
159 |
4.1. Строение и свойства чистого железа ............................................................. |
159 |
4.2. Диаграмма состояния железо–углерод.......................................................... |
160 |
4.3. Фазы, структурные составляющие, их строение и свойства........................ |
168 |
4.4. Фазовые и структурные превращения в диаграмме железо−углерод........ |
175 |
4.5. Условия превращения в железоуглеродистых сплавах................................ |
177 |
4.6. Классификация сталей..................................................................................... |
185 |
4.7. Влияние углерода, легирующих элементов, примесей на свойства сталей188 |
|
4.8. Термическая и химико-термическая обработка сплавов.............................. |
189 |
4.9. Конструкционные стали и сплавы................................................................... |
229 |
4.10. Инструментальные материалы..................................................................... |
271 |
Контрольные вопросы и задания........................................................................... |
282 |
Глава 5. Чугуны, сплавы системы железо–углерод........................................... |
284 |
5.1. Фазовые и структурные превращения в белых чугунах................................ |
284 |
5.2. Эвтектическая кристаллизация....................................................................... |
287 |
5.3. Серые чугуны.................................................................................................... |
292 |
5.4. Высокопрочные, с вермикулярным графитом и ковкие чугуны.................... |
295 |
5.5. Чугуны специального назначения................................................................... |
299 |
Контрольные вопросы и заданиия......................................................................... |
300 |
Раздел III. Материаловедение цветных |
|
металлов и сплавов.............................................. |
302 |
Глава 6. Тяжелые цветные металлы и сплавы................................................... |
302 |
6.1. Структура и свойства меди.............................................................................. |
302 |
6.2. Латуни двойные и специальные...................................................................... |
306 |
6.3. Оловянные бронзы........................................................................................... |
315 |
6.4. Бронзы безоловянные...................................................................................... |
319 |
6.5. Сплавы медно-никелевые............................................................................... |
326 |
6.6. Никелевые сплавы........................................................................................... |
327 |
Контрольные вопросы и задания........................................................................... |
333 |
Глава 7. Легкие цветные металлы и сплавы ....................................................... |
334 |
7.1. Структура и свойства алюминия..................................................................... |
334 |
7.2. Литейные алюминиевые сплавы системы алюминий–кремний................... |
341 |
7.3. Литейные алюминиевые сплавы систем алюминий–медь, |
|
алюминий–магний.................................................................................................... |
347 |
7.4. Деформируемые термически неупрочняемые алюминиевые сплавы........ |
353 |
7.5. Деформируемые термически упрочняемые алюминиевые сплавы............ |
356 |
7.6. Магний и его сплавы......................................................................................... |
370 |
7.7. Титан и его сплавы........................................................................................... |
376 |
Контрольные вопросы и задания........................................................................... |
389 |
Глава 8. Антифрикционные, порошковые и композиционные сплавы......... |
390 |
Материаловедение. Учеб. пособие |
-4- |

ОГЛАВЛЕНИЕ |
|
8.1. Антифрикционные сплавы на основе олова, свинца и цинка....................... |
390 |
8.2. Порошковые материалы.................................................................................. |
395 |
8.3. Композиционные материалы........................................................................... |
398 |
8.4. Металлические стекла..................................................................................... |
402 |
Контрольные вопросы и задания........................................................................... |
403 |
Раздел IV. Материаловедение неметаллических |
|
материалов............................................................ |
404 |
Глава 9. Минеральные разрыхленные, дисперсные и каменные |
|
материалы................................................................................................................... |
404 |
9.1. Природные каменные материалы................................................................... |
404 |
9.2. Минеральные неорганические вяжущие вещества....................................... |
408 |
9.3. Искусственные каменные материалы. Бетоны.............................................. |
412 |
9.4. Каменные плавленые материалы................................................................... |
421 |
Контрольные вопросы и задания........................................................................... |
422 |
Глава 10. Полимерные материалы......................................................................... |
424 |
10.1. Неорганические полимерные материалы.................................................... |
424 |
10.2. Полимерные пластические материалы........................................................ |
432 |
Контрольные вопросы и задания........................................................................... |
438 |
Глава 11. Другие органические и полупроводниковые материалы................ |
439 |
11.1. Полупроводниковые материалы................................................................... |
439 |
11.2. Органические материалы из леса................................................................. |
440 |
11.3. Материалы из бумаги.................................................................................... |
445 |
11.4. Резиновые материалы................................................................................... |
448 |
Контрольные вопросы и задания........................................................................... |
451 |
Библиографический список................................ |
452 |
Материаловедение. Учеб. пособие |
-5- |

ВВЕДЕНИЕ
Начало науки о металлах в России было положено великим русским ученым М.В. Ломоносовым в его труде «Первые основания металлургии или рудных дел».
Однако по праву начало металловедения как науки связано с именем великого русского металлурга Павла Петровича Аносова.
Имя П.П. Аносова связано с открытием секрета изготовления булатных клинков, обладавших замечательными свойствами чрезвычайной остротой лезвия и большой гибкости и упругости клинка. П.П. Аносовым был выполнен большой объем работ в области создания технологии изготовления высококачественной литой стали, а также работы по изучению влияния легирующих элементов в стали на ее свойства: марганца, хрома, титана, платины, золота и других; по влиянию формы вводимого в сталь углерода: от лепестков роз до алмаза. П.П. Аносов, изучая рисунки на булатах, пришел к выводу о том, что они являются проявлением внутренней структуры металла. Им впервые показано, что свойства стали зависят от ее макроструктуры и микроструктуры. П.П. Аносов впервые в 1831 г. применил микроскоп для исследования микроструктуры стали, положив этим начало науки о металлах – металловедения.
Работы Аносова по изучению структуры литой стали были продолжены Александром Степановичем Лавровым и Николаем Вениаминовичем Калакуцким, которые исследовали структуру стальных слитков, производили химические анализы в разных его частях, изучили образование пустот, пузырей, усадочных раковин в слитках.
Новым этапом развития науки о металлах – металловедения явились открытия великого русского ученого Дмитрия Константиновича Чернова. В 1868 г. Д.К. Черновым были открыты критические точки стали а, b и с, которые определили научную основу технологии термической обработки.
Громадное научное и практическое значение работы Д.К. Чернова заключается в том, что в ней было теоретически обосновано и экспериментально доказано, что решающее влияние на формирование структуры и свойств стали оказывает термическая обработка, а не ковка, как это считалось раньше.
Открытие критических точек стали Д.К. Черновым и периодического закона Д.И. Менделеевым в 1869 г. явились основой современного металловедения. Периодический закон Д.И. Менделеева позволяет установить связь между строением атомов, кристаллической структурой и свойствами металлических сплавов. Этот закон позволяет предвидеть и объяснить влияние элементов на структуру и свойства металлических сплавов, способность их к образованию твердых растворов, химических соединений и т.д.
Следующей работой Д.К. Чернова (1878), внесшей большой вклад в теорию металловедения, является работа по изучению процессов кристаллизации стального слитка. Этой работой Д.К. Чернова был установлен приори-
Материаловедение. Учеб. пособие |
-6- |

ВВЕДЕНИЕ
тет русской науки по таким вопросам теории кристаллизации, как учение о центрах кристаллизации и законы роста кристаллов в больших объемах стали. Д.К. Черновым был исследован знаменитый «кристалл Чернова» длиной 39 см и весом 3,45 кг, являющийся классической иллюстрацией явления кристаллизации.
В1884 г. Д.К. Чернов первым обнаружил и описал линии скольжения на поверхности деформированной стали, называемые в настоящее время линиями Чернова-Людерса, заложив научные основы обработки металлов давлением.
В1885 г., основываясь на работах П.П. Аносова по закалке в горячем сале, Д.К. Чернов осуществил закалку в расплавленном сплаве свинца с оло-
вом при температуре 200 °С, что послужило началом применения ступенчатой закалки стали, а в дальнейшем – исследованию изотермического превращения аустенита. В 1875 г. Д.К. Чернов исследовал микроструктуру рельсовой стали и высказал свои представления по влиянию микроструктуры рельсов на их стойкость.
Большое значение имеют работы Д.К. Чернова по изучению разгаростойкости орудийных стволов и технологии термической обработки бронебойных снарядов.
Одним из основных разделов металловедения является учение о внутренних напряжениях. Большой вклад в этот раздел металловедения был внесен замечательным русским металловедом Николаем Вениаминовичем Калакуцким. В 1887 г. в Петербурге вышел его знаменитый труд «Исследование внутренних напряжений в чугуне и стали». Н.В. Калакуцкий в своем труде утверждал, что производство многих изделий было бы гораздо совершеннее, если бы учитывались внутренние напряжения. Им предложен метод определения внутренних напряжений в чугунных или стальных изделиях. Н.В. Калакуцкий впервые указал, что создание в деталях благоприятного распределения напряжений (сжимающие на поверхности изделий), значительно повышает их прочность и долговечность. Этот вывод Калакуцкого широко применяется в настоящее время. Иллюстрацией этого может быть применение упрочнения наклепом дробью, накаткой роликами, холодной поверхностной пластической деформацией, закалки токами высокой частоты, создающей на поверхности изделий сжимающие напряжения.
Дальнейшее развитие науки о металлах характеризуется резким скачком, значительным прогрессом металловедения одновременно по многим направлениям. Николай Семенович Курнаков создал школу металловедов, разработавших основы физико-химического анализа. Под его руководством были сформированы крупные, хорошо оборудованные лаборатории. Им разработан дифференциальный пирометр (пирометр Курнакова).
Н.С. Курнаковым и его учениками были разработаны новые представления о природе твердых растворов и химических соединений, исследованы и разработаны сотни диаграмм состояния металлических сплавов, составляющих сокровищницу мировой науки. Выдающимся исследователем, работавшим над наиболее важными проблемами металловедения, был Александр
Материаловедение. Учеб. пособие |
-7- |

ВВЕДЕНИЕ
Александрович Байков. Он впервые обнаружил кристаллическое строение аустенита путем травления хлором микрошлифов при высокой температуре. В 1900 г. при исследовании сплавов меди с сурьмой А.А. Байков показал, что процесс закалки применим не только к сталям, но и к сплавам цветных металлов.
В 1906 г. немецкий инженер А. Вильм на изобретенном им дуралюмине открыл старение – процесс, который стал основным процессом, приводящим к упрочнению многих цветных сплавов. Старение сплавов, обнаруженное Вильмом, исследовалось П. Мерика, С.Т. Конобеевским, Ю.А. Багаряцким, М.И. Захаровой, Гинье, Престоном и др. Теория распада пересыщенных твердых растворов разработана С.Т. Конобеевским.
Развитие металловедения как науки связано с именем Николая Анатольевича Минкевича. Им решались проблемы по созданию научных основ термической обработки специальных сталей и сплавов высокого качества для авиационной, автомобильной и других отраслей промышленности. В результате работ Н.А. Минкевича были внедрены в производство многие марки конструкционных и инструментальных сталей. Им проведены работы в области теории и технологии газовой цементации стали.
Большой вклад в развитие металловедения и теории термической обработки стали был внесен уральской школой металловедов под руководством Сергея Самойловича Штейнберга.
Этой школой разработаны теории изотермической закалки и изотермического отжига стали, разработан и обоснован способ многократного отпуска быстрорежущей стали, а также выявлено влияние различных легирующих элементов и величины зерна на свойства и структуру стали после термической обработки.
Теория мартенситного превращения в стали и других сплавах изучалась и в современном виде разработана Г.В. Курдюмовым.
Большой объем работ по металловедению цветных металлов и сплавов наряду с изучением сталей был проведен школой А.М. Бочвара и А.А. Бочвара. Этой школой широко изучены многие сплавы цветных металлов, исследован процесс эвтектической кристаллизации, разработаны многие подшипниковые сплавы, усовершенствованы способы изготовления изделий из этих сплавов, разработаны методы борьбы с коррозией.
Изучение медных сплавов проведено школой ленинградских металловедов М.П. Славинского.
Новые методы комбинированной обработки, появившиеся в последнее время, потребовали новых металловедческих исследований. Исследования структуры сталей и сплавов цветных металлов при их термомеханической обработке, механико-термической, термомагнитной обработке проведены М.Л. Бернштейном. Влияние ультразвуковых колебаний на превращения в металлах и сплавах исследовано В.С. Ермаковым, Э.А. Альфтаном, К.М. Пого- диной-Алексеевой, Г.И. Погодиным-Алексеевым, А.В. Кулеминым, В.С. Биронтом и др.
Материаловедение. Учеб. пособие |
-8- |

ВВЕДЕНИЕ
Развитие науки в области неметаллических керамических и композиционных материалов основывается на самостоятельных научных направлениях, которые имеют свою богатую историю.
Материаловедение (в том числе и металловедение) в последнее время из чисто технологической дисциплины, изучавшей отдельные классы материалов и способы их получения и обработки, преобразуется в стройную науку, включающую теоретические основы, единые для широкого круга классов материалов, и имеющую упорядоченную классификационную систему с разветвленной сетью сведений о материалах, их составах и свойствах, которые регламентируются государственными стандартами.
Государственными образовательными стандартами высшего и среднего профессионального образования металлургического, машиностроительного, и горного направлений предусматривается изучение общепрофессиональной дисциплины «Материаловедение», целью которой является подготовка специалистов, способных при разработке новых конструкций, машин и механизмов, при решении множественных технологических проблем их изготовления, при анализе поведения изделий в разнообразных условиях эксплуатации принимать правильные решения, основанные на знаниях о строении металлических и неметаллических материалов, их структуре и свойствах. Специалисты в любой отрасли знаний должны уметь правильно оценивать возможности тех или иных материалов сопротивляться внешним механическим воздействиям, без разрушения работать в агрессивных коррозионных средах, выдерживать температурные циклы, длительно работать в условиях износа и усталости при многократно повторяющихся нагрузках.
В первом разделе пособия («Основы физического металловедения») излагаются сведения о физико-химических основах материалов, их строении, методах изучения структуры и свойств материалов, фундаментальные основы фазовых взаимодействий в двойных и более сложных системах.
Второй и третий разделы, опирающиеся на фундаментальные знания физического металловедения и системы государственных стандартов на различные классы материалов, описывают конструкционные материалы. При этом понятие конструкционных материалов следует трактовать широко, к ним можно относить и собственно конструкционные машиностроительные, инструментальные, а также металлические строительные материалы, порошковые и композиционные материалы для конструкций и др.
Во втором разделе учебного пособия («Материаловедение сталей и чугунов») рассматриваются сведения о таких конструкционных материалах, как стали и чугуны, в том числе, влияние легирующих элементов на фазовые равновесия в системах, на структуру, свойства сталей и виды их термической обработки. В разделе представлены строительные, машиностроительные, в том числе, автоматные, конструкционные стали общего назначения, высокопрочные, пружинно-рессорные, шарикоподшипниковые стали и др. Даны сведения об инструментальных сталях, включая стали для мерительных, режущих и штамповых инструментов. Охарактеризованы стали со специальными химическими и физическими свойствами, в т.ч. нержавеющие, жаро-
Материаловедение. Учеб. пособие |
-9- |

ВВЕДЕНИЕ
стойкие, жаропрочные, магнитные сплавы, а также сплавы с высоким удельным электросопротивлением. В пособии подробно рассматривается наиболее распространенная и одна из наиболее важных систем для металлургической и машиностроительной отрасли диаграмма железо–углерод. Приведены действующие системы классификации сталей.
Втретьем разделе («Материаловедение цветных металлов и сплавов») представлены данные по цветным металлам и сплавам, порошковым и композиционным материалам. Рассмотрены цветные металлы и сплавы на основе титана, алюминия, магния, меди, никеля, цинка, олова и свинца.
Четвертый раздел содержит сведения о неметаллических материалах.
Внаписании пособия принимали участие: В. С. Биронт (глава 1, п. 1.2, 1.4–1.6; гл. 2, п. 2.1–2.7; глава 3 п. 3.1–3.9, 3.11, 3.12; глава 4, п. 4.1–4.5; гл. 5; гл. 6, п. 6.6; гл. 8, п. 8.1, 8.2). Т. А. Орелкина (гл. 1, п. 1.1, 1.4–1.6; гл. 3, п. 3.4–3.9, 3.12; гл. 4, п. 4.6, 4.7; гл. 5, п. 5.3–5.5; гл. 6; гл. 7). Л. А. Быконя (гл. 2, п. 2.8, 2.9; гл. 4, п. 4.8–4.10). Л. С. Цурган (гл. 1, п. 1.3; гл. 3, п. 3.10; гл. 8, п. 8.3–8.5; гл. 9). Т. Н. Дроздова (гл. 1, п. 1.5; гл. 3, п. 3.4–3.9; гл. 6; гл. 7). В. Ю. Гурская (гл. 3, п. 3.4–3.10, 3.12). В. И. Аникина (гл. 3, п. 3.4–3.10).
Материаловедение. Учеб. пособие |
-10- |
РАЗДЕЛ I.
ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава1. Строение, свойстваиметоды исследованияметалловисплавов
1.1. Типыхимическойсвязи
Атомы любого вещества состоят из положительно заряженного ядра и отрицательно заряженных электронов, распределяющихся по энергетическим уровням. В зависимости от взаимодействия молекул, атомов, ионов и электронов в атомной структуре материалов встречается несколько типов химической связи: ионная, ковалентная, молекулярная, металлическая.
Ионная связь обусловлена переходом электронов от одного атома к другому, в результате чего образуется электростатическое притяжение между положительными и отрицательными ионами. Данная связь характерна для солей и оксидов (NaCl, MgO, LiF), это направленная прочная связь, ограничивающая движение электронов. Ионным кристаллам свойственна малая электропроводность при низких температурах, электрический ток в ионных кристаллах обеспечивается направленным потоком ионов (ионная проводимость) (рис. 1.1, а).
а б в
Рис. 1.1. Основные типы связей: а – ионная (NaCl); б – ковалентная (алмаз); в – молекулярная (Ван-дер-Ваальсовая)
Ковалентная (гомеополярная) связь возникает в результате того, что электроны, находящиеся на внешнем энергетическом уровне примерно равномерно распределены между соседними атомами. Поэтому каждый атом связан с соседним атомом парой валентных электронов (рис. 1.1, б). Силы притяжения между атомами слабее, чем при ионной связи, однако ковалентная связь является сильно направленной, она определяет прочное взаимное расположение атомов. Ковалентные кристаллы характеризуются высокой температурой плавления, большой твердостью и малой электропроводностью, которая, как и у кристаллов с ионной связью, растет с повышением температуры. В ковалентных кристаллах, в отличие от ионных, электропро-
Материаловедение. Учеб. пособие |
-11- |
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
водность связана с направленным движением электронов. Ковалентную связь между атомами имеют Si, Ge, C (с решеткой алмаза).
Молекулярная связь характеризуется тем, что в узлах кристаллической решетки находятся устойчивые молекулы. Атомы внутри молекул сильно связаны, а между молекулами силы взаимодействия (силы Ван-дер-Ваальса) слабые и осуществляются за счет определенного смещения центров электрических зарядов в целом нейтральных молекул и их кулоновского притяжения (рис. 1.1, в). Молекулярные кристаллы имеют низкую температуру плавления и легко переходят из твердого состояния в газообразное. Такая связь наблюдается в твердом водороде, а также в отвердевших инертных газах.
Металлическая связь возникает, когда атомы в решетке максимально плотно упакованы (модель жестких шаров). В результате электрические поля атомных ядер перекрываются. Электроны, находящиеся на внешних энергетических уровнях атомов под воздействием этих полей теряют связь со своими атомами и становятся коллективными (свободными). В результате решетка металлического кристалла будет состоять из закономерно расположенных в пространстве положительных ионов и свободных электронов (рис. 1.2).
Рис. 1.2. Металлическая связь: 1 – атомное ядро; 2 – атомный остов; 3 – обобщенные электроны
Металлическая связь ненаправленная, электроны свободно перемещаются в решетке, обеспечивая высокую электро- и теплопроводность. У металлических кристаллов электропроводность падает с повышением температуры, т.е. они имеют отрицательный температурный коэффициент электропроводности. Неметаллы (металлоиды), в отличие от металлов, имеют положительный температурный коэффициент электропроводности, электропроводность растет при повышении температуры. К металлам относятся Na, Al, Fe, Mg, Cr, W, Ti, Ni и другие; к неметаллам – газы (H, N, O, F, Cl), твердые кристаллы (B, C, Si, P, S, As).
Некоторые кристаллы занимают промежуточное положение между идеальными типами. Например, некоторые фазы обладают металлической проводимостью, но имеют ковалентные связи. Так, при легировании железа кремнием помимо основной металлической связи возникает дополнительно ковалентная связь.
Материаловедение. Учеб. пособие |
-12- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
1.2. Характеристикаметаллическогосостояния
Трудно переоценить значение металлов. Машины и механизмы, посуда и железнодорожные мосты, украшения и строительные конструкции – все это металлы. По многим оценкам металл относят к фундаментам цивилизации. Обеспеченность металлом в значительной мере определяет уровень жизни людей, уровень развития науки и техники. Уникальный комплекс свойств металлических материалов – высокая прочность, пластичность, электропроводность, жаропрочность и др. обеспечивает широкое применение их в про- мышленно-экономическом комплексе, во всех отраслях науки и техники. По данным ООН, все другие вместе взятые неорганические материалы пока смогли заменить лишь 6 % металла.
Сейчас ежегодно добываются и используются в деятельности человека в мире многие миллионы тонн различных металлов: Fe около 300 млн т; Cu около 4 млн т; Al около 5 млн т; Zn, Pb около 2 млн т; Mg более 100 тыс.
т; Ni, Sn около 200 тыс. т; Ti около 20 тыс. т; Mg, Bi, Cd, Co, Ag от 1 000 до 10 000 т; Au около 1 000 т; Pt около 10 т; Mn свыше 1 млн т; Cr не менее
200 тыс. т.
Что же такое металл? Как его отличить от неметаллов? Какие свойства являются характерными для металла?
Физико-химические представления о металлах. Первое научное оп-
ределение металла дано великим русским ученым М.В. Ломоносовым: «Металл – это светлое тело, которое ковать можно». В этом определении заложен глубокий физический смысл, вытекающий из особенностей атомного строения. В настоящее время металлами называют вещества, обладающие высокой электропроводностью и отрицательным термическим коэффициентом электропроводности.
Положительно заряженное ядро атома окружено отрицательно заря-
женными электронами, распределяющимися по энергетическим уровням: 1s2, 2s2, 2p6, 3s2, 3p6, (3d, 4s2), 4p6, (4d10, 5s2), 5p6, (5d10, 4f14), 6s2, (6d10, 5f14), 7s2.
Заполнение электронных уровней происходит в указанной последовательности. Для металлов характерным является наличие незаполненных уровней, наряду с полностью заполненными электронными уровнями. Электроны незаполненных уровней являются такими электронами, которые и образуют «электронный газ», обеспечивающий создание металлической связи.
Взаимодействие между положительными ионами и отрицательными коллективизированными электронами является основным фактором, определяющим металлическую связь. Ионы сохраняют постоянное положение и образуют пространственную решетку металла. Электроны, оторвавшиеся от атомов, свободно перемещаются между ионами. Считается, что электроны, оторвавшиеся от одних атомов, после некоторого перемещения вновь присоединяются к ионам, образуя нейтральные атомы, а затем вновь отрываются и т.д. Таким образом, в каждый момент времени определенная часть электронов может находиться в свободном состоянии.
Материаловедение. Учеб. пособие |
-13- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
Каждый из типов уровней, а именно уровни s имеют сферическую ориентацию, уровень p – гантелевидную, уровни d и f – эллипсоидальную. На внешней орбитали металлов обычно имеется 1 или 2 электрона. Переход электронов в коллективизированное состояние с внешней электронной орбитали приводит либо к сохранению формы внешней орбитали (если переходит в коллективизированное состояние 1 электрон), либо к оголению новой (нижней) орбитали. Это явление лежит в основе полиморфизма (аллотропического превращения) металлов, например, железа, марганца, кобальта, урана и других полиморфных металлов. Если после перехода электронов в коллективизированное состояние внешняя электронная оболочка – сферическая, то атомы упаковываются наиболее плотно, образуя одну из плотноупакованных решеток. Образование несферических орбиталей на поверхности атома приводит к формированию менее плотно упакованных решеток – обычно объем- но-центрованных.
Чем больше оторвавшихся (коллективизированных) электронов, тем больше электропроводность металла. Коллективизированные электроны движутся в самых различных направлениях и поэтому в нейтральном кристаллическом металле нет направленного потока и результирующего переноса электричества. Но как только между двумя точками кристалла извне создается разность потенциалов, коллективизированные электроны металла устремляются в определенном направлении или, другими словами, в металле появляется электрический ток. Чем менее связаны коллективизированные электроны и чем больше их количество, тем выше электропроводность металла. У элементов с малым количеством коллективизированных электронов наблюдается пониженная электропроводность и пластичность. Так как объем электрона ничтожно мал по сравнению с пространством, занятым кристаллической решеткой, коллективизированные электроны можно сравнить с атомами или молекулами газа, и к ним до некоторой степени могут быть применены законы газового состояния. В связи с этим совокупность коллективизированных электронов называют электронным газом. Электронный газ играет роль матрицы, связывающей положительные ионы прочной связью в своих положениях в кристаллической решетке. При этом электронные силы притяжения между электронами и ионами уравновешивают силы отталкивания, действующие между одноименно заряженными ионами.
Высокая пластичность металлов, отмеченная М.В. Ломоносовым, также обусловлена наличием коллективизированных электронов электронного газа. Например: в ионных соединениях солей, обладающих высокой хрупкостью, взаимодействие атомов осуществляется за счет притяжения положительно и отрицательно заряженных ионов (рис. 1.3).
Материаловедение. Учеб. пособие |
-14- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
Рис. 1.3. Схема строения ионного кристалла и его поведение при сдвиге ионов друг относительно друга
При воздействии на кристалл солей напряжений, вызывающих перемещение иона на долю междуатомного расстояния, происходит следующее: положительный ион, ранее находящийся в непосредственной близости с отрицательными ионами и притягивавшийся к нему, приближается к другому положительному иону и отталкивается от него. В результате возникают силы отталкивания между атомами, приводящие к хрупкому сколу кристалла.
В металлическом кристалле связь между ионами обеспечивается за счет перемещающихся частиц (электронов), не связанных с конкретным атомом. Поэтому смещение ионов на расстояния, соизмеримые с межатомными, не вызывает появления сил отталкивания.
При смещении слоя ионов перемещаются и электроны, поддерживая связь всего коллектива частиц, т.е. металлическому состоянию свойственна возможность смещения атомов из своего положения под действием силы извне без сколов, т.е. налицо явление пластичности.
Таким образом, физические свойства металлов, благодаря металлической связи в кристаллах, имеют свои особенности:
1.Более высокая электропроводность (на несколько порядков).
2.Уменьшение электропроводности с повышением температуры (у неметаллов с повышением температуры электропроводность растет).
3.Наличие у некоторых металлов явления сверхпроводимости при температурах вблизи абсолютного нуля.
4.Более высокая теплопроводность. Отличие в теплопроводности металлов и неметаллов значительно меньше, чем отличие в электропроводности. Например, теплопроводность серы всего в 3 раза меньше теплопроводности висмута и только на полтора порядка меньше теплопроводности железа.
5.Высокая пластичность металлов.
Кристаллическая структура металлов. Изучение металлов в соот-
ветствии с периодической системой элементов Менделеева показывает, что за исключением Mn и Hg элементы подгруппы А, в том числе переходные металлы и большинство редкоземельных элементов, а также металлы подгрупп IB и IIB и некоторые элементы группы IIIB, в том числе Al образуют одну из следующих типичных металлических структур: А1 – кубическая гранецентрированная решетка (ГЦК), А2 – кубическая объемно-центрированная решетка (ОЦК), А3 – гексагональная плотноупакованная решетка (ГПУ). Подавляющее большинство металлов имеют кристаллические структуры трех видов – это решетки типа вольфрама, меди и магния.
Материаловедение. Учеб. пособие |
-15- |
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
Структурный тип меди (А1). Решетка Браве – гранецентрированная кубическая решетка (ГЦК).
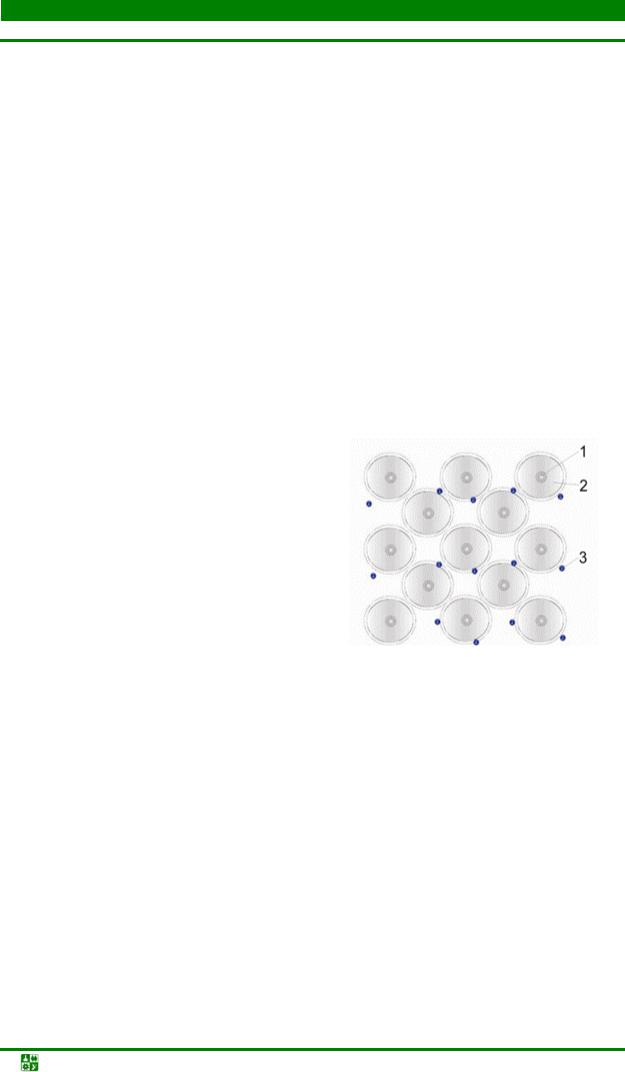
В кубической гранецентрированной решетке атомы располагаются по вершинам элементарной ячейки и в центрах ее граней (рис. 1.4, а).
а |
б |
в |
г |
Рис. 1.4. Гранецентрированнаякубическаярешетка(а), размещениевнейоктаэдрических (б) и тетраэдрических (в) пустот; г – расположение плотноупакованных плоскостей и направлений (111)
Каждый атом в этой решетке окружен 12 ближайшими соседями, рас-
полагающихся на одинаковых расстояниях, равных a /  2 = 0,707 а, где а – ребро элементарной ячейки. Число ближайших соседей, равное 12, называется координационным числом кристаллической решетки. Кристаллическая ГЦК-решетка имеет два вида пустот (междоузлий, в которых могут располагаться более мелкие атомы других элементов в сплавах), образующих твердые растворы внедрения.
2 = 0,707 а, где а – ребро элементарной ячейки. Число ближайших соседей, равное 12, называется координационным числом кристаллической решетки. Кристаллическая ГЦК-решетка имеет два вида пустот (междоузлий, в которых могут располагаться более мелкие атомы других элементов в сплавах), образующих твердые растворы внедрения.
Наибольшие пустоты находятся в центре куба и посередине его ребер. Каждая из этих пустот окружена шестью атомами ГЦК-решетки, занимающими места в вершинах правильного октаэдра, поэтому они называются октаэдрическими пустотами (рис. 1.4, б). Тетраэдрические пустоты имеют радиус, равный 0,41 r, где r – радиус атома. Такие положения различных элементов в гранецентрированной кубической решетке занимают атомы Na и Cl в решетке NaCl. Такие же положения занимает углерод в решетке γ-Fe.
Кроме этих пустот в ГЦК-решетке имеются более мелкие пустоты, называемые тетраэдрическими, поскольку их окружают 4 атома. Всего в ГЦКрешетке 8 тетраэдрических пустот радиусом 0,41 r и 0,225 r (рис. 1.4, в).
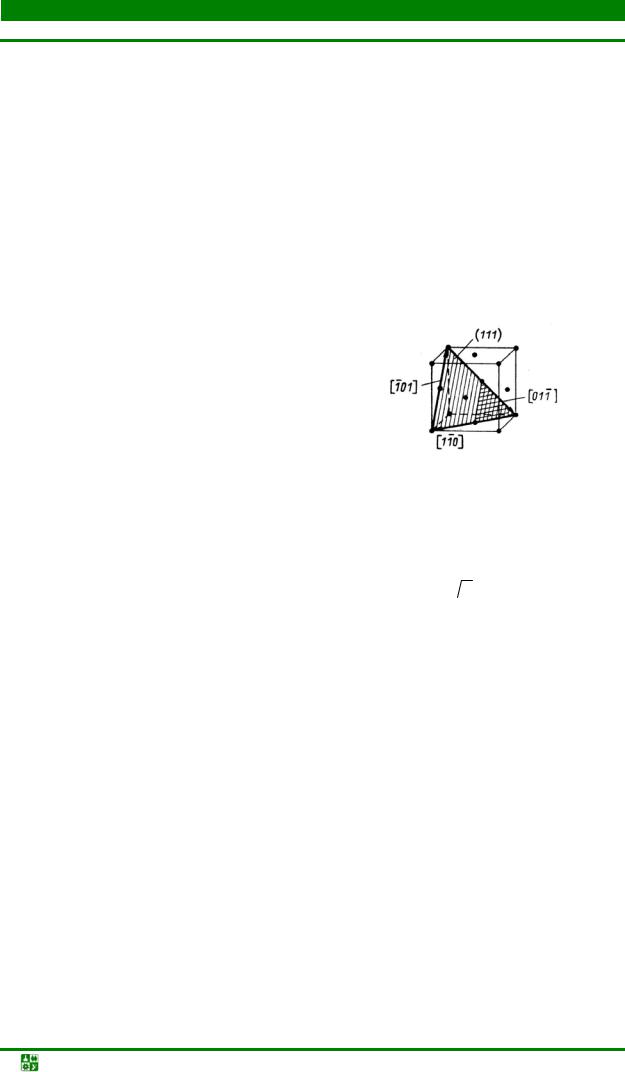
Наиболее плотноупакованными плоскостями в структуре гранецентрированного куба, чередующиеся в последовательности АВСАВС…, являются плоскости {111} (рис. 1.4, г). В этих плоскостях содержатся направления <110 > с плотноупакованными рядами атомов.
Материаловедение. Учеб. пособие |
-16- |
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
Кубической гранецентрированной решеткой ГЦК обладают следующие металлы: γ-Fe, Al, Cu, Ni, α-Co, Pb, Ag, Au, Pt и др.
Структурный тип вольфрама (А2). Решетка Браве является объемноцентрированной кубической решеткой (ОЦК), решетка ОЦК является менее плотноупакованной.
Атомы в решетке ОЦК располагаются в вершинах и в центре элементарной ячейки (рис. 1.5). Каждый атом в этой ячейке имеет 8 ближайших со-
седей, располагающихся на расстоянии 12 a 3 = 0,866 a , где, а – длина ребра
3 = 0,866 a , где, а – длина ребра
куба. Следовательно, координационное число решетки равно 8.
В структуре ОЦК также имеются 2 типа пустот. Крупные занимают положения на гранях куба (рис. 1.5, в). Они окружены 4 атомами, располагающимися в вершинах тетраэдра, ребра которых попарно равны. Более мелкие пустоты, окруженные 6 атомами, занимающими места в вершинах неправильного октаэдра, располагаются посередине ребер и граней ячейки (рис. 1.5, г). Если структуру ОЦК-решетки построить из жестких шаров, то в тетраэдрические пустоты можно поместить сферы радиусом 0,292 r, а в октаэдрические – 0,154 r.
Таким образом, максимальный размер сферы, которую можно поместить в пустоты более плотно упакованной решетки ГЦК оказывается большим, чем в решетку ОЦК. Внедрение других атомов в октаэдрическую пору ОЦК-решетки вызывает смещение двух атомов в направлении параллельными ребру куба, что вызывает расширение решетки в этом направлении. В структуре мартенсита, где атомы углерода внедряются в октаэдрические пустоты, расположенные только на ребрах, параллельных оси С и в центрах граней, перпендикулярных этой оси, это приводит к тетрагональному искажению решетки α-Fe.
а |
б |
в |
г |
Рис. 1.5. Объемно-центрированная кубическая решетка (а), размещение в ней наиболее плотной системы плоскостей и направлений (110) (б); тетраэдрических (в) и октаэдрических (г) пустот
Материаловедение. Учеб. пособие |
-17- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
Примесные атомы внедрения, располагающиеся в междоузлиях ОЦК, чаще всего занимают меньшие по объему октаэдрические пустоты, т.к. это приводит к меньшему искажению решетки по сравнению с нахождением в тетраэдрических пустотах.
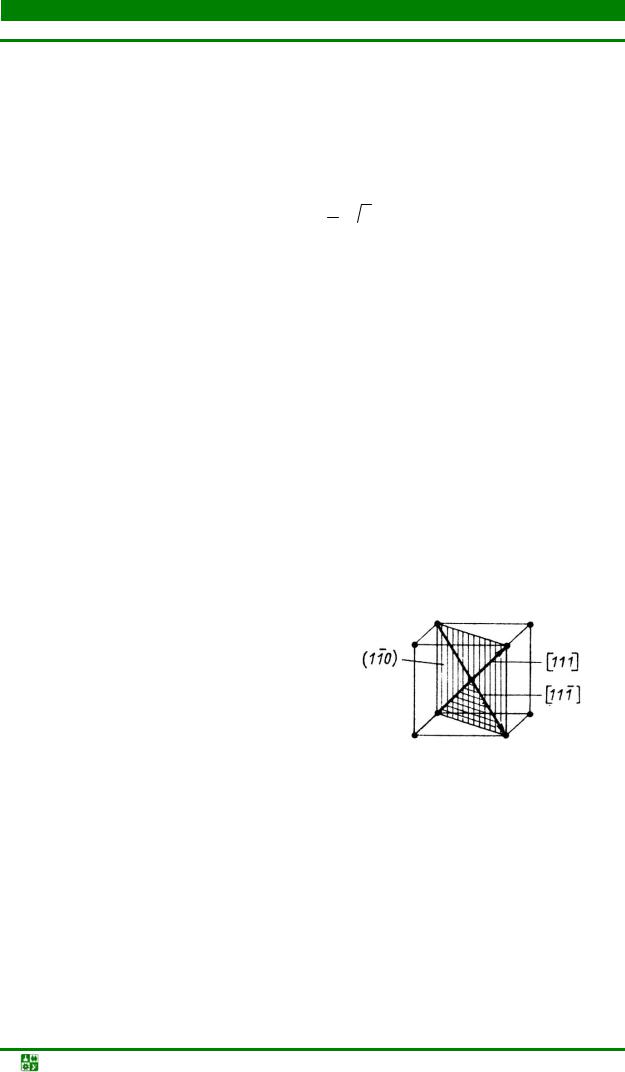
Наиболее плотноупакованными плоскостями ОЦК являются 12 плоскостей семейства {110} (рис. 1.5, б). В этих плоскостях имеются 2 направления <111>, в которых жесткие шары могут соприкасаться.
Объемно-центрированную кубическую решетку А2 (ОЦК) имеют металлы α-Fe, хром, вольфрам, молибден, ванадий, натрий, литий и др.
Структурный тип магния (А3) – гексагональная плотноупакованная решетка А3 (ГПУ, ГП, ГК). Решетка Браве – гексагональная примитивная. Плотная упаковка обеспечивается дополнительным слоем атомов, расположенным внутри шестигранной призмы. Гексагональная решетка построена из отдельных слоев, причем таким образом, что каждый атом любого слоя окружен 6 расположенными на равных расстояниях соседями, принадлежащими этому же слою, и, кроме того, имеет по три ближайших соседа в слоях, расположенных выше и ниже данного слоя (рис. 1.6).
Расстояние между атомами в гексагональных слоях обозначается через а, высота ячейки – через с. Шесть ближайших соседей, расположенных в смежных слоях, будут также находиться на расстоянии а от данного атома, если
отношение осей с/а составит |
8 |
3 |
=1,6330 , то такая структура называется иде- |
|
|
|
альной плотноупакованной. Причем координационное число в этом случае так же, как и в ГЦК-решетке, равно 12.
|
|
Рис. 1.6. Гексагональная плотноупако- |
|
|
ванная решетка (ГПУ): а – расположе- |
|
|
ние атомов; б – выделенные типы пус- |
а |
б |
тот в решетке: октаэдрическая (ввер- |
ху) и тетраэдрическая (внизу) |
Большинство металлов с гексагональной плотноупакованной решеткой имеет отношение осей с/а = 1,56 – 1,63. Исключения составляют Zn и Cd (1,86; 1,89). Это связано с тем, что электронные облака атомов Zn и Cd не обладают сферической симметрией и вытянуты вдоль оси «с». В гексагональной плотноупакованной решетке так же, как и в ГЦК, имеется 2 вида пустот: октаэдрические и тетраэдрические (рис. 1.6, б). Диаметры жестких сфер, которые могут быть помещены в эти пустоты, так же, как и для ГЦК, равны
0,41 r и 0,225 r.
Материаловедение. Учеб. пособие |
-18- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
Плотнейшие слои атомов типа {0001} располагаются в последовательности АВАВ… В каждой такой плоскости имеется три плотноупакованных направления типа <1120>.
Гексагональной плотноупакованной решеткой обладают такие метал-
лы, как Zn, β-Co, Cd, Mg, α-Ti, α-Zr, Sc, Be.
Достаточно взглянуть на построение плотноупакованных плоскостей ГЦК-решетки {111} (рис. 1.7, а), чтобы найти полную аналогию в построении атомов в этих двух решетках. Разница этих решеток состоит в чередовании слоев. Если в гексагональной решетке происходит чередование слоев АВАВ и т.д., то в ГЦК-решетке: …АВСАВС… (рис. 1.7, б), т.е. при этом используется третье возможное положение плотноупакованного слоя.
Разница в энергетическом отношении между этими двумя решетками незначительна, поэтому последовательность чередования слоев может легко нарушиться при пластической деформации, а также в результате возникновения дефектов кристалла во время его роста, называемых дефектами упаковки. Таким образом, кажущаяся разница в построении ГПУ и ГЦК решетки совсем не велика (рис. 1.7).
а б
Рис. 1.7. Схема расположения плотноупакованных атомных слоев в решетках: а – ГПУ; б – ГЦК
Углерод в виде алмаза, кремний, герма- |
|
|
ний, α-олово (серое) имеют кубическую решет- |
|
|
ку типа алмаза (рис. 1.8). Она отличается от |
|
|
ГЦК-решетки наличием в четырех из восьми |
|
|
тетраэдрических пустот дополнительно четы- |
|
|
рех атомов. В результате структура оказывает- |
|
|
ся более рыхлой. Каждый атом алмаза окружен |
|
|
лишь четырьмя ближайшими соседями, распола- |
Рис. 1.8. Кристаллическая |
|
гающимися в углах правильного тетраэдра. Ко- |
||
решетка алмаза |
||
ординационное число такой структуры равно 4. |
||
|
Одни и те же металлы при разных температурах могут иметь разное кристаллическое строение, что вызвано их аллотропией. Аллотропическим (полиморфным) превращением называют изменение пространственной решетки кристаллического тела при нагреве или при охлаждении. В качестве примеров аллотропических превращений можно привести превращение низ-
Материаловедение. Учеб. пособие |
-19- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
котемпературной аллотропической формы α-Fe с ОЦК-решеткой в высокотемпературную форму γ-Fe с ГЦК-решеткой, при температуре 910 °С и последующее превращение при температуре 1392 °С γ-Fe в δ-Fe с ОЦКрешеткой, аналогичной α-Fe. Аллотропические превращения можно наблюдать в титане, цирконии и т.д. В титане и цирконии низкотемпературной формой являются α-Ti, α-Zr с ГП-решеткой. При температуре выше 882 °С для титана и 862 °С для циркония образуются β-Ti и β-Zr, обладающие ОЦК-решеткой.
Характеристика реального металла. Расчетами теоретической проч-
ности металлов, основанными на классической теории, представляющей металл идеально построенным конгломератом, в котором атомы занимают строго определенные места в кристаллических решетках, показано, что реальная прочность металлов в десятки и сотни раз ниже теоретической.
Прочность технически чистого металла составляет 250–300 МПа, тогда как теоретическая прочность ее должна быть порядка 15 000 МПа.
Причиной такого снижения прочности является отклонение порядка расположения атомов в кристаллических решетках металла от идеального расположения, рассмотренного выше. Реальный металл всегда не идеально чистый, и присутствующие в металле примеси, даже в очень небольших количествах, приводят к появлению дефектов кристаллического строения металла. Физические нарушения (дефекты) твердых металлов обусловлены отклонением от правильного идеального расположения атомов в решетке металлов.
Даже идеально построенный единичный монокристалл имеет дефекты, т.к. он имеет грани. В силу поверхностного натяжения решетка на поверхности металла и в прилегающих участках оказывается искаженной. Еще более искаженными оказываются решетки поликристаллических тел в зонах границ зерен. Границы зерен – один из видов дефектов кристаллического строения.
Более тонкими нарушениями кристаллического строения является субзеренная структура металлов. Если идеально построенный монокристалл или кристаллит поликристалла можно представить в виде идеальной сетки, то фактическая кристаллографическая ориентировка в зернах идеального кристалла отличается от идеальной, образуя так называемую субзеренную структуру зерна (рис. 1.9).
а |
б |
Рис. 1.9. Схема субзеренного строения зерна
Материаловедение. Учеб. пособие |
-20- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
Участки с одинаковой ориентировкой называются здесь субзернами. Они ориентированы относительно друг друга на очень небольшой угол (порядка нескольких угловых секунд или минут). Размеры субзерен – 10-4–10-5 см. Границы между субзернами являются дефектами кристаллографического строения и называются субзеренными границами. Границы зерен и субзеренные границы относятся к поверхностным (двухмерным) дефектам.
Включения вторых фаз в сплаве, а также микропоры представляют собой класс объемных (трехмерных) дефектов. Эти дефекты оказывают значительное влияние на механические и физические свойства металлов и сплавов, однако решающее значение в этом отношении имеют точечные (нульмерные)
илинейные (одномерные) дефекты.
Кточечным дефектам относятся вакансии и дислоцированные атомы
(рис. 1.10). Вакансии и междоузельные атомы играют решающую роль в процессах диффузии, но могут влиять и на механические свойства. Наличие вакансий в решетке сообщает атомами подвижность, т.е. позволяет им перемещаться в процессах диффузии и самодиффузии в металлах и сплавах.
а |
б |
Рис. 1.10. Схема точечных дефектов в атомном строении металлов: а – вакансия; б – дислоцированный атом
Вакансия образуется путем выхода атома, находящегося в верхней атомной плоскости кристалла, на поверхность, вследствие чего образуется вакансия на поверхностном слое, в которую может перейти любой из соседних атомов, образуя новую вакансию и т.д. Таким образом, путем перескока атома на место существующей вакансии, она перемещается в объеме кристалла, сообщая атомам необходимую в процессах диффузии подвижность. Количество вакансий в каждом металле является строго определенной величиной, зависящей от температуры.
Дислоцированные атомы образуются в результате перескоков из своего регулярного положения в ближайшее междоузлие. Эти перескоки могут осуществляться в результате локальных повышений температуры и напряжений, сообщающих отдельным атомам энергию, повышающую среднюю тепловую энергию всех атомов. Вероятность образования дислоцированных атомов по сравнению с вакансиями значительно меньше, поэтому и концентрация дислоцированных атомов всегда значительно меньше, чем вакансий. При нали-
Материаловедение. Учеб. пособие |
-21- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
чии в сплаве обоих типов точечных дефектов может происходить их взаимодействие, в результате которого уменьшается число дефектов решетки.
К линейным дефектам относятся дислокации. Выделяют два основных вида линейных несовершенств: краевые и винтовые дислокации.
Краевые дислокации в кристалле возникают в том случае, если часть кристалла по всей плоскости скольжения под действием напряжений сдвигается относительно другой его части на некоторую величину, соизмеримую с межатомным расстоянием или его частью (рис. 1.11).
а |
б |
Рис. 1.11. Схема образования краевой дислокации
После появления дислокации продолжение длительности действия напряжений приводит к перемещению краевой дислокации в плоскости скольжения в направлении действия напряжения, называемого вектором сдвига. Графически краевая дислокация представляет собой структурное несовершенство кристаллической решетки, вызванное в ней присутствием в ней «лишней» атомной полуплоскости (экстраплоскости). Эта плоскость перпендикулярна плоскости рисунка. Область, находящаяся вблизи края экстраплоскости, называется ядром дислокации. В ядре дислокации наблюдается наибольшее искажение кристаллической решетки: выше кромки экстраплоскости решетка оказывается сжатой, ниже – растянутой, а по бокам сдвинутой. Длина линии дислокации в плоскости, перпендикулярной рисунку, имеет тот же порядок, что макроскопические размеры кристалла. Часто дислокации распространяются через весь кристалл. Поперечные размеры дислокации весьма малы (в радиусе порядка десяти межатомных расстояний).
Рис. 1.12. Положительная и отрицательная краевые дислокации в кристалле
Материаловедение. Учеб. пособие |
-22- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
Различают положительные краевые дислокации, если сдвигается верхняя частькристалла, иотрицательные, еслисдвигается егонижняячасть(рис1.12).
Взаимодействие разноименных дислокаций, сдвигающихся в одной плоскости скольжения, может приводить к аннигиляции дислокаций, к изменению количества дефектов решетки.
Основными характеристиками дислокаций являются вектор сдвига, называемый вектором Бюргерса, и направление линии дислокации.
Вектор Бюргерса является основной количественной энергетической характеристикой дислокации. Вектор Бюргерса, с одной стороны, отражает способность дислокации при своем движении вызвать пластический сдвиг данной величины и направления, а с другой стороны, является мерой искаженности кристаллической решетки, содержащей дислокацию. Линия краевой дислокации перпендикулярна вектору сдвига. Следовательно, образующаяся в металле под действием возникающих внутренних напряжений краевая дислокация может двигаться параллельно самой себе в плоскости скольжения в направлении, перпендикулярном линии дислокации.
Винтовая дислокация образуется при сдвиге одной части кристалла относительно другой не одновременно по всей плоскости скольжения (рис. 1.13). В этом случае наиболее искаженную кристаллическую решетку получают микрообъемы металла на линии, параллельной вектору сдвига. При этом вокруг такой линии атомные плоскости оказываются изогнутыми по винтовой линии. Радиус воздействия дислокации на эти плоскости находится в пределах нескольких десятков межатомных расстояний.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а |
|
|
|
б |
|
||
|
|
||||||
Рис. 1.13. Сравнение краевой (а) и винтовой (б) дислокаций
У винтовой дислокации, в отличие от краевой, линия дислокации параллельна вектору Бюргерса, а направление перемещения дислокации перпендикулярно ему (рис. 1.13). Винтовые дислокации также могут иметь разные знаки, в этом случае они называются правой и левой дислокаций. При встрече разноименных винтовых дислокаций может иметь место их аннигиляция.
Как винтовая, так и краевая дислокации в идеальном случае являются прямолинейными несовершенствами. Однако в реальном металле могут иметь место криволинейные дислокации, составленные из нескольких краевых и винтовых дислокаций. Такая дислокация называется смешанной.
Материаловедение. Учеб. пособие |
-23- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
Для чего необходимо знание дефектов кристаллического строения (и в частности дислокаций) для специалистов различных специальностей? Оказывается, что дислокации принимают непосредственное участие во всех структурных и фазовых превращениях в металлах и сплавах и оказывают значительное влияние на их свойства. Тщательное изучение субзеренных границ и границ зерна показывает, что они являются скоплениями несовершенств кристаллического строения, и в наи-
большей степени дислокаций (рис. 1.14).
На рисунке приведена схема субзеренной границы, составленной из краевых дислокаций. Воздействуя каким-либо образом на количество дислокаций, можно увеличить степень разориентировки субзерен, уменьшить их размеры или размер зерна, тем самым оказывая непосредственное влияние на физи-
ко-механические свойства металлов и сплавов. С одной стороны, управляя механизмом перемещения дислокаций в металлах, воздействуя на их подвижность, можно вызывать упрочнение или разупрочнение сплавов. С другой стороны, количество дислокаций в материале, их взаимодействие и распределение определяет поведение материала в изделии под действием эксплуатационных нагрузок и температурных воздействий. Выходы дислокаций на поверхность кристалла и внешнюю поверхность изделия повышают химическую активность материала, снижают его коррозионную стойкость. Дислокации являются катализаторами выделения избыточных фаз в сплавах, воздействуя на процессы распада пересыщенных твердых растворов и иные процессы фазовых превращений.
Рассмотренные дефекты кристаллической решетки, как мы видим, приводят к ее искажениям. Эти искажения вызывают рост энергии кристалла. Обычно эту добавочную энергию условно выражают в виде напряжений. Согласно классификации внутренних напряжений, предложенной Н.Н. Давиденковым, их классифицируют как напряжения I, II, и III рода. К микронапряжениям II рода относятся остаточные напряжения, уравновешивающиеся в объемах отдельных зерен или субзерен. Эти напряжения возникают в результате наличия средней деформации кристаллических решеток, составляющих объемы соответствующих зерен или субзерен. Наличие напряжений II рода приводит к размытию рентгеновских линий на рентгенограмме. Величина размытия линий определяет величину напряжений II рода.
К микронапряжениям III рода относят остаточные напряжения, возникающие в результате отклонений атомов в кристаллической решетке от идеального положения вокруг единичных дефектов кристаллической решетки (точечных или линейных). Эти напряжения уравновешиваются в объемах с радиусом, соизмеримым с одним или несколькими межатомными расстояниями в кристаллической решетке.
Материаловедение. Учеб. пособие |
-24- |
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
Основная масса микронапряжений сосредоточена в пограничных зонах: по границам блоков, кристаллов, а также в зонах кристаллов, в которых наблюдается повышенная плотность дислокаций.
Напряжения I рода – макроскопические, возникающие в результате наиболее грубых дефектов в металлах. Эти напряжения уравновешиваются в объемах, соизмеримых с объемом тела или его макроскопических зон. Наиболее ответственными за изменение физико-механических свойств металлов и сплавов являются напряжения II и III рода, в первую очередь III рода, тогда как макронапряжения (I рода) отвечают за способность изделий надежно работать без разрушения в условиях эксплуатации под действием динамических нагрузок, усталостного разрушения и в иных сложных ситуациях.
1.3. Характеристикаполимерныхикомпозиционныхматериалов
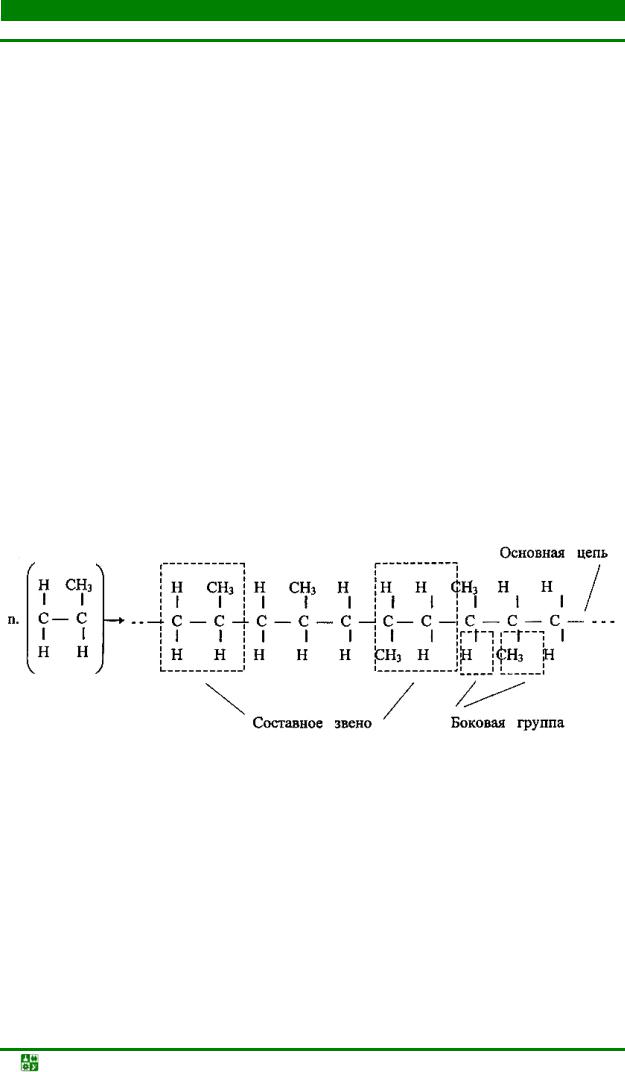
Полимерные вещества: состав, строение и структура. Строение полимерных веществ определяют молекулы – это минимальные частицы вещества с основными его химическими свойствами. Они состоят из атомов, между которыми действуют химические связи. Молекула полимера состоит из множества одинаковых по строению групп атомов и называется макромолекулой. Элементы макромолекулы – это основная цепь, составное звено и боковые группы (рис. 1.15).
Рис. 1.15. Схема строения линейной макромолекулы полимера
Основная цепь – это последовательность химически связанных атомов. Составное звено – группа атомов, которая описывает строение всей цепи макромолекулы. Боковые группы – это атомы, группы атомов, отрезки полимерных молекул разной длины.
Полимерами называют вещества, макромолекулы которых состоят из составных звеньев одинаковой структуры (мономеров). По химическому составу основной цепи полимеры могут быть неорганическими, органическими, элементоорганическими.
Неорганические – это полимеры, в основной цепи которых нет углерода и боковых органических групп. В основной цепи находятся оксиды кремния,
Материаловедение. Учеб. пособие |
-25- |
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
алюминия, магния, кальция. Исключение составляет графит. Эти полимеры имеют высокую плотность, длительную теплостойкость, но хрупки, не эластичны, не выдерживают динамических нагрузок. Неорганические полимеры
– это керамика, асбест, силикатные стёкла, графит, горные вулканические породы (базальты, диабазы).
Ворганических полимерах основная цепь образована углеродными атомами, вместе с которыми могут быть атомы кислорода (повышают гибкость цепи), атомы фосфора и хлора (повышают огнестойкость), атомы серы (придают газонепроницаемость), атомы фтора (придают химическую стойкость). К органическим полимерам относят пластмассы, композиционны материалы, каучуки, резины, клеи, герметики, масла и т.д.
Элементоорганические (гетероцепные) полимеры в основной цепи содержат углерод, атомы неорганических элементов Si, Ti, Al и др. (увеличи-
вают теплостойкость), органические радикалы СН3, С6Н5, СН2 и др. (придают прочность и пластичность). В природе таких материалов нет, они – искусственные (кремнийорганические соединения).
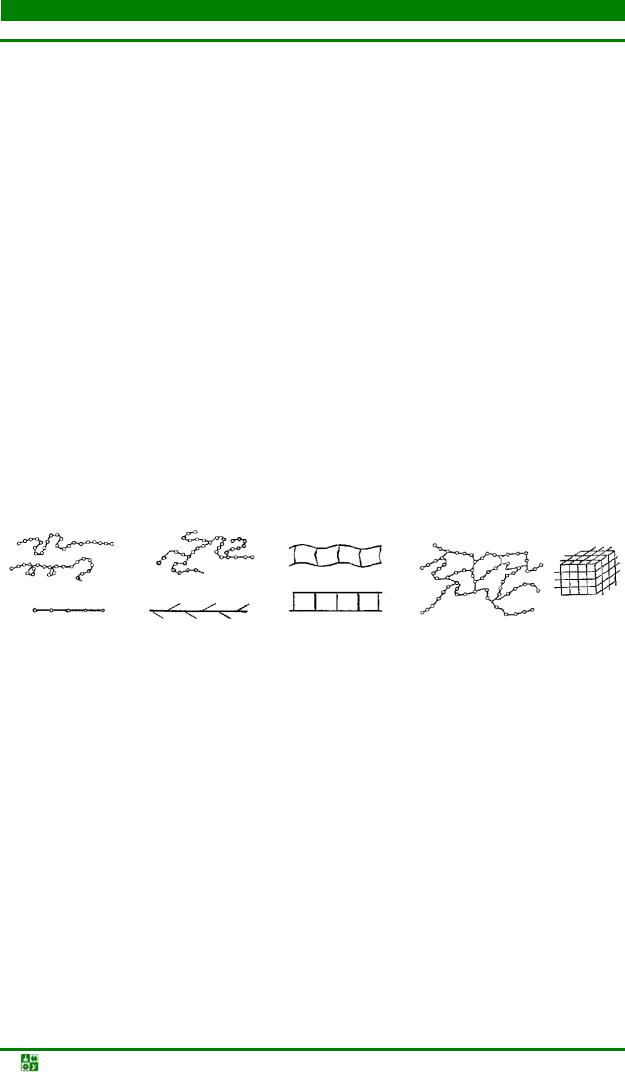
Вмакромолекулах составные звенья могут быть одинаковыми по химическому составу (мономеры) или различными (сополимеры). Макромолекулы полимеров могут образовывать между собой пространственные конфигурации следующих видов: линейная, разветвленная, лестничная, сетчатая
(рис. 1.16).
а |
б |
в |
г |
Рис. 1.16. Формы макромолекул полимеров: а – линейная; б – разветвленная; в – лестничная; г – сетчатая
Строение полимера определяет его физические свойства. Линейные (рис. 1.16, а) и разветвлённые (рис. 1.16, б) полимеры (полиэтилен, полистирол и др.) при нагревании размягчаются, а при охлаждении затвердевают. Их называют термопластами. Они имеют высокоэластичное и вязкое состояние. Лестничные полимеры (рис. 1.16, в) имеют повышенную теплостойкость, жёсткость, не растворяются в органических растворителях (кремнийорганические полимеры). В сетчатых полимерах (рис. 1.16, г) макромолекулы соединены между собою в поперечном направлении прочными химическими связями. При этом может быть разная густота сетки. Редкосетчатые полимеры являются упругими (мягкие резины), они не растворяются, не плавятся. Пластинчатый полимер – графит относится к сетчатым полимерам. Густосетчатые полимеры имеют высокую твёрдость, теплостойки, нерастворимы. Пространственные полимеры стеклообразны, термореактивны. Они обратимо не
Материаловедение. Учеб. пособие |
-26- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
изменяют свои свойства, при нагревании становятся неплавкими, нерастворимыми, повторно не формируются (фенолоформальдегиды, карбамиды и т.д.)
Если макромолекулы имеют сетчатую структуру в полимерах, то возникают надмолекулярные структуры (упорядочение) следующих видов: глобулы, пачки, ленты, пластины (рис. 1.17). Надмолекулярные структуры полимеров: аморфное – для глобул и кристаллическое – для пластин.
а |
б |
в |
Рис. 1.17. Схема состояния макромолекул линейных полимеров: а – аморфное беспорядочное; б – аморфное ориентированное; в – кристаллическое
Кристаллические полимеры имеют высокие температуру плавления, плотность, прочность, теплостойкость, низкую прозрачность и проницаемость. В них надмолекулярные структуры – это зёрна с одинаковой кристаллической структурой.
Аморфные полимеры имеют ближнее упорядочение – глобулы с глобулярной структурой, поэтому их механические свойства низкие (хрупкие).
В реальных полимерах почти всегда есть и аморфная и кристаллическая фазы, содержание которых зависит от формы цепи, межмолекулярных сил, внешних условий. Поэтому полимеры оценивают степенью кристалличности – содержанием в нем веществ кристаллического состояния, в процентах. Если образуются кристаллиты, то у полимера снижается эластичность, способность деформироваться.
Коднородным полимерным веществам относят:
•мономеры – вещества, молекулы которых образуют одно или несколько повторяющихся звеньев;
•олигомеры – вещества, молекулы которых содержат составные звенья, соединенные повторяющимся образом;
•полимеры.
Однородные полимерные вещества делят:
•на природные (белки, смолы, каучук, целлюлоза, слюда, графит) и синтетические, которые образуются при химическом синтезе путем полимеризации (процесс соединения молекул мономеров) или поликонденсации (процесс синтеза для получения высокомолекулярных соединений);
•стеклообразные, высокоэластичные и вязкотекучие – по физическому состоянию;
Материаловедение. Учеб. пособие |
-27- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
•полярные и неполярные – по электрическим свойствам;
•термопластичные (при повышении температуры размягчаются) и термореактивные (при нагреве химически изменяются, затвердевают и пластически не деформируются при повторном нагреве).
Каучук – натуральное или синтетическое непредельное, высокомолекулярное, термопластичное соединение с двойной химической связью между углеродными атомами в звеньях макромолекулы. Молекулы каучуков зигзагообразные, их структура – линейная или слаборазветвленная.
Натуральный каучук – эластичный полимер изопрена (С5Н8)n, получаемый коагуляцией латекса каучуконосных растений. Резины на их основе высокоэластичные и прочные. Латекс – млечный сок каучуконосных растений.
Синтетические каучуки – эластичные полимеры, которые получают полимеризацией. Известно более 250 их видов (бутадиеновые, бутадиеннитрильные, бутадиенстирольные, изопреновые, кремнийорганические, фторкаучуки, этиленпропиленовые и др.).
Ктермопластичным полимерам относят полиэтилен, полипропилен, полиизобутилен, полистирол.
Полиэтилен – синтетический высокомолекулярный полимер на основе непредельных углеводородов (продукт полимеризации этилена). Различают полиэтилен низкого давления – ПЭНД (ГОСТ 16337-77) и высокого давления – ПЭВД (ГОСТ 16338-77). Полиэтилен прочен, эластичен, диэлектрик, но с низкой теплостойкостью. Его назначение – ненагруженные детали (контейнеры, вентили, трубы); защитные покрытия на металлах, пленка разного назначения.
Полипропилен химически стоек, превосходит полиэтилен по тепло-
стойкости (до 150 °С) и механическим свойствам. Из него изготавливают некоторые детали автомобилей, корпуса насосов, трубы.
Полиизобутилен – мягкий полимер, который невозможно вулканизировать. Применяют его для гидроизоляции строительных конструкций, получения клеев.
Полистирол – твердое стеклообразное вещество; диэлектрик, химически стоек, имеет высокую прозрачность, но хрупкий. Идет на изготовление пенопласта, деталей машин и приборов (ручки, корпуса), емкостей для химикатов.
Ктермопластичным полимерам относятся также поливинилхлорид (идет на изготовление пластмасс – винипластов и пластикатов); поливинилацетат (применяется в производстве лаков и красок); фторопласты (идут на изготовление подшипников скольжения, прокладок, деталей химического производства); полиакрилаты (для производства штампов, абразивного инструмента); полиуретаны (применяют в производстве пенопластов, лаков).
Ктермореактивным полимерам относят фенолальдегид, аминоалдьдегид, полиформальдегид, полиамиды, фурановые, эпоксидные и кремнийорганические полимеры.
Фенолальдегидные полимеры применяют для производства слоистых пластиков, пластмасс, минераловаты. Это отвержденные продукты.
Материаловедение. Учеб. пособие |
-28- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
Аминоальдегидные полимеры – продукты поликонденсации аминов с альдегидами.
Полиформальдегид применяют вместо цветных металлов сплавов для изготовления деталей; делают пленки и волокна.
Полиамиды – это капрон, нейлон и т.д. Фурановые полимеры идут для получения полимерных бетонов, защитных лаков, клеев. Из эпоксидных полимеров изготавливают водо- и химически стойкие клеи, связующее для стеклопластиков. Кремнийорганические полимеры (полиоксаны, силиконы – физиологически-инертные) идут на изготовление герметиков, пенопластов, электрохимических деталей.
Композиционные материалы. Одним из основных способов создания новых материалов является комбинирование разных материалов. Композиционные материалы (композиты) – это искусственные материалы из двух и более компонентов, которые сохраняют свои свойства.
Признаки композиционных материалов: состав и форма компонентов; строение, определенные их количества; различие компонентов по свойствам; наличие границ раздела между компонентами. В композитах различают матрицу (она непрерывна по объему материала) и упрочнитель (армирующий компонент – прерывный).
По природе матрица и упрочнитель могут быть полимерными (пластики), металлическими и минеральными. Матрица придает композиту механические, теплофизические свойства, химическую стойкость, уровень рабочих температур, возможность совмещения с упрочнителем. Упрочнители могут быть активными и инертными (последние повышают трещиностойкость композита). Упрочнители могут быть:
•порошкообразные (дисперсные);
•волокнистые (отношение длины к толщине равно 10 и более – нити, волокна, проволока): стеклянные, углеродные, борные, металлическая проволока; обрезки волокон называют фибрами;
•слоистые (листовые); композит с таким упрочнителем называют слоистым.
Если упрочнитель порошкообразный, композит имеет изотропные свойства, высокую прочность и твердость, а если листовой – анизотропные свойства, высокий предел прочности на изгиб.
Композиты, одномерно армированные непрерывными волокнами, называют волокнистыми, а двумерно армированные тканями – текстолитами.
По назначению композиты делят на конструкционные, инструментальные, электротехнические и др.
1.4. Методыисследованиявматериаловедении
Основными методами исследования в металловедении и материаловедении являются макро- и микроанализ.
Макроанализ включает изучение поверхностных дефектов, поверхности разрушенных образцов или изломов и макроструктуры слитков, полу-
Материаловедение. Учеб. пособие |
-29- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
фабрикатов и изделий. Макроанализ не требует использования специального оборудования, проводится без применения увеличительных приборов или при помощи лупы. Анализ осуществляется визуальным наблюдением дефектов поверхности и внутреннего строения материалов.
Излом – самый простой и доступный способ оценки внутреннего строения металлов. Метод оценки изломов, несмотря на свою кажущуюся грубость оценки качества материала, применяется довольно широко в различных отраслях производства и научных исследований. Оценка излома во многих случаях может характеризовать качество материала.
Излом может быть кристаллическим или аморфным. Аморфный излом характерен для материалов, не имеющих кристаллического строения, таких как стекло, канифоль, стекловидные шлаки.
Металлические сплавы, в том числе сталь, чугун, алюминиевые, магниевые сплавы, цинк и его сплавы, дают зернистый, кристаллический излом. В зависимости от пластичности и вязкости металлических материалов, поверхность изломов существенно различается, излом может быть вязким или хрупким. Для вязкого разрушения, которое сопровождается значительной пластической деформацией, характерна развитая поверхность излома. Такой излом называется волокнистым. Хрупкое разрушение реализуется при незначительной пластической деформации, и поверхность излома часто имеет морфологию, связанную с формой и расположением кристаллов. К хрупким изломам относят кристаллические, фарфоровидные, нафталинистые, камневидные. Каждая грань кристаллического излома является плоскостью скалывания отдельного зерна. Поэтому по излому можно определять размеры зерна металла. Изучая излом стали, можно видеть, что размер зерна изменяется в очень широких пределах: от нескольких сантиметров в литой, медленно остывшей, стали до тысячных долей миллиметра в правильно откованной и закаленной стали. В зависимости от размера зерна, излом может быть крупнокристаллический и мелкокристаллический. Обычно мелкокристаллический излом соответствует более высокому качеству металлического сплава.
Вслучае волокнистого излома разрушение исследуемого образца проходит с предшествующей пластической деформацией, зерна в плоскости излома деформируются, и излом уже не отражает внутреннего кристаллического строения металла. Часто в одном образце, в зависимости от уровня его пластичности, в изломе могут быть волокнистые и кристаллические участки.
Хрупкий кристаллический излом может быть получен при разрушении по границам зерен или по плоскостям скольжения, пересекающим зерна. В первом случае излом называется межкристаллитным, во втором – транскристаллитным. Иногда, особенно при очень мелком зерне, трудно определить природу излома. В этом случае излом изучают с помощью лупы или бинокулярного микроскопа.
Впоследнее время получило развитие фрактографическое изучение изломов на металлографических и электронных микроскопах. При этом находят новые достоинства старого метода исследований в металловедении (исследований излома), используя понятия фрактальных размерностей.
Материаловедение. Учеб. пособие |
-30- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
Следующим методом исследования металлических материалов является макроструктурное исследование, которое заключается в изучении после травления плоскости сечения изделия или образца в продольном, поперечном или любых иных направлениях. Достоинством макроструктурного исследования стала возможность изучения структуры целой отливки или слитка, поковки, штамповки и т.д. С помощью этого метода исследования можно обнаружить внутренние пороки материала: поры, пустоты, трещины, расслоения шлаковые включения, определить размер и форму кристаллов, и изучать и химическую неоднородность (ликвацию) при кристаллизации слитка. Например, с помощью серных отпечатков макрошлифов на фотобумаге по Бауману определяется неравномерность распределения серы по сечению слитков. Большое значение этот метод исследования имеет при исследовании кованых или штампованных заготовок для определения правильности направления волокон в металле.
Одним из основных методов в металловедении является исследование микроструктуры металла на металлографических и электронных микроскопах. Этот метод позволяет изучать микроструктуру металлических объектов с большими увеличениями: от 50 до 2 000 раз на оптическом металлографическом микроскопе и от 10 до 200 тыс. раз на электронном микроскопе. Исследование микроструктуры производится на полированных шлифах. На нетравленых шлифах изучается наличие неметаллических включений, таких как оксиды, сульфиды, мелкие шлаковые включения и другие включения, резко отличающиеся от природы основного металла.
Микроструктура металлов и сплавов изучается на травленых шлифах. Травление обычно производится слабыми кислотами, щелочами или другими растворами, в зависимости от природы металла шлифа. При травлении поразному растворяются различные структурные составляющие, которые окрашиваются в разные тона или цвета. Границы зерен, отличающиеся от основного раствора, имеют травимость, обычно различающуюся от основы, они выделяются на шлифе в виде темных или светлых линий.
Видимые под микроскопом полиэдры зерен представляют собой сечения зерен поверхностью шлифа. Так как это сечение является случайным и может проходить на разных расстояниях от центра каждого отдельного зерна, то различие в размерах полиэдров не соответствует действительным различиям в размерах зерен. Более крупные зерна имеют величину, наиболее близкую к действительному размеру зерна.
При травлении образца, состоящего из однородных кристаллических зерен, например чистого металла, однородного твердого раствора наблюдается часто различно протравленные поверхности разных зерен (рис. 1.18). Это явление объясняется тем, что на поверхности шлифа выходят зерна, имеющие различные кристаллографическую ориентировку, вследствие чего степень воздействия кислоты на эти зерна оказываются разной. Одни зерна выглядят блестящими, другие сильно протравливаются, темнеют (рис. 1.18, б). Это потемнение связано с образованием различных фигур травления, по-разному отражающих световые лучи. В случае сплавов, от-
Материаловедение. Учеб. пособие |
-31- |
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
дельные структурные составляющие образуют микрорельеф на поверхности шлифа, имеющий участки с различным наклоном отдельных поверхностей
(рис. 1.19, а).
Нормально расположенные участки отражают наибольшее количество света и оказываются наиболее светлыми. Другие участки – более темные. Часто контраст в изображении зернистой структуры связан не со структурой поверхности зерен, а с рельефом у границ зерен. Существует 3 разновидности границ зерен (рис. 1.19, б, в, г). Кроме того, различные оттенки структурных составляющих могут являться результатом образования пленок, образованных при взаимодействии травителя со структурными составляющими.
С помощью металлографического исследования можно осуществлять качественное выявление структурных составляющих сплавов. Количественное изучение микроструктуры металлов и сплавов можно проводить, вопервых, путем сравнения с известными изученными структурными составляющими и, во-вторых, специальными методами количественной металлографии. Использованием методов количественной обработки изображений в микроскопе можно определить размер зерна, размеры и объем структурных составляющих материала, протяженность границ зерен и другие количественные характеристики.
а |
б |
Рис. 1.18. Микроструктура (а, б) однофазного сплава – твердого раствора в отожженном состоянии
а |
б |
в |
г |
Рис. 1.19. Схема образования контраста в изображении рельефных структур: а – формирование контраста; б – граница зерен; в – избирательное растравливание одной из фаз; г – граница с примесями
В настоящее время для исследования структуры металлов в металлографических исследованиях широко применяются электронный сканирующий и просвечивающий микроскопы. Если разрешающая способность оптического микроскопа достигает значений 0,00015 мм = 1500 Å, то разрешающая
Материаловедение. Учеб. пособие |
-32- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
способность электронных микроскопов достигает 2–10 Å, т.е. в несколько сот раз больше, чем у оптического, что связано с использованием волнового потока электронов с длинами волн 0,05–0,037 Å.
В просвечивающем электронном микроскопе осуществляют исследование тонких пленок (реплик), снятых с поверхности шлифа или непосредственное изучение тонких металлических пленок (фольг), полученных утонением массивного образца. Разрешение микроскопа позволяет изучать дефекты кристаллического строения, строение малоугловых и высокоугловых границ субзерен и зерен, распад пересыщенных твердых растворов при термическом или деформационном старении, связанных с выделением зоны ГеньеПрестона (ЗГП), когерентных и полукогерентных метастабильных фаз. Сочетание дифракции электронов с тонкой структурой фаз разрешает идентифицировать фазовый состав, устанавливать ориентационные соотношения, определять плотность дислокаций и решать другие задачи практического материаловедения.
Сканирующий (растровый) микроскоп дает возможность исследовать при значительном разрешении развитые поверхности, например изломы. Анализ структуры изломов позволяет описать характер разрушения, установить причину разрушения детали или изделия. Растровые электронные микроскопы снабжены рентгеновскими спектрометрами для проведения микрорентгеноспектрального анализа материалов. Такой анализ позволяет осуществлять с точностью 1–4 % качественного и количественного анализа поэлементного состава сплавов от 4 до 42 элемента в микрообъемах вещества до 0,5 мкм.
Методы рентгеноструктурного анализа (РСА) используют для реше-
ния широкого спектра материаловедческих задач. Этим методом можно определять качественный и количественный фазовый состав многокомпонентных веществ, оценивать степень упругой и пластической деформации без разрушения образца, изучать и контролировать процессы термообработки металлов и сплавов, расшифровывать структуры сложных кристаллических материалов и т.д.
Этот метод дополняет другие методы анализа веществ, а в ряде случаев является важным звеном в технологической цепочке, например, автоматизированный контроль фазового состава электролита при получении алюминия из глинозема.
Рентгеноструктурный анализ – это дифракционный метод. В его основе лежит взаимодействие между рентгеновскими лучами и кристаллическим веществом. Сложную картину рассеяния рентгеновских лучей атомами можно уподобить отражению этих лучей от атомных плоскостей кристалла по законам геометрической оптики. «Отражаясь» от параллельных плоскостей (hkl) с межплоскостным расстоянием dhkl, электромагнитные волны рентгеновских лучей будут усиливать друг друга (интерферировать), если они совпадут по фазе, т.е. в разность хода лучей уложится целое число длин волн nλ.
Уравнение дифракции рентгеновских лучей под названием формулы Вульфа-Брэггов имеет вид: 2 dhkl sin θ = nλ; если nλ – целое число длин волн,
Материаловедение. Учеб. пособие |
-33- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
то 2dhklsinθ – разность хода лучей, где θ – угол дифракции между отраженным лучом и атомной плоскостью. В случае использования монохроматического излучения (λ = const) для атомных плоскостей (hkl) с определенным значением dhkl/n имеем единственный угол θ, под которым будет наблюдаться интерференционный максимум на регистрирующем устройстве.
Данное следствие позволяет применить формулу Вульфа-Брэггов для установления фазового состава вещества. Каждая фаза обладает собственной кристаллической решеткой с определенным набором отражающих плоскостей и значениями dhkl/n. Зная длину волны рентгеновских лучей λ и определив угол дифракции θ из рентгенограммы, находим значения dhkl/n для всех атомных плоскостей, участвующих в отражении. Далее сравниваем dhkl/n расчетные с dhkl/n табличными из международной базы данных дифракционных стандартов ICDD (Объединенный комитет дифракционных данных). При совпадении значений делаем вывод о фазовом составе пробы. В настоящее время рентгенофазовый анализ автоматизирован и дает высокую точность как в качественном, так и в количественном определении соотношении фаз многокомпонентного образца.
Любые изменения в кристаллической решетке в случае полиморфного превращения, упругой, пластической деформации, термообработки ведут к изменению межатомных расстояний и, следовательно, изменению dhkl. В свою очередь это приводит к изменениям в дифракционной картине образца: к смене положения линий на рентгенограмме, их размытию, нарушению сплошности (например, в случае текстуры на размытых линиях появляются характерные уплотнения – текстурные максимумы) и т.д.
Изучая методом РСА изменения в кристаллической решетке по сравнению с исходным её состоянием, можно судить о тех процессах, которые вызвали эти изменения. Ярким примером являются труды отечественных ученых Г.В. Курдюмова, Л.И. Лысака, М.В. Захарова, Г.С. Жданова, В.И. Ивероновой, Я.С. Уманского и многих других, которые с помощью методов РСА внесли ясность в теорию термообработки (например, мартенситного превращения стали), старения цветных сплавов, фазовых превращений и т.д.
В материаловедении, кроме указанных методов, применяются:
•дилатометрический метод исследования внутренних превращений в металлах, основанный на измерении изменений индивидуальных объемов фаз в процессе фазовых превращений;
•метод термического анализа, основанный на принципе учета и измерения скрытого тепла превращения, происходящего в металле при тех или иных превращениях;
•магнитный анализ, основанный на свойствах ферромагнитных материалов изменять магнитные свойства с изменением температуры и протеканием фазовых превращений.
В материаловедении для определения характеристик превращений, происходящих в металлах и сплавах, используются также все доступные измерению химические, физические и механические свойства, изменяющиеся при протекании исследуемых превращений. Очень важными свойствами, оп-
Материаловедение. Учеб. пособие |
-34- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
ределяющими кинетику многих превращений, является электропроводность, растворимость в кислотах, плотность, твердость и др.
Практически все методы исследования, включая чисто металловедческие и изменения физико-механических свойств, должны применяться в комплексе, дополняя друг друга.
1.5.Физические, химическиеиэксплуатационныесвойстваматериалов
Ктипичным металлам относятся железо и алюминий, медь и свинец, титан и вольфрам и еще множество элементов. Какой из них лучше, какой следует применять в тех или иных условиях эксплуатации? С одной стороны, каждый материал обладает только ему присущим качеством, независимо от того, оцениваем ли мы его или нет. С другой стороны, качество можно охарактеризовать множеством свойств, которые нам кажутся наиболее важными в той или иной ситуации.
Металлы отличаются по внешнему виду, например, алюминий выглядит светло-серебристым, а медь – красной. Магний, алюминий и титан по первому ощущению кажутся легкими, свинец и вольфрам – тяжелыми. При нагревании свинец из кристаллического (твердого) состояния превращается в жидкость уже при 324 °С, тогда как вольфрам остается твердым до температур в 10 раз более высоких (температура плавления вольфрама 3 400 °С). Поэтому то или иное отдельно взятое свойство еще не может охарактеризовать качество материала. Для более полной характеристики качества определяют несколько свойств, наиболее важных для конкретных условий их применения.
Одной из главных задач материаловедов является правильный подбор материала для изготовления деталей конструкций, инструмента и изделий специального назначения. При разработке и выборе металлов и сплавов руководствуются основными требованиями: необходимый уровень эксплуатационных свойств, достаточные характеристики технологических свойств, приемлемые экономические показатели производства сплавов и изделий из них.
Эксплуатационные свойства определяются назначением изделия, условиями его работы и заданными механическими, физическими, химическими свойствами. К конструкционным материалам предъявляются прежде всего требования по прочности, пластичности и вязкости разрушения. Для контроля термической обработки изделий из конструкционных материалов задаются требования по твердости и глубине упрочненного слоя. К ответственным изделиям предъявляются дополнительные требования по пределу текучести, пределу выносливости, ударной вязкости и другим свойствам. Важнейшей характеристикой при эксплуатации изделий является сопротивление коррозии.
Технологические свойства определяют поведение сплава в процессе производства изделий. К технологическим свойствам относятся литейные свойства, способность к обработке давлением, характеристики обрабатываемости резанием, свариваемость. Низкие технологические свойства выбранно-
Материаловедение. Учеб. пособие |
-35- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
го сплава не позволяют изготовить изделия с заданными параметрами. Например, если жидкотекучесть сплава невысокая, то из него невозможно изготовить деталь сложной конфигурации.
Экономические показатели также влияют на поиск материала. Выбранный состав сплава определяет стоимость затрат на получение самого сплава (стоимость металла, легирующих элементов, модификаторов и прочих материалов), а также стоимость изготовления из него отливок, полуфабрикатов и изделий. Необходимо учитывать капитальные затраты, связанные с использованием сплава. Например, если сплав необходимо подвергать упрочняющей термообработке, то предложенная технология приводит к увеличению стоимости расходов как на дополнительную технологическую обработку, так и на установку нового оборудования. Чрезвычайно высокая стоимость ограничивает применение предлагаемого сплава. Выбор состава сплава определяет затраты не только на производство, но и на эксплуатацию изделий. Снижение эксплуатационных расходов может перекрыть увеличение производственных затрат. Например, деталь из титанового сплава дороже детали из алюминиевого сплава, но срок службы ее без ремонта может быть намного больше, следовательно, использование детали из титанового сплава экономически более выгодно.
Все основные свойства материалов условно можно подразделить на следующие группы: химические, физические и механические.
Кхимическим характеристикам материалов относят химический состав,
втом числе наличие примесей, легирующих элементов; способность к химическому взаимодействию с кислотами и щелочами; коррозионная стойкость, определяемая в различных условиях химически активной воздействующей на материал среды, и некоторые другие свойства.
Кфизическим свойствам относят плотность (удельный вес) и способность материала изменять ее и размеры изделия при температурном воздействии (тепловое расширение); электропроводность и электросопротивление; комплекс магнитных характеристик, таких, например, как коэрцитивная сила, намагниченность насыщения, магнитная проницаемость. В комплекс теплофизических свойств входят теплоемкость, теплопроводность, коэффициент теплоизлучения, степень черноты поверхности и др.
Кмеханическим свойствам относят твердость, определяемую различными методами, в том числе по Бринеллю, Роквеллу, Виккерсу, микротвердость вдавливанием, царапанием. К механическим свойствам, определяемым при растяжении (сжатии, кручении, изгибе) образцов, относят временное сопротивление разрыву (или предел прочности), предел пропорциональности, предел упругости, предел текучести, относительное удлинение и относительное сужение. Характеристика, определяемая при многократных знакопеременных нагрузках при растяжении–сжатии, кручении и изгибе, – предел выносливости. Важной характеристикой, определяемой при динамическом нагружении изгибом, является ударная вязкость. К механическим характеристикам относят также жаропрочность, износостойкость и другие, которые находятся по специальным методикам.
Материаловедение. Учеб. пособие |
-36- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
Химические свойства. Химический состав материалов определяет их строение, в том числе фазовый состав, структуру и их свойства. В связи с этим различают сплавы на основе железа: стали и чугуны, сплавы на основе алюминия: силумины, дуралюмины, сплавы на основе меди: латуни, бронзы, медно-никелевые сплавы.
При дальнейшем изучении курса мы познакомимся с классификацией сталей и сплавов; стали могут быть углеродистые и легированные, например, хромистые, хромоникелевые, хромоникельмолибденовые и др. Наличие примесей в стали или сплаве резко изменяет свойства сплавов, поэтому количество примесей строго ограничивается. Особенно вредны примеси серы и фосфора, в связи с этим различают стали обыкновенного качества, качественные, высококачественные и особовысококачественные. Металлы могут быть химически чистыми, технически чистыми, что определяется содержанием примесей.
Химический состав металлов и сплавов строго регламентируется требованиями государственных стандартов, которые являются обязательными для заводов-изготовителей этих материалов. В последнее время, в связи с интеграционными процессами, большое количество материалов у нас в стране изготавливается для поставок на экспорт, что требует оценки их химического состава и свойств согласно требованиям зарубежных стандартов.
Каждому материалу по государственным стандартам присваиваются марки, используя которые, можно всегда определить их химический состав. Например, алюминий технический различной степени чистоты обозначается А5; А7; А8; А9; А99; А999, что отвечает содержанию примесей не более (со-
ответственно) 0,5 %; 0,3 %; 0,2 %; 0,1 %; 0,01 %; 0,001 %.
Стали марок 10, 15, 20, 30, 40, 45 и т.д. соответствуют среднему содер-
жанию углерода в сталях 0,1 %, 0,15 %; 0,2 %; 0,3 %; 0,4 %; 0,4 5% и т.д.
Марки не всегда определяют химический состав стали или сплава, а бывают просто условными обозначениями, например, сталь марки Ст3. Здесь цифра 3 – условный номер. Марки алюминиевых сплавов: АД31; Д16; АК6. Здесь цифры – номер сплава по ГОСТу. То же в титановых сплавах: ВТ3; ВТ5; ВТ6;
ВТ22; ВТ14.
Определение химического состава сплавов производится чисто химиче-
скими методами – аналитической химии, а также методами физикохимического анализа: спектрального, рентгеноспектрального, спектральнофлюоресцентного, атомно-абсорбционного и др. Методы микрорентгеноспектрального анализа позволяют определять не только средний химический состав материала, но и содержание компонентов в каждой частице структуры сплава, что очень важно для гетерогенных материалов, в том числе композиционных. Распределение элементов в материале может быть определено радиометрическим методом, так называемым методом «меченых атомов», с применением радиоактивных изотопов.
Способность к взаимодействию с кислотами и щелочами – это еще одно химическое свойство материалов, которое широко используется в технологиях получения микросхем на полупроводниковых приборах, методах
Материаловедение. Учеб. пособие |
-37- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
электрохимической обработки поверхности, а также для выявления структуры материалов при металлографическом травлении.
Коррозионная стойкость материала характеризует устойчивость ма-
териала в условиях эксплуатации при воздействии внешней агрессивной среды: атмосферного воздуха, влаги, морской воды, газов, температуры и др. Высокая коррозионная стойкость обусловлена химическим составом сплава, его структурой, что в свою очередь достигается способом и режимами термической обработки. Коррозионная стойкость является одним из важнейших химических и эксплуатационных свойств материалов, и ее повышение становится одной из главных задач при создании новых сплавов, материалов и покрытий.
Коррозия − процесс самопроизвольного разрушения материалов в результате химического, физико-химического и электрохимического воздействия. По механизму взаимодействия со средой различают коррозию химическую и электрохимическую. По виду агрессивной среды коррозию делят на газовую, атмосферную, в растворах электролитов, подземную и коррозию в жидкостях-неэлектролитах.
По характеру изменения поверхности металла или его физикохимических свойств различают общую (сплошную), местную и избирательную коррозию. Избирательной коррозии подвержены сплавы, содержащие несколько структурных составляющих − структурно-избирательная корро-
зия, и сплавы типа твердых растворов − компонентно-избирательная корро-
зия. Сплошная коррозия делится на равномерную и неравномерную, а местная коррозия может быть точечной, подповерхностной, межкристаллитной,
ножевой, в виде пятен, язв. Наиболее опасный вид местной коррозии − межкристаллитная коррозия, которая распространяется по границам зерен. Местная коррозия более опасна, чем сплошная, т. к. может привести к нарушению герметичности в локальном месте и к разрушению.
При воздействии рабочих напряжений в конструкциях может развиться опасный вид разрушения − коррозионное растрескивание или коррозия под напряжением. При коррозионном растрескивании под воздействием напряжения могут возникать транскристаллитное (по объему кристалла) и межкристаллитное (по границам кристаллов) разрушения. Коррозионное растрескивание под напряжением характеризуется хрупкими изломами. Проблему коррозионного растрескивания можно решить проведением термической обработки − отжигом для снятия внутренних напряжений или созданием в поверхностной зоне материала напряжений сжатия при поверхностном наклепе (упрочнение при деформации).
Химическая коррозия − процесс разрушения материалов под воздействием жидкостей-неэлектролитов и газовой высокотемпературной среды. Защиту конструкций, работающих в среде неэлектропроводящих жидкостей (спирт, бензол, фенол, бензин, расплавленная сера) ведут либо подбором химического состава материала, либо применяя защитные покрытия. Газовая коррозия наблюдается при работе в условиях высоких температур, она опас-
Материаловедение. Учеб. пособие |
-38- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
на для термического нагревательного оборудования, оборудования для горячей деформации и литья. Газовая коррозия − это прежде всего окислительные процессы, т.е. взаимодействие с кислородом среды. В свою очередь образующаяся на поверхности материала плотная оксидная пленка может защитить металл от дальнейшего окисления. Основной метод защиты от газовой коррозии − использование жаростойких сталей и сплавов и защита поверхности материала специальными жаростойкими покрытиями, получаемыми при диффузионном насыщении алюминием, хромом, кремнием, либо металлокерамическими покрытиями.
Электрохимическая коррозия возникает при контакте металлов с электролитами, чаще всего во влажной среде через электродные реакции. При нахождении металла в растворе электролита между поверхностью металла и электролитом возникает разность потенциалов, величина которого оказывает большое влияние на характер коррозионного процесса. Разность потенциалов возникает при образовании двойного электрического слоя заряженных частиц на границе раздела фаз металл − электролит, что и вызывает появление некоторой разницы потенциалов между металлом и раствором электролита. Электродный потенциал определяет термодинамическую устойчивость металлов к коррозии. Каждая электродная реакция имеет свой стандартный потенциал (φ°). Если расположить электродные реакции в соответствии со значениями стандартных потенциалов, то получится электрохимический ряд напряжений металлов:
Li Rb K Ba Sr Ca Na Mg Al Mn Zn Cr Fe Cd Co Ni Sn Pb H2 Sb Cu Hg Ag Pt Au
Электрохимический ряд напряжений металлов, который применим только для чистых (неокисленных) металлических поверхностей, представляет собой закономерное расположение металлов относительно стандартного электродного потенциала водорода, который принят за ноль. Слева от Н2 располагаются металлы с отрицательными значениями стандартного электродного потенциала, справа − с положительными. Металл, которому соответствует относительно высокий стандартный потенциал, например, серебро (φ° = +0,80), называется благородным металлом. Металл, которому соответствует низкий стандартный потенциал, например магний (φ° = −2,38), называется неблагородным металлом. Таким образом, более электроотрицательные металлы обладают большей склонностью к электрохимической коррозии.
Определение коррозионной стойкости чаще всего производят в условиях, близких к условиям эксплуатации реальных изделий. Коррозионную стойкость металлов можно оценить количественно по изменению массы металла при коррозии, отнесенной к единице времени или единице поверхности; по объему выделяющегося или поглощаемого при коррозии газа, отнесенного к единице времени или единице поверхности; по уменьшению тол-
Материаловедение. Учеб. пособие |
-39- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
щины образца металла, отнесенной к единице времени (мм/год); по плотности коррозионного тока.
Важнейшими характеристиками коррозионной стойкости являются сопротивление общей коррозии, склонность к межзеренному разрушению (межкристаллитная коррозия), склонность к коррозии под напряжением, жаростойкость, окалиностойкость и др.
Физические свойства. Плотность вещества характеризует массу в единице объема и измеряется в кг/м3 (г/см3). Плотность зависит от строения и массы атома, от упаковки атомов в кристаллической решетке вещества и может изменяться при наличии в металле микро- и макродефектов. Следовательно, это свойство может быть использовано для определения количества входящих в состав материала элементов, если известны эти элементы. Кроме того, при известном и постоянном химическом составе материала определение плотности может дать информацию о количестве дефектов в реальном изделии (макро- и микропор, точечных дефектов – вакансий).
Теоретическую плотность материала находят расчетным путем. Реальная плотность материала определяется экспериментально и может быть рассчитана после прямого взвешивания образца и точного измерения его размеров. Основным наиболее точным методом определения плотности, не зависимым от формы исследуемого образца, является метод гидростатического взвешивания в соответствии с законом Архимеда: «На тело, погруженное в жидкость, действует выталкивающая сила, равная весу жидкости, вытесненной телом». Метод реализуется двукратным взвешиванием: на воздухе и жидкости (воде, спирте) с точной известной плотностью при контролируемой температуре с последующим расчетом.
Изменение объема и линейных размеров тела с ростом температуры вызывает изменение плотности и учитывается через характеристику коэффициента линейного и объемного теплового расширения. Коэффициент линейного теплового расширения α измеряется в °С-1 и является самостоятельной характеристикой физических свойств материалов. Например, для алюминия средний температурный коэффициент линейного расширения от 20 до 100 °С равен 23,8 ·106 °С-1, для меди – 6,8·106 °С-1. Коэффициент линейного расширения характеризует способность материала к изменению размеров при изменении температуры.
Электропроводность и электросопротивление – это структурночувствительные свойства материалов. Удельное электросопротивление ρ измеряется в мкОм·см, например, удельное электросопротивление сплава на основе никеля, константана, равно 0,46 мкОм·м, меди – 0,0172 мкОм·м. Удельная электропроводность γ (удельная проводимость) – величина обрат-
ная удельному электросопротивлению 1/ρ, она измеряется в Ом-1·см-1, мкОм-
1·см-1.
Электрические свойства зависят от типа металла – основы сплава, от соотношения компонентов в материале, от размеров частиц рассматриваемого материала, от концентрации компонентов в фазах. Измерения электропроводности и электросопротивления дают информацию о структуре сплавов, о
Материаловедение. Учеб. пособие |
-40- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
развивающихся при технологических переделах процессах перестройки кристаллической решетки, об изменении количества (соотношения) фаз в сплавах при нагревах и охлаждениях.
Кроме того, электросопротивление и электропроводность для электротехнических материалов являются важнейшими эксплуатационными свойствами и, следовательно, могут использоваться в качестве контрольных характеристик, оценивающих качество изделий после их получения согласно тем или иным технологическим процессам получения изделий.
Заданные магнитные свойства материалов могут являться конечной целью определения магнитных характеристик для деталей типа постоянных магнитов, трансформаторной и динамной стали.
Магнитные свойства определяются в результате анализа так называемой «петли магнитного гистерезиса». Основными характеристиками магнитных свойств является W – удельная магнитная энергия (Дж/м3), Вr – остаточная индукция магнитного поля, Тл, Нс – коэрцитивная сила (А/м), µн – относительная магнитная проницаемость и др.
Магнитные свойства часто коррелируют с изменением механических характеристик обрабатываемых материалов, поэтому их используют для создания неразрушающих методов контроля качества стальных изделий и других ферромагнитных материалов.
Теплофизические свойства. Основными теплофизическими свойствами конструкционных материалов, являются теплоемкость и теплопроводность веществ. Удельная теплоемкость ср измеряется в Дж/(кг·°С), удельная теплопроводность λ – в Вт/(м·°С). Эти характеристики важны для анализа процессов нагрева и охлаждения в различных условиях получения изделий и в процессах эксплуатации. Их значения зависят от температуры, они определяются прямыми температурными измерениями в условиях выполнения экспериментов с использованием специальных теплообменных устройств и расчетов на основе классических законов термодинамики. Например, теплоемкость алюминиевого сплава АМг6 при температуре 100 °С равна 922 Дж/(кг·°С), а теплопроводность – 122 Вт/(м ·°С). Известные результаты измерений теплоемкости и теплопроводности различных материалов концентрируются в специальных справочных изданиях, которые рекомендуется использовать для любых расчетов, включая процессы теплообмена как внутри рассматриваемого изделия, так и при взаимодействии его поверхности с окружающей технологической средой.
Эксплуатационными называют свойства материала, которые определяют работоспособность деталей машин, приборов или инструментов и их технико-эксплуатационные показатели.
Работоспособность подавляющего большинства деталей машин и изделий обеспечивает уровень механических свойств. Механические свойства характеризуют поведение материала под действием внешней нагрузки. Так как условия нагружения деталей машин чрезвычайно разнообразны, то механические свойства включают большую группу показателей. Работоспособность отдельной группы деталей машин зависит не только от механических
Материаловедение. Учеб. пособие |
-41- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
свойств, но и от сопротивления воздействию химически активной рабочей среды. Если такое воздействие становится значительным, то определяющими становятся физико-химические свойства материала – жаростойкость и коррозионная стойкость.
Жаростойкость характеризует способность материала противостоять химической коррозии, развивающейся в атмосфере сухих газов при повышенной температуре. У металлов при нагреве на поверхности образуется оксидный слой (окалина). Количественные показатели жаростойкости: скорость окисления, оценивающая интенсивность изменения массы металла (г/м2·ч), или скорость роста толщины оксидной пленки на поверхности (мкм·ч); допустимая рабочая температура металла, при которой скорость его окисления не превышает заданного значения.
Коррозионная стойкость – это способность металла противостоять, например, электрохимической коррозии, которая развивается при наличии жидкой среды на поверхности металла и ее электрохимической неоднородности. Количественные показатели коррозионной стойкости: скорость электрохимической коррозии, оценивающая интенсивность изменения массы металла (г/м2·ч) или линейных размеров образца (мкм/ч); степень изменения механических свойств под влиянием повреждения поверхности.
Технологические свойства. Изготовление изделий из материалов производится различными способами обработки давлением, литьем, механической обработкой. Для оценки возможности использования различных схем обработки необходимо учитывать технологические свойства материалов. Технологичность оценивается способностью к обрабатыванию резанием, например, отделением стружки при резании, технологической пластичностью при обработке давлением, свариваемостью, жидкотекучестью и усадкой при литье, а также прокаливаемостью, склонностью к деформации и короблению при термической обработке. Технологичность материала имеет важное значение, так как от нее зависит производительность и качество изготовления деталей.
1.6. Механическиесвойстваматериалов
Механические свойства характеризуют способность материала сопротивляться деформации и разрушению под действием приложенных нагрузок.
По характеру изменения во времени действующей нагрузки механические испытания делятся на статические (на растяжение, сжатие, изгиб, кручение); динамические (на ударный изгиб) и циклические (на усталость).
По воздействию температуры на процесс их делят на испытания при комнатной температуры, низкотемпературные и высокотемпературные (на длительную прочность, ползучесть).
Статические испытания проводятся при воздействии на образец с определенной скоростью постоянно действующей нагрузки. Скорость деформации составляет 10-4–10-1 с-1. Статические испытания на растяжение относятся к наиболее распространенным. Свойства, определяемые при этих испы-
Материаловедение. Учеб. пособие |
-42- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
таниях, приведены в многочисленных стандартах по техническим условиям на материалы. К статическим испытаниям относятся: растяжение, сжатие, изгиб, кручение.
Динамические испытания характеризуются приложением к образцу ударной нагрузки и значительной скоростью деформации. Длительность испытания не превышает сотен долей секунды. Скорость деформации составляет около 102 с-1. Динамические испытания чаще всего проводят по схеме ударного изгиба образцов с надрезом.
Циклические испытания характеризуются многократными изменениями нагрузки по величине и по направлению. Примером испытаний являются испытания на усталость, они длительны и по их результату определяют число циклов до разрушения при разных значениях напряжения. В конечном итоге находят предельные напряжения, которые образец выдерживает без разрушения в течение определенного числа циклов нагружения.
Простейшим механическим свойством является твердость. Способы определения твердости делятся, в зависимости от скорости приложения нагрузки, на статические и динамические а по способу ее приложения – на методы вдавливания и царапания. Методы определения твердости по Бринеллю, Роквеллу, Виккерсу относятся к статическим методам испытания.
Твердость – это способность материала сопротивляться вдавливанию в него более твердого тела (индентора) под действием внешних сил.
При испытании на твердость в поверхность материалов вдавливают пирамиду, конус или шарик (индентор), в связи с чем различают методы испытаний, соответственно, по Виккерсу, Роквеллу и Бринеллю. Кроме того, существуют менее распространенные методы испытания твердости: метод упругого отскока (по Шору), метод сравнительной твердости (Польди) и некоторые другие.
При испытании материалов на твердость не изготавливают стандартных специальных образцов, однако к размерам, поверхности образцов и изделий предъявляются определенные требования.
Твердость по Виккерсу (ГОСТ 2999-75) определяют путем вдавливания в металл индентора алмазной пирамиды с углом при вершине 136° под действием постоянной нагрузки (Р): 1; 2; 2,5; 3; 5; 10; 20; 30; 50 или 100 кгс и выдержки под нагрузкой 10–15 с. Для определения твердости черных металлов и сплавов используют нагрузки от 5 до 100 кгс, медных сплавов – от 2,5 до 50 кгс, алюминиевых сплавов – от 1 до 100 кгс. После снятия нагрузки определяют длину диагонали отпечатка с помощью микроскопа прибора а твердость HV рассчитывают по формуле
HV =1,854 dP2 ,
где Р – нагрузка, кгс; d – диагональ отпечатка, мм.
В стандарте на испытание имеется таблица зависимости твердости от величины нагрузки и длины диагонали. Поэтому на практике расчетов не производят, а пользуются готовой расчетной таблицей. Твердость по Виккер-
Материаловедение. Учеб. пособие |
-43- |
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
су HV измеряется в кгс/мм2, Н/мм2 или в МПа. Значение твердости по Виккерсу может изменяться от HV 2060 до HV 5 при нагрузке 1 кгс.
По методу Бринелля вдавливают в образец или изделие стальной закаленный шарик диаметром 10, 5 или 2,5 мм под действием нагрузок 3 000, 1 000, 750, 500, 250, 62,5 кгс и других (ГОСТ 9012-59). Схема определения твердости по Бринеллю показана на рис. 1.20. Полученный круглый отпечаток на образце измеряют лупой и по таблицам находят величину твердости по Бринеллю, значение которой не превышает 450 НВ. Твердость по Бринеллю почти совпадает со значениями твердости по Виккерсу.
Твердость НВ – это также величина напряжений сопротивления вдавливанию, т.е. физическая величина:
HB = |
P |
= |
P |
= |
|
2P |
|
|
|
|
, |
|
πDt |
πD(D − |
|
|
|
|
) |
||||
|
Fot |
|
D |
2 |
−d |
2 |
|
||||
|
|
|
|
|
|
|
|
||||
где Р – нагрузка, кгс; D – диаметр шарика, мм; t – глубина сегмента отпечатка; d – диаметр отпечатка, мм.
Рис. 1.20. Схема определения твердости по Бринеллю
Твердость по Бринеллю НВ (по умолчанию) имеет размерность кгс/мм2, например, твердость алюминиевого сплава равна 70 НВ. При нагрузке, определяемой в ньютонах, твердость по Бринеллю измеряется в МПа. Например, твердость отожженной стали равна 207 НВ при нагрузке 3 000 кгс, диаметре шарика 10 мм, диаметре отпечатка 4,2 мм или, учитывая коэффициент перевода: 1 ньютон = 9,8 кгс, НВ = 2028 МПа.
По методу Роквелла (ГОСТ 9013-59) вдавливают алмазный конус с углом при вершине 120о (шкалы А и С) или стальной шарик диаметром 1,5875 мм (шкала В). При этом определяют твердость, соответственно, HRA, HRC и HRB. В настоящее время измерение твердости по методу Роквелла является наиболее распространенным методом, потому что при использовании твердомеров Роквелла не требуется измерять отпечаток, число твердости считывается со шкалы прибора сразу после снятия основной нагрузки.
Метод заключается во вдавливании в испытуемый образец индентора под действием двух последовательно прикладываемых нагрузок – предвари-
Материаловедение. Учеб. пособие |
-44- |
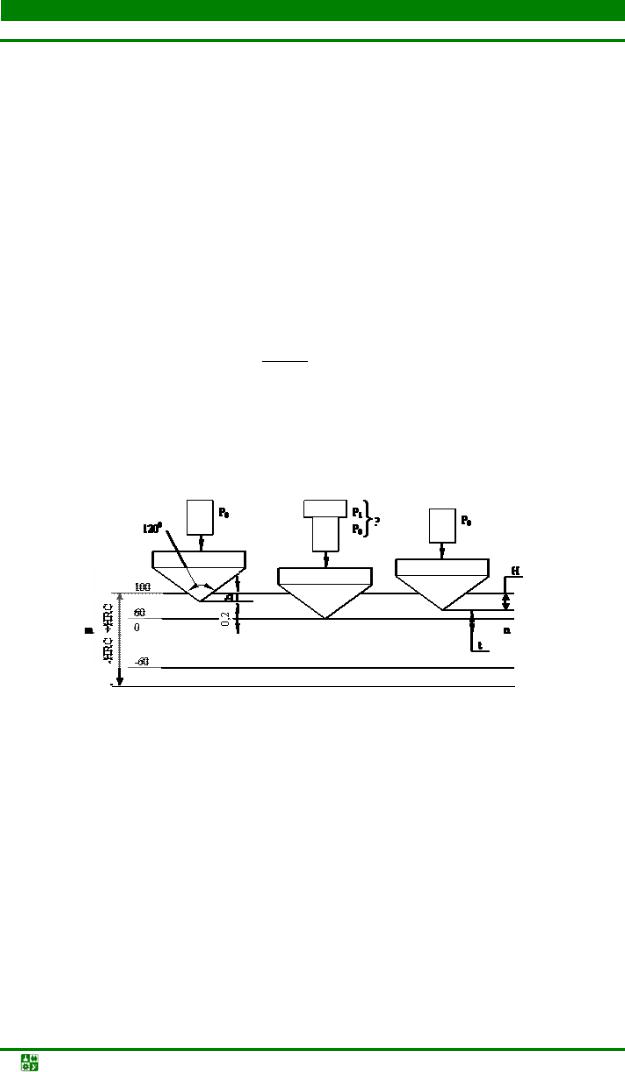
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
тельной Р0 и основной P1, которая добавляется к предварительной, так что общая нагрузка Р = Р0 + Р1. После выдержки в течение нескольких секунд основную нагрузку снимают и измеряют остаточную глубину проникновения индентора, который при этом продолжает находиться под действием предварительной нагрузки. Перемещение основной стрелки индикатора на одно деление шкалы соответствует перемещению индентора на 0,002 мм, которое принимается за единицу твердости.
На рис. 1.21 представлена схема измерения твердости по методу Роквелла алмазным или твердосплавным конусом. При испытаниях измеряют глубину восстановленного отпечатка. Шкалы А и С между собой совпадают, поскольку испытания проводят одним и тем же индентором – алмазным конусом, но при разных нагрузках: 60 и 150 кгс соответственно. Твердость в этом случае определяется как
HRC = 0,002t =100 − 0,002H −h .
По шкале В (нагрузка 100 кгс, шарик) HRB =130 − 0,002H −h .
Рис. 1.21. Схема определения твердости по Роквеллу (индентор – конус)
На практике значения твердости по Роквеллу не рассчитываются по формулам, а считываются с соответствующей (черной или красной) шкалы прибора. Шкалы HRC и HRA используются для высокой твердости, HRB – для низкой. Число твердости по Роквеллу измеряют в условных единицах, оно является мерой глубины вдавливания индентора под определенной нагрузкой.
Механические свойства металлов при растяжении. Испытание на растяжение материалов проводят в соответствии с ГОСТ 1497-84 «Методы испытаний на растяжение». Стандарт устанавливает методы статических испытаний на растяжение черных и цветных металлов для определения при температуре 20 °С пределов пропорциональности, упругости, текучести,
Материаловедение. Учеб. пособие |
-45- |
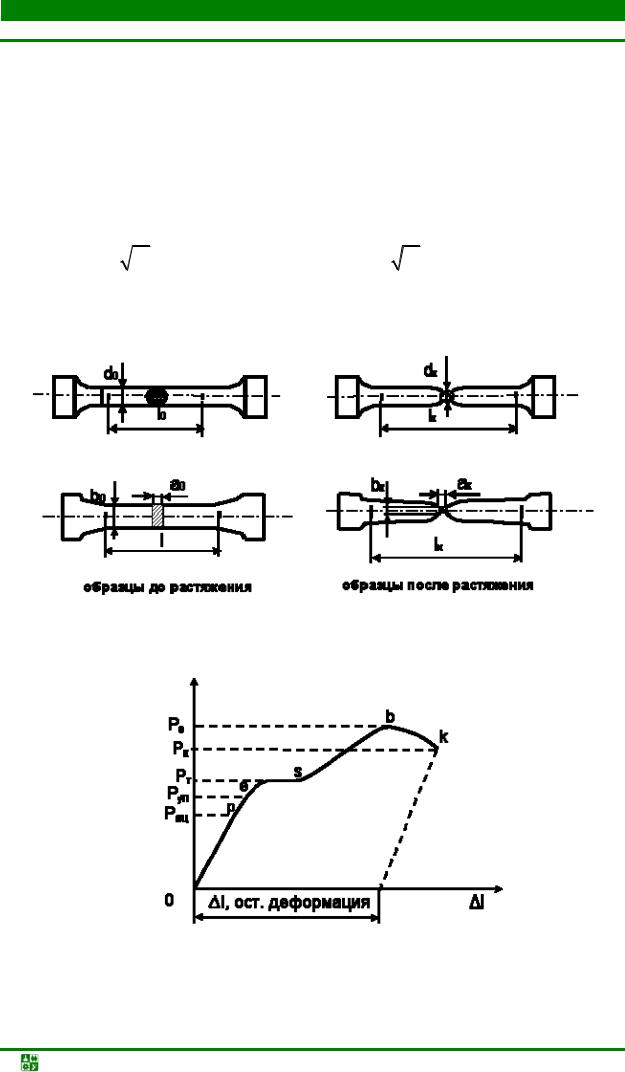
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
временного сопротивления разрыву, относительного удлинения и относительного сужения, модуля упругости.
Для испытаний применяют плоские и цилиндрические образцы, вырезанные из детали или специально изготовленные. Размеры образцов регламентированы указанным стандартом, они подчиняются геометрическому подобию и могут быть короткими и длинными. Для цилиндрического образца берется соотношение начальной рабочей длины l0 и исходного диаметра d0: l0 = 5d0 – короткий образец, l0 = 10d0 – длинный образец. Для плоского образца берется соотношение рабочей длины l0 и площади поперечного сечения
F0: l0 = 5,65 F0 – короткий образец, l0 = 11,3 F0 – длинный образец. Ци-
линдрические образцы изготавливаются диаметром 3 мм и более. Образцы состоят из рабочей части длиной l0, и головок, форма и размер которых соответствует захватам машины (рис. 1.22).
0
До растяжения |
После растяжения |
|
|
Рис. 1.22. Цилиндрические и плоские образцы до и после испытания на растяжение
P
Рис. 1.23. Первичная диаграмма растяжения
Материаловедение. Учеб. пособие |
-46- |
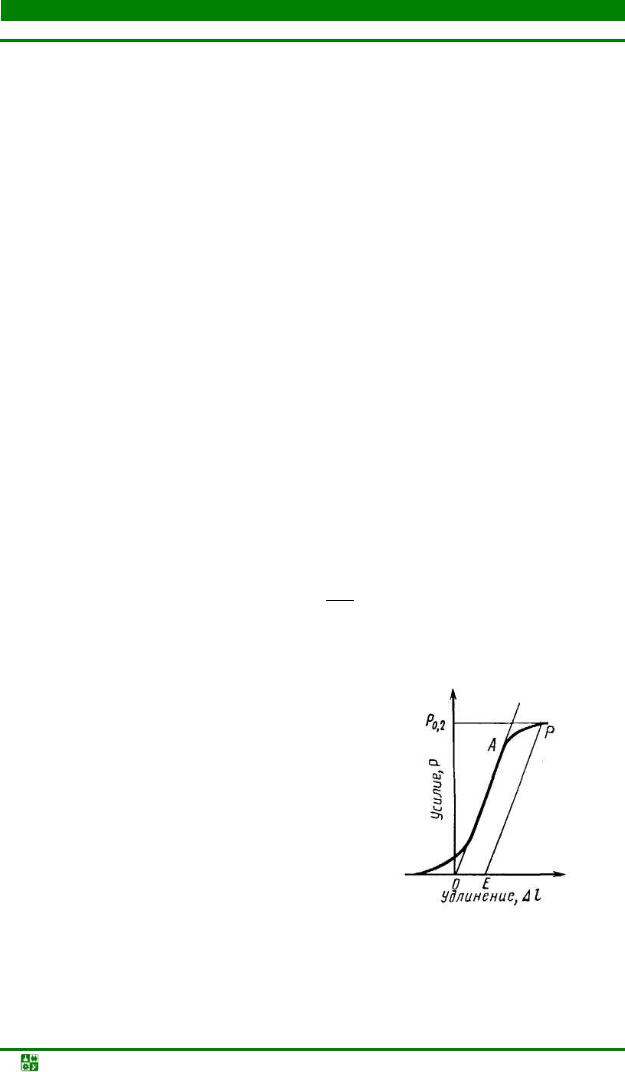
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
Растяжение образца проводят на специальных машинах, фиксирующих величину прилагаемой нагрузки и изменение длины образца при растяжении. Эти же машины позволяют записывать изменение длины образца при увеличении нагрузки (рис. 1.23), т.е. первичную диаграмму испытания на растяжение в координатах: нагрузка (Р), в Н, кН и абсолютное удлинение образца l в мм.
Измеряя величину нагрузки в характерных точках диаграммы испытаний на растяжение (рис. 1.23), определяют следующие характеристики механических свойств материалов:
σпц – предел пропорциональности, точка р; σ0,05 – предел упругости, точка е;
σт – предел текучести физический, точка s; σ0,2 – предел текучести условный;
σв – временное сопротивление разрыву или предел прочности, точка b. Значения 0,05 и 0,2 в записи предела упругости и текучести соответствуют величине остаточной деформации l в процентах от l0 при растяжении образца. Напряжения при испытании на растяжение определяют путем деления нагрузки Р, соответствующей характерной точке на диаграмме, на площадь первоначального поперечного сечения F0 рабочей части испытуемого
образца:
σ |
пц |
= |
Pпц |
; σ |
0,05 |
= |
P0,05 |
; σ |
т |
= |
Pт |
; σ |
в |
= |
Pв |
или σ |
в |
= |
Pmax |
. |
|
F |
|||||||||||||||||||
|
|
F |
|
|
|
F |
|
|
F |
|
|
F |
||||||||
|
|
|
0 |
|
|
|
0 |
|
|
|
0 |
|
|
|
0 |
|
|
|
0 |
|
Площадь поперечного сечение F0 определяется следующим образом:
πd2
для цилиндрического образца F0 = 0 ,
4
для плоского образца F0 = a0 ×b0 , где a0 – первоначальная толщина, а b0
– первоначальная ширина образца. В точке k определяют напряжение сопротивления разрушению материала.
Предел пропорциональности и предел упругости определяют с помощью тензометра (прибор для определения величины деформации). Предел текучести физический и условный рассчитывают, определяя нагрузку по диаграмме растяжения. Если на диаграмме нет площадки текучести, то для вычисления условного предела текучести необходимо провести графические построения на диаграмме
(рис. 1.24). Вначале находят величину остаточной деформации, равную 0,2 % от Рис. 1.24. Определение предела
l0, далее отмечают отрезок на оси дефор-
текучести
мации, равный 0,2 % от l0, и проводят линию, параллельную пропорциональному участку диаграммы растяжения до пересечения с кривой растяже-
Материаловедение. Учеб. пособие |
-47- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
ния. Нагрузка Р0,2 соответствует точке их пересечения. Физический или условный предел текучести характеризует способность материала к началу пластической деформации, т.е. сопротивление малой пластической деформации.
Предел прочности можно подсчитать, используя показание силоизмерителя, по максимальной нагрузке Pmax при разрыве; либо найти Pmax (Pв) по первичной диаграмме растяжения. Характер деформации при растяжении вязких и хрупких материалов существенно различается.
Хрупкие материалы после достижения максимальной нагрузки быстро разрушаются без значительной пластической деформации, поэтому σв для хрупких материалов является характеристикой сопротивления разрушению, а для пластичных – характеристикой сопротивления деформации.
Напряжение разрушения определяют как истинное. При этом нагрузку разрушения делят на конечную площадь поперечного сечения образца после разрушения (Fк):
Sк = Pк . Fк
Все рассчитанные таким образом величины являются характеристиками прочности материала.
Пластичность, т.е. способность деформироваться без разрушения, характеризуется изменениями размеров образца. При испытании на разрыв определяют характеристики пластичности: относительное удлинение
δ = lк − l0 100 % l0
и относительное сужение
Ψ = F0 − Fк 100 % , F0
где lк и Fк – соответственно, длина рабочей части и площадь поперечного сечения образца после разрыва.
Рассчитанные характеристики механических свойств после испытания на растяжение заносят в протокол.
Механические свойства металлов при сжатии. Для хрупких мате-
риалов с низким сопротивлением разрыву проводят испытание на сжатие по ГОСТ 25.503-97. Для испытания используют цилиндрические образцы с гладкими торцами и торцовыми выточками.
При сжатии находят следующие характеристики сопротивления деформации: предел пропорциональности σпрсж, предел упругости σ0,05сж, физический предел текучести σтсж, условный предел текучести σ0,2сж, предел прочности σвсж . Напряжения рассчитываются как отношение соответствующей нагрузки к площади сечения образца до деформации. Предел прочности можно рассчитать без записи диаграммы сжатия, для остальных расчетов необходима первичная диаграмма испытания.
Материаловедение. Учеб. пособие |
-48- |
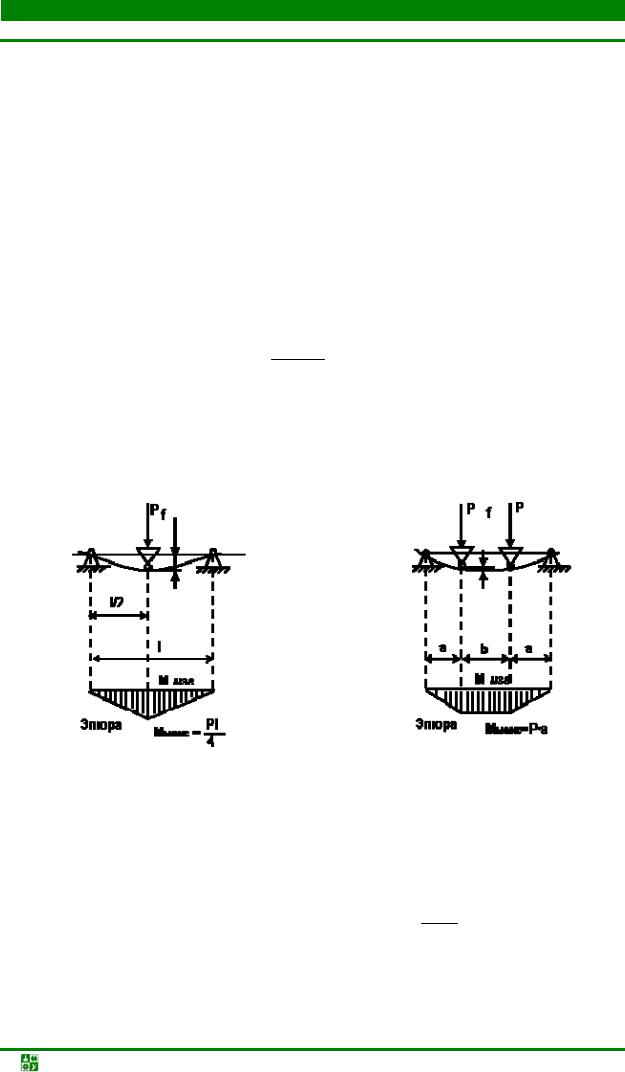
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
Диаграмма сжатия пластичных образцов отличается от диаграммы хрупких образцов. Высокопластичные материалы не удается разрушить при сжатии, и они сплющиваются. Поэтому временное сопротивление сжатию пластичных образцов можно определить лишь условно, т.к. после участка упрочнения происходит быстрое нарастание сплющивания образца. Хрупкие материалы разрушаются при незначительных деформациях и предел прочности находят по отношению максимальной нагрузки к первоначальной площади сечения образца. У хрупких материалов, например чугуна, сопротивление сжатию выше, чем сопротивление растяжению. Многие хрупкие материалы при сжатии разрушаются вследствие среза или скалывания по плоскостям под углом 45° к оси образца.
К характеристике пластичности при сжатии относят ε – относительное укорочение образца:
ε = h0 − hк 100 % , h0
где h0, hк – начальная и конечная высота образца.
Испытания на изгиб. Испытание на изгиб проводят по ГОСТ 14019-80 по двум схемам: сосредоточенной нагрузкой, приложенной в середине пролета, и при чистом изгибе (рис. 1.25).
Сосредоточенный |
Чистый |
|
|
а |
б |
Рис. 1.25. Схема изгиба сосредоточенной силой (а)
идвумя симметричными нагрузками (б)
Врезультате испытания находят предел пропорциональности, предел упругости, предел текучести с точным замером величины деформации. Пре-
дел прочности при изгибе рассчитывают σизг: σизг = Мизг , где Мизг – наиболь-
W
ший изгибающий момент, равный при первой схеме нагружения Мизг = Рl/4, а по второй схеме – Мизг = Ра; W – момент сопротивления, характеристика по-
Материаловедение. Учеб. пособие |
-49- |
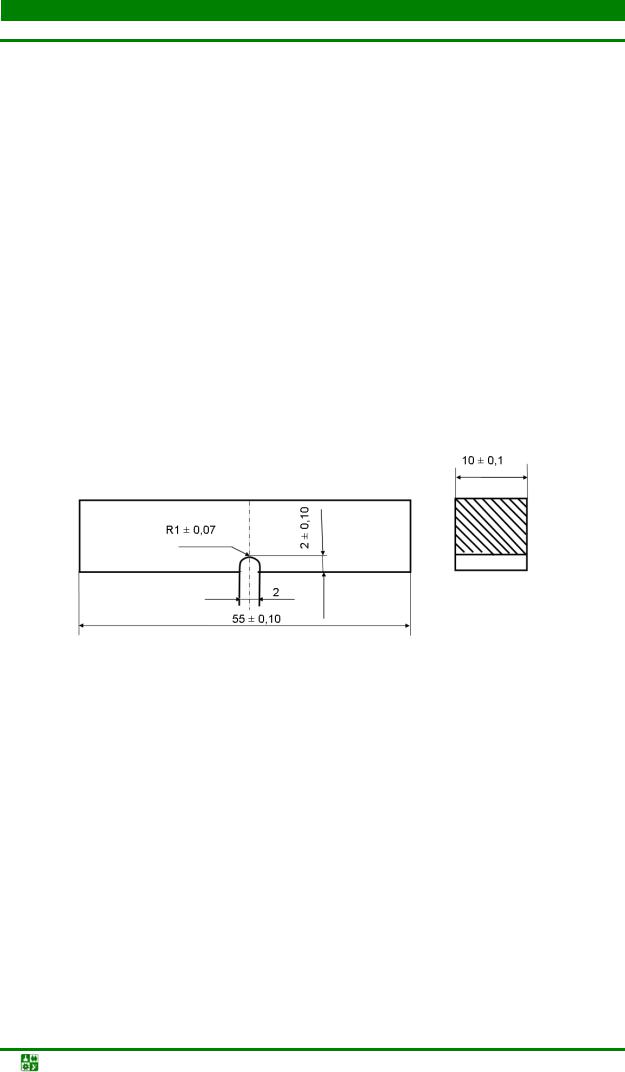
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
перечного сечения бруса, для образцов круглого сечения W = π d3/32; для образцов прямоугольного сечения W = bh2/6, где h – высота бруса.
Пластичность характеризует fразр (величина прогиба), деформация, которая зависит от материала, длины образца, момента инерции и т.д.
Динамические испытания. Испытания на ударный изгиб. Важной характеристикой механических свойств является ударная вязкость, характеризующая удельную работу, затрачиваемую на разрушение при ударе образца с надрезом. Ударная вязкость определяется при испытании на маятниковом копре с постоянным запасом работы маятника по ГОСТ 9454-78 «Метод испытания на ударный изгиб при пониженной, комнатной и повышенной температурах». Стандарт распространяется на черные и цветные металлы и сплавы и устанавливает метод испытания от –100 до +1 000 °С. Метод основан на разрушении ударом маятникового копра образца с концентратором напряжений. В результате испытания определяют полную работу, затраченную при ударе К или ударную вязкость КС.
Используют образцы прямоугольной формы с концентратором типа U, V, T (усталостная трещина). Наиболее распространенными образцами являются образцы размерами 55×10×10 мм с U концентратом 2×2 мм (рис. 1.26).
Рис. 1.26. Стандартный образец с U-образным надрезом для испытаний на ударный изгиб
На разрушение ударом образца затрачивается только часть энергии маятника, в связи с чем маятник после разрушения образца продолжает двигаться, отклоняясь на определенный угол. Чем больше величина работы, затрачиваемой на разрушение образца, тем на меньший угол он отклоняется от вертикали после разрушения. Величиной этого угла и определяют работу удара К или работу, затраченную на разрушение образца. Работу разрушения K относят к площади поперечного сечения образца S0 в месте излома, и
тем самым определяют KC – ударную вязкость: КС = К/S0, где К измеряется в Дж (кгс·м), S0 в м2 (см2).
В зависимости от вида концентратора ударная вязкость обозначается KCU, KCV, KCT и имеет размерность МДж/м2 (МДж/см2) или кгс·м/см2.
Материаловедение. Учеб. пособие |
-50- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 1. Строение, свойства и методы исследования металлов и сплавов
Контрольныевопросыизадания
1.Какие типы кристаллических решеток характерны для чистых ме-
таллов?
2.Изобразите решетки кристаллов ОЦК, ГЦК, ГПУ, укажите их координационное число и плотность упаковки.
3.Какие типы связей характерны для металлов Al, Cu, Fe; полуметаллов Bi, Si и неметаллических материалов?
4.Опишите типичные признаки металлического состояния.
5.Какие дефекты кристаллического строения присутствуют в реальных кристаллах?
6.Опишите строение пластмасс и других неметаллических материалов.
7.Охарактеризуйте основные методы исследования материалов.
8.В чем заключается макроанализ материалов?
9.Что можно определить при исследовании микроструктуры?
10.Как приготовить объекты исследования для макро- и микроанализа?
11.Опишите преимущества электронной микроскопии при исследовании материалов.
11.Какие задачи можно решать, применяя рентгеновские методы анализа для изучения материалов?
12.Какие требования предъявляют к выбору материала при изготовлении изделий?
13.Опишите химические свойства материалов.
14.Какие виды коррозии возможны в материалах при их эксплуатации в агрессивных средах?
15.Опишите физические и теплофизические свойства материалов.
16.Охарактеризуйте механические свойства материалов.
17.Как определяют твердость по Бринеллю, Роквеллу и Виккерсу?
18.Запишите единицы измерения твердости по Бринеллю, Роквеллу и
Виккерсу.
19.Какие методы испытаний механических свойств относят к статическим, динамическим и циклическим?
20.Изобразите первичную диаграмму растяжения для пластичного
материала.
21.Как по диаграмме растяжения определить предел прочности и предел текучести?
22.Какие типы образцов используют для нахождения относительного удлинения и относительного сужения?
23.Какие характеристики определяют при испытании на сжатие и на
изгиб?
24.Какиехарактеристикивычисляютприиспытаниинаударныйизгиб?
25.Чем различается ударная вязкость, обозначаемая КСU , КСV,
КСТ?
Материаловедение. Учеб. пособие |
-51- |
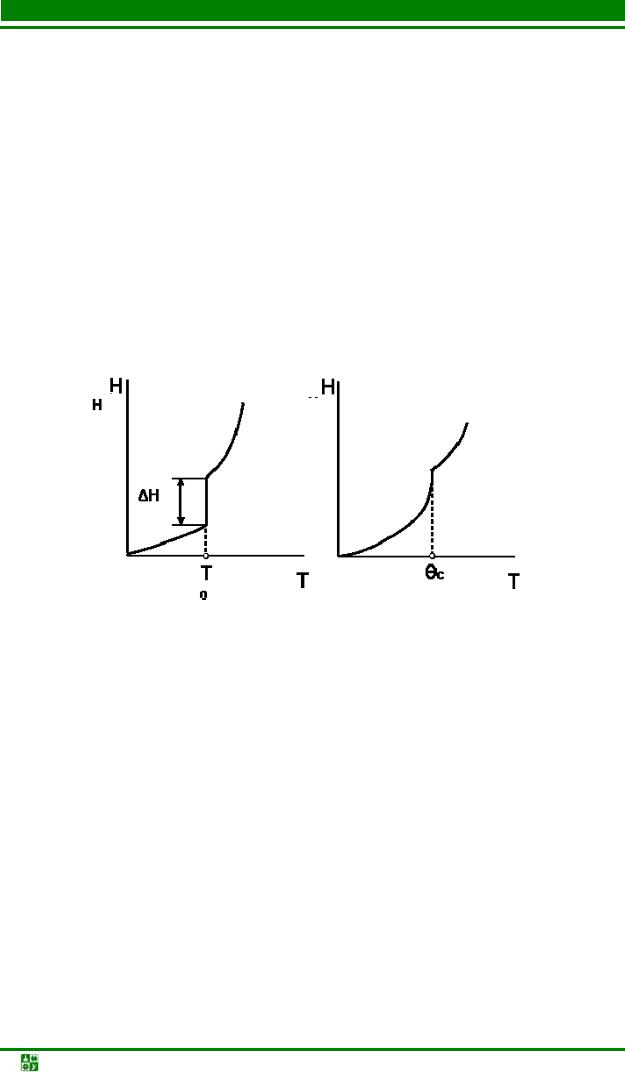
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава2. Кристаллизацияметаллов иихфазовыепревращениявтвердомсостоянии
2.1. ФазовыепревращенияI иII рода
Фазовые превращения в металлических материалах подразделяются на превращения первого и второго рода. В чистых металлах при фазовых переходах I рода энтальпия (теплосодержание) Н и удельный объем изменяются скачками при температуре перехода Тп. Разницу в энтальпии двух фаз Н при температуре перехода называют теплотой фазового превращения. К фазовым переходам I рода в металлах относятся плавление, кристаллизация и полиморфные превращения. При фазовых переходах II рода скачкообразного изменения энтальпии и удельного объема в точке перехода не наблюдается
(рис. 2.1).
|
а |
б |
|
Рис. 2.1. Изменение энтальпии от температуры при фазовых превращениях I (а) и II (б) рода
К фазовому переходу II рода в металлах относится магнитное превращение. Происходит переход при нагревании из ферромагнитного состояния в парамагнитное и обратный переход при охлаждении. Температуру превра-
щения в этом случае называют точкой θс Кюри. При переходе через точку Кюри тип кристаллической решетки не меняется. Выше температуры Кюри у парамагнетика в отсутствие внешнего магнитного поля собственные магнитные моменты атомов имеют хаотичную пространственную ориентацию. Переход через точку Кюри во время охлаждения означает возникновение в кристалле ферромагнитных доменов – областей самопроизвольной намагниченности, внутри которых и при отсутствии внешнего магнитного поля собственные магнитные моменты атомов имеют одинаковую пространственную ориентацию (благодаря действию сил обменного взаимодействия квантовой природы). При нагревании ферромагнетика усиливающееся тепловое движение атомов постепенно размывает магнитный порядок (взаимную параллель-
Материаловедение. Учеб. пособие |
-52- |
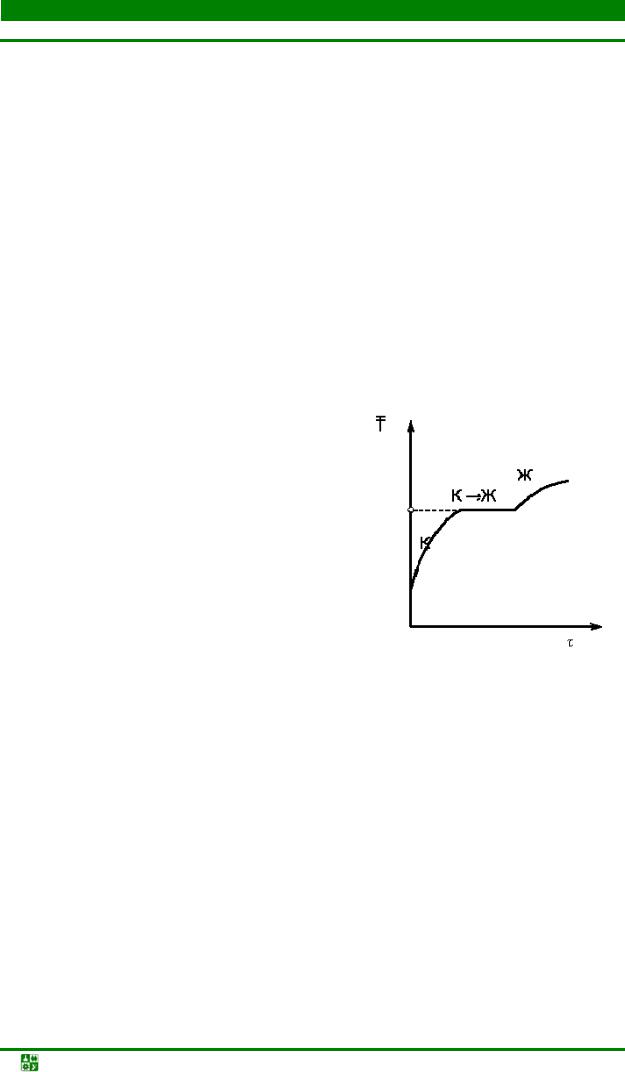
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
ность магнитных моментов атомов), и в точке Кюри самопроизвольная намагниченность исчезает: ферромагнетик становится парамагнетиком. С повышением температуры самопроизвольная намагниченность плавно падает, причем с приближением к точке Кюри это падение усиливается. Рассмотренное магнитное превращение происходит в железе, никеле, кобальте и некоторых редкоземельных металлах. Поскольку магнитное превращение не связано с диффузионными перемещениями атомов, то температура Кюри не зависит от скорости охлаждения (и нагревания), в то время как температура начала кристаллизации и полиморфных превращений могут сильно снижаться с увеличением скорости охлаждения.
2.2. Плавлениечистыхметаллов
Нагрев металлов выше температуры плавления приводит к переходу твердого состояния в жидкое состояние. Теплота нагрева расходуется на раз-
рыв межатомных связей и разрушение |
|
|
кристаллической решетки, поэтому тем- |
|
|
пература определенное время не повыша- |
Т |
|
ется и на кривой нагрева фиксируется |
|
|
|
|
|
площадка при температуре Т0 (рис. 2.2). |
|
|
При плавлении нет перегрева выше |
Т0 |
|
температуры Т0 , что объясняется тем, что |
||
образование зародыша жидкости в виде |
|
|
тонкого участка на поверхности кристалла |
|
|
вместо одной поверхности раздела кри- |
|
|
сталл–газ дает две поверхности раздела: |
|
|
кристалл–жидкость и жидкость–газ. Об- |
|
|
разование двух поверхностей раздела |
|
|
вместо одной энергетически выгодно, т.к. |
Рис. 2.2. Кривая нагревания |
|
удельная энергия поверхности кристалл– |
|
чистого металла |
газ всегда больше, чем удельная энергия |
|
|
поверхности кристалл–жидкость и жидкость–газ, т.е. выполняется условие
γ кр-газ > γ кр-ж + γ ж-г.
Рассмотрим строение жидкого металла. Еще недавно полагали, что в жидком состоянии атомы металла располагаются хаотически. Это приводило к отождествлению жидкого металла с газообразным состоянием.
На основании проведения тонких методов исследования жидких металлов было показано, что строение жидкого металла гораздо ближе к твердому состоянию, чем к газу. В жидком состоянии, как и в твердом металле, наблюдается тенденция к правильному расположению атомов. Каждый атом окружен определенным числом ближайших атомов, зависящих от природы металла и температуры. Однако вследствие интенсивного теплового движения часть атомов теряется данной группой атомов (кластер) и присоединяется к
Материаловедение. Учеб. пособие |
-53- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
другой, причем процесс обмена атомами между группами протекает непрерывно, а ориентация групп атомов в пространстве постоянно изменяется и не подчиняется каким-либо закономерностям.
При плавлении металла происходит заметное увеличение объема (на 2–6 %), как показано в табл. 2.1. Однако этот рост не является следствием только равномерного увеличения междуатомных расстояний. Как указывает Я.И. Френкель, жидкость состоит из областей, которые имеют порядок, относительно близкий к имеющемуся в твердом теле, и расширенных областей, т.е. разрывов или трещинок, которые возникают то здесь, то там и сразу же залечиваются.
Таблица 2.1
Изменение объема при плавлении и координационные числа Z вблизи температуры плавления металлов
Металл |
Fe |
Mg |
Cu |
Zn |
Ni |
Al |
|
|
|
|
|
|
|
|
|
V/Vk, % |
3,0 |
3,1 |
4,15 |
4,2 |
– |
6,0 |
|
|
|
|
|
|
|
|
|
Координационное |
10,6 |
10,9 |
11,3 |
– |
11,6 |
11,5 |
|
число Z |
|||||||
|
|
|
|
|
|
Такое разделение всего объема жидкого металла на группы и геометрически правильное строение внутри них называют термином – ближний порядок. Регулярное расположение атомов во всем объеме металла, присущее твердому телу, называется дальним порядком.
Координационные числа Z жидких металлов вблизи температуры плавления представлены в табл. 2.1. У меди, алюминия и никеля с плотной упаковкой атомов в кристаллическом состоянии (решетка ГЦК) при плавлении Z уменьшается. С ростом температуры расплава Z уменьшается, а ближний прядок постепенно размывается.
Таким образом, при оценке характера состояния дефектов кристаллического строения расплавленных металлов, можно говорить о том, что в жидкости сохраняется только ближний порядок, а дальний порядок наруша-
ется полностью в процессе плавления.
2.3. Термодинамическиеосновыпроцессакристаллизации
Кристаллизация может происходить как при переходе из жидкого состояния в твердое, так и в твердом состоянии при переходе из одной аллотропической формы в другую. Во втором случае такое превращение носит название фазовая перекристаллизация.
Материаловедение. Учеб. пособие |
-54- |
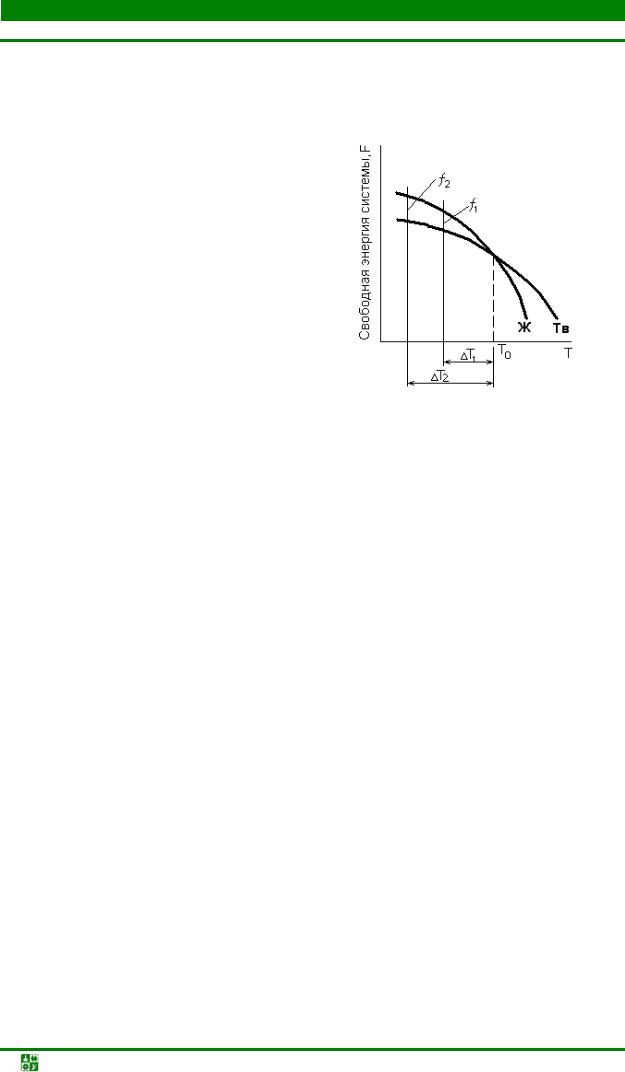
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
Основной причиной и движущей силой процесса кристаллизации является стремление вещества к устойчивому в термодинамическом отношении, состоянию, т.е. к наименьшему запасу свободной энергии (рис. 2.4).
Рис. 2.4. Зависимость изменения свободной энергии системы жидкой и твердой фаз от
температуры
При наличии фазового перехода из твердого в жидкое состояние, и наоборот, эти кривые должны пересекаться. Точка пересечения Т0 соответствует равенству свободных энергий твердой и жидкой фаз, что говорит о возможности сосуществования в металле при данных условиях как твердых, так и жидких фаз. Физический смысл температуры Т0, при которой наблюдается равенство свободных энергий твердой и жидкой фаз, выражается как температура фазового равновесия: плавление–кристаллизация.
При температуре Т1 > Т0 запас свободной энергии жидкой фазы меньше, чем твердой. В этих условиях устойчивой фазой будет жидкость. При понижении температуры ниже Т0 меньшей энергией обладает твердая фаза, которая и становится стабильной в данных условиях.
Изучение кривых охлаждения реальных металлов показывает, что затвердевание начинается не при температуре Т0 , а при ТS < Т0 (рис. 2.5).
Рис. 2.5. Термические кривые затвердевания: а – аморфного вещества; б, в – кристаллического при различных тепловых эффектах кристаллизации
Это объясняется тем, что при образовании новой фазы должна появиться граница между двумя фазами, на что расходуется часть свободной
Материаловедение. Учеб. пособие |
-55- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
энергии системы. В некоторых случаях для образования первых зародышей новой фазы, первых межфазных границ требуются очень значительные затраты энергии, а для образования последующих частиц затраты энергии меньше. В этом случае кривые охлаждения будут иметь вид кривой в. Остановка в понижении температуры связана с выделением при кристаллизации скрытой теплоты превращения.
В некоторых случаях выделение теплоты при кристаллизации настолько велико, что температура поднимается несколько выше температуры ТS. Температура ТS носит название температуры затвердевания, разность температур Т = Т0 – ТS носит название степени переохлаждения.
Необходимость переохлаждения при кристаллизации обусловлена рядом причин. Затвердевание жидкости начинается с образования зародышей очень малых размеров и приводит к образованию межфазной границы между жидкой и твердой фазами. Такая граница на начальном этапе кристаллизации характеризуется очень большой относительной протяженностью по отношению к объему формирующихся кристаллов. Известно, что любая граница является своеобразным дефектом кристаллического строения, а следовательно, обладает более высоким уровнем свободной энергии по сравнению со свободной энергией жидкости и твердой фазы.
Таким образом, образование границы – поверхности раздела требует затраты поверхностной свободной энергии Fоб, которая пропорциональна удельной величине поверхностного натяжения σ на границе раздела фаз и протяженности поверхности твердой частицы S:
S σ = 4πr2 σ.
Поскольку процессы, протекающие с увеличением свободной энергии, не могут происходить самопроизвольно, то при температуре Т0 появление стабильных кристаллов оказывается невозможным.
Наличие флуктуаций энергии, однако, приводит к непрерывному появлению и исчезновению твердой фазы таким образом, что суммарная энергия системы не изменяется и процесс кристаллизации не происходит.
При понижении температуры может происходить уменьшение свободной энергии системы на величину объемной свободной энергии Fоб, пропорциональную удельной энергии превращения и объему твердой частицы:
f V =Δf 43 πr3 . Таким образом, суммарная величина свободной энергии
системы при кристаллизации |
Ф =S σ− |
f V = 4πr2σ− |
f |
4 |
πr3 . Если ана- |
|
|
|
|
3 |
|
лизируют изменение энергии Гиббса при кристаллизации, то результирую-
щее изменение энергии Гиббса G = – Gоб + Gпов или Gоб = – V gоб + Fγ. Если представить кристалл в виде куба с ребром а, то G = – a3 gоб + 6a2γ.
Материаловедение. Учеб. пособие |
-56- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
2.4. Гомогеннаяигетерогеннаякристаллизация, зарождениекристаллов
Процесс кристаллизации состоит из двух стадий: образование центров кристаллизации (зародышей) и рост кристаллов вокруг этих центров.
Первый процесс может идти двумя путями: гомогенным и гетерогенным. Гомогенное зарождение кристаллов связано с флуктуационным образованием зародышей в случайных участках объема чистого расплава металлов. В реальных расплавах такое зародышеобразование происходит крайне редко, так как в них встречаются нерастворимые частицы (оксиды, нитриды и др.), являющиеся центрами зародышеобразования. Кристаллизация с гомогенным образованием зародышей носит название гомогенной кристаллизации.
Нерастворимые частицы расплава или стенки литейной формы являются готовыми центрами зародышеобразования. Зарождение кристаллов на готовых центрах или подложках называют гетерогенным, а кристаллизацию с неоднородным зародышеобразованием технически чистых металлов – гетерогенной. Гетерогенное образование зародышей на готовой подложке энергетически выгодно, т.к. поверхностная свободная энергия Fпов системы уменьшается, потому что имеется исходная граница между подложкой и зарождающимся кристаллом, т.е. нет необходимости формировать новую поверхность. Следовательно, зарождение на готовой поверхности характеризуется меньшим приростом межфазной поверхностной энергии и, соответственно, характеризуется меньшей работой образования критического зародыша. Поэтому в реальных металлических расплавах главную роль играет гетерогенное зарождение кристаллов.
При кристаллизации суммарная энергия системы в изменяется зависимости от размера зародыша (рис. 2.6), штриховые линии являются геометрической суммой объемной и поверхностной энергии – функцией изменения величины полной свободной энергии системы. Максимальная точка на кривых определяется размером зародыша, названным критическим зародышем rк. При образовании кристалла размером меньше rк свободная энергия Ф системы возрастает. Если размер кристалла будет равен или больше rк, то свободная энергия системы уменьшается. Таким образом, самопроизвольный процесс зародышеобразования при гомогенной кристаллизации оказывается невозможным до тех пор, пока размер кристалла твердой фазы не достигнет размера rк. Переохлаждение Т = Т0 – ТS должно быть таким, чтобы разница свободных энергий f = Fж – Fтв обеспечивала бы появление в системе запаса свободной энергии, достаточной для образования критического зародыша.
Материаловедение. Учеб. пособие |
-57- |
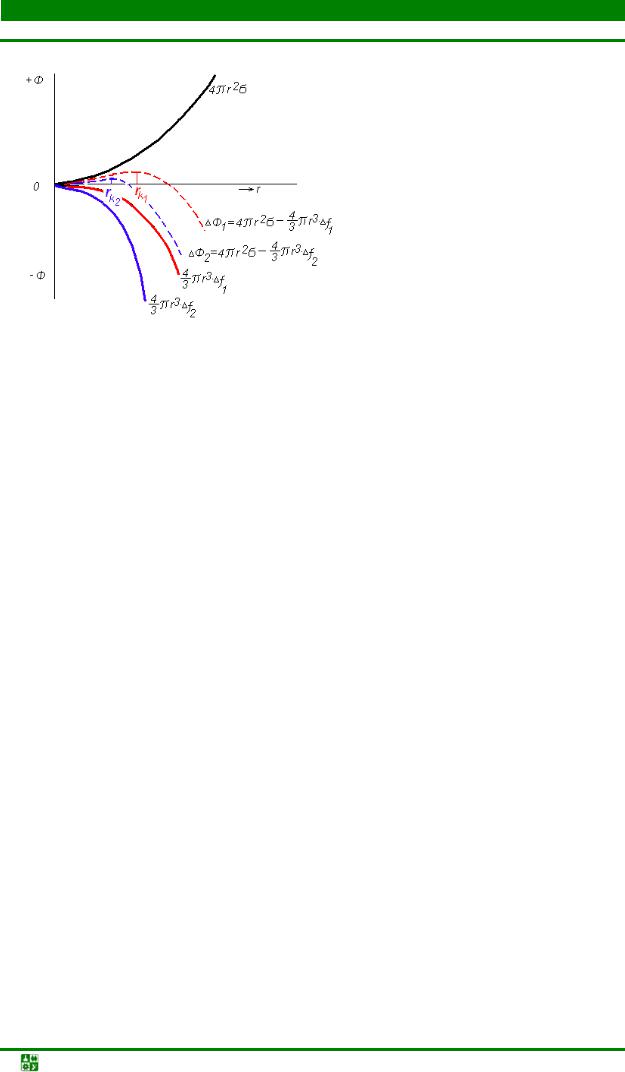
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
Рис. 2.6. Изменение суммарной свободной энергии системы при кристаллизации в зависимости от размера образующегося зародыша и степени переохлаждения
После образования зародыша критического размера присоединение к твердым кристаллам новых атомов приводит к непрерывному уменьшению свободной энергии системы, и процесс кристаллизации продолжается самопроизвольно. Самопроизвольно процесс может развиваться лишь в том случае, если размер образовавшихся частиц больше критического.
Степень переохлаждения оказывает определяющее влияние на размер критического зародыша. Чем больше степень переохлаждения, тем меньше размер критического зародыша (рис. 2.6). Это определяется увеличением выигрыша в изменении объемной свободной энергии с увеличением степени переохлаждения, т.к. размер критического зародыша определяется выражением:
rк = 4σ/ fоб.
Если металл подвергнуть быстрому охлаждению до температуры ниже ТS, то кристаллизация при ТS произойти не успеет и, следовательно, процесс образования кристаллов твердой фазы будет происходить при более низких температурах, т.е. в условиях большей степени переохлаждения. Понижение реальной температуры кристаллизации по сравнению с равновесной температурой кристаллизации (степень переохлаждения) зависит от начальной скорости охлаждения. Применяя различные скорости охлаждения, удается получить различные степени переохлаждения (рис. 2.7).
Материаловедение. Учеб. пособие |
-58- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
Рис. 2.7. Термические кривые кристаллизации при различных скоростях охлаждения: от а до е – увеличение скорости охлаждения системы
Кинетика кристаллизации при разных степенях переохлаждения различается. Это можно видеть из кривых изменения свободной энергии системы: при Т2 > Т1 (рис. 2.4), когда f2 > f1 и, следовательно, отрицательный член суммарной свободной энергии системы значительно возрастает по абсолютной величине, уменьшая уровень энергии, который необходимо преодолеть для образования критического зародыша, и саму величину критического зародыша (индексы 1 и 2 на рис. 2.6).
Совершенно очевидно, что чем меньше критический размер зародыша, тем большее число частиц сумеют преодолеть критический энергетический барьер и стать зародышами критических размеров.
Следовательно, чем больше степень переохлаждения, тем больше зародышей образуется за единицу времени. Зависимость кристаллизационных параметров Таммана от степени
переохлаждения показана на рис. 2.8, где n – число центров кристаллизации, образующихся в единицу времени; с – линейная скорость роста кристаллов.
Однако рост числа зародышей наблюдается не бесконечно. При определенных низких температурах в связи с естественным уменьшением скорости протекания диффузионных процессов подвижность атомов, необходимая для протекания процесса кристаллизации, снижается и теоретически при очень больших переохлаждениях может уменьшиться до нуля (штриховые части кривых). Однако для металлов при кристаллизации из жидкого состояния практически удалось обнаружить только восходящие части кривых Таммана.
Материаловедение. Учеб. пособие |
-59- |
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
2.5. Механизмыиформыростакристаллов
После образования центров кристаллизации рост кристаллов осуществляется путем последовательного присоединения атомных слоев на поверхности образовавшихся зародышей (рис. 2.9).
Рост кристалла происходит за счет появления на поверхности кристалла двухмерного зародыша (рис. 2.9, а), который может иметь размеры меньше или больше критического.
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
а |
|
б |
в |
||
Рис. 2.9. Рост кристалла на атомно-гладкой поверхности: а – одиночный атом на поверхности; б – присоединениеатома к ступеньке; в – присоединения атома к излому на ступеньке
Механизм роста зависит от атомного строения границы раздела кри- сталл–жидкость. Используют представление о двух крайних типах этого строения: атомно-гладкой и атомно-шероховатой границе.
При образовании двухмерного зародыша происходит изменение свободной энергии системы за счет фазового перехода и увеличения ее за счет образования дополнительной поверхности раздела, т.е.
Ф = – V f + S σ.
Таким образом, эта функция оказывается аналогичной для рассмотренного выше трехмерного зародыша, т.е. для условий роста кристалла путем присоединения двухмерного зародыша на плоскость ранее образовавшегося кристалла существует такой размер двухмерного зародыша, меньше которого он оказывается неустойчивым и растворяется. Такой слой называется крити-
ческим двумерным зародышем.
При малых степенях переохлаждения размер критического двумерного зародыша велик, поэтому возникающих двумерных зародышей весьма мало, и рост кристаллов в этих условиях происходит очень медленно.
Чем больше степень переохлаждения, тем меньше линейные размеры двумерного зародыша и тем меньшее значение энергии требуется для его образования, с увеличением степени переохлаждения скорость роста кристаллов возрастает, т.е. кривая линейного роста кристаллов аналогична кривой количества центров кристаллизации, возникающих в единицу времени.
Материаловедение. Учеб. пособие |
-60- |
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
В случае атомно-гладкой границы все позиции атомов поверхностного слоя кристалла заняты. Одиночный атом на гладкой поверхности слабо связан с кристаллом. После возникновения двумерных зародышей рост кристалла протекает с наименьшими энергетическими затратами. Наиболее благоприятным участком является тройной пространственный угол, где для присоединения новых решеток требуется минимальная площадь дополнительно образующейся границы кристалла. Такое присоединение происходит до полной достройки атомного слоя; дальнейший рост возможен только после появления нового двумерного зародыша.
Важную роль в процессе роста кристалла играют дефекты кристаллов, в частности винтовая дислокация. При этом рост кристалла происходит путем заполнения ступеньки по винтовой линии, когда ступенька в течение всего цикла не исчезает, а только перемещается, обеспечивая непрерывный рост кристалла без образования двумерных зародышей.
Жидкость
Рис. 2.10. Строение атомно-шероховатой поверхности раздела кристалл–жидкость (d – граница раздела)
На атомно-шероховатой границе раздела происходит постепенный переход от структуры расплава к структуре кристалла. На схеме (рис. 2.10) пунктир условно отделяет атомы, принадлежащие жидкой фазе, от атомов твердой фазы. Фактически же граница является размытой и имеет ширину несколько атомных диаметров.
На атомно-шероховатой границе имеется множество мест, где атомы из жидкости могут присоединяться к кристаллу. Рост кристалла с атомношероховатой поверхностью называют непрерывным (он идет во множестве точек по всей поверхности кристалла) или нормальным (граница раздела перемещается в направлении нормали к ней, без участия тангенциального роста каждого слоя).
Степень шероховатости кристалла связана с энтропией плавления. У металлов энтропия плавления низкая, граница кристалл–расплав является атомно-шероховатой и основной механизм роста кристалла непрерывный (нормальный). У висмута и сурьмы, большинства карбидов и многих других химических соединений энтропия плавления высокая, граница кристалл– расплав атомно-гладкая и основной механизм роста кристалла ступенчатый.
Материаловедение. Учеб. пособие |
-61- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
Кинетика кристаллизации, т.е. изменение количества закристаллизовавшегося металла во времени (рис. 2.11) зависит от количества возникающих центров кристаллизации и скорости их роста.
Рис. 2.11. Кинетические кривые развития кристаллизации в зависимости от степени переохлаждения: 1 – минимальная степень переохлаждения; 5 – максимальная
Чем больше количество зародышей и линейная скорость их роста, тем больше количество закристаллизовавшегося вещества.
Величина кристаллизационных параметров зависит от степени переохлаждения (рис. 2.11). При очень малых степенях переохлаждения кристаллизация протекает очень медленно, и начинается не сразу, а по прохождению некоторого промежутка времени, называемого инкубационным периодом (кривая 1).
Увеличение степени переохлаждения приводит к уменьшению длительности инкубационного периода и увеличению скорости кристаллизации (кривые 2, 3, 4, 5). Скорость кристаллизации в начальный период минимальна, увеличивается со временем, достигает максимума и затем понижается (рис. 2.11, нижняя часть).
Факторы, оказывающие влияние на кинетику кристаллизации и размер зерен, оказывают влияние и на их форму. В условиях, близких к равновесию, образуются правильно ограненные кристаллы. Они растут медленно, поверхность их гладкая, хотя и содержит необходимые для застройки граней ступеньки (рис. 2.12).
С увеличением степени переохлаждения межфазная поверхность становится неровной, на поверхности металла появляется множество ячеек, средняя часть которых несколько выдвигается в расплав (рис. 2.12, б).
Материаловедение. Учеб. пособие |
-62- |
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
1
а |
2 |
|
б |
в |
3 |
|
|
|
Рис. 2.12. Формы роста кристаллов в расплаве при кристаллизации: а – плоский (ограненный) кристалл; б – столбчатый ячеистый; в – дендритный: цифры у осей – соответственно, оси первого, второго и третьего порядков
Появление ячеистой структуры зависит от наличия в расплаве примесей и их перераспределения. При постоянном теплоотводе от поверхности отливки в первую очередь кристаллизуются наиболее чистые (по содержанию примесей) участки жидкого металла, в связи с чем наблюдается выдвижение фронта кристаллизации в расплав. Объемы жидкого металла, наиболее загрязненные примесями, оттесняются в появившиеся впадинки на фронте кристаллизации, затвердевают в последнюю очередь и образуют границы ячеек. Выращенный в таких условиях кристалл приобретает столбчатую, вытянутую в направлении теплоотвода форму, напоминающую связку карандашей, боковые поверхности которых соответствуют обогащенным примесями границам зерен.
При еще большем увеличении степени переохлаждения, что достигается увеличением теплоотвода от кристаллизирующейся жидкости, выступы на межфазной границе становятся настолько большими, что жидкость между выступами значительно отстает по темпу затвердевания от выступающих частей кристалла. Наступает так называемый дендритный тип кристаллизации.
Образовавшиеся длинные выступы становятся осями первого порядка. При возникновении на поверхности этих осей неровностей (выступов) появляются новые направления возможного роста кристалла, т.е. оси второго, третьего порядка и т.д. Кристалл в процессе роста напоминает дерево в среде жидкого металла. Если обеспечить слив металла, не закристаллизовавшегося к данному моменту времени, то можно получить дендрит в чистом виде – иллюстрацию для изучения дендритного роста кристаллов (дендрит Чернова). Наслаивание металла на образовавшиеся оси первого, второго и т.д. порядков при последующей кристаллизации приводит к заполнению всего междендритного пространства и образованию сплошного кристалла. Однако обра-
Материаловедение. Учеб. пособие |
-63- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
зующие сплошной кристалл слои металла, появившиеся в различные моменты кристаллизации, отличаются по содержанию примесей. Оси формируются наиболее чистым металлом, участки, закристаллизовавшиеся в междендритном пространстве в последнюю очередь, наиболее сильно загрязнены примесями.
Дендритный рост кристаллов объясняется следующим образом. Наиболее стабильным кристаллом, например металла с ГЦК-решеткой, является кристалл, образованный наиболее плотно упакованными плоскостями (111). Такой кристалл имеет форму октаэдра (рис. 2.13).
|
|
|
Рис. 2.13. Начальные этапы дендритного |
|
|
|
|
роста кристаллов: а – рост совершенного |
|
|
|
|
ограненного кристалла в виде октаэдра; |
|
|
|
|
||
|
|
|||
|
|
|
б – образование отростков (дендритных осей |
|
|
|
|
первого порядка) |
|
а |
б |
|||
|
|
Грани октаэдра обладают минимальной свободной энергией. Вершины октаэдра, как правило, обладают значительным количеством дефектов кристаллического строения, повышенной свободной энергией. В связи с этим уже на ранних этапах роста октаэдрический кристалл отбрасывает шесть отростков в трех взаимно перпендикулярных направлениях. Эти отростки превращаются в оси первого порядка, ответвления от которых образуют оси второго, третьего и т.д. порядков.
Ускоренный рост выступающих участков дендрита обусловлен несколькими причинами: во-первых, особенности упаковки атомов и преимущественное расположение выходов дефектов кристаллического строения на поверхности этих участков влияют на их рост.
Во-вторых, выступающие участки кристалла соприкасаются с большим объемом жидкости, приходящейся на единицу их поверхности. За счет этого быстрее рассеивается теплота кристаллизации, выделяющаяся на фронте затвердевания. При этом оказывается, что острие соприкасается с более охлажденным металлом, чем около боковых поверхностей, в связи с чем кристаллизация оказывается более выгодной у острия.
В-третьих, сказывается влияние примесей. Накапливаясь в жидком металле у вогнутых участков кристалла, примесь тормозит их рост. Рост же острых выступов, соприкасающихся с расплавом исходного состава, не задерживается.
Материаловедение. Учеб. пособие |
-64- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
2.6. Размерзерналитогометалла. Строениеметаллическогослитка
Изменение степени переохлаждения оказывает влияние на кристаллизационные параметры: число центров кристаллизации n и скорость роста кристаллов с. Степень переохлаждения практически определяет получаемую при кристаллизации структуру литого металла, величину его зерен. С увеличением степени переохлаждения увеличиваются оба кристаллизационных параметра, однако темп возрастания количества зародышей больше, чем темп возрастания линейной скорости их роста. Кроме того, максимум кривой скорости роста кристаллов относительно кривой изменения числа центов кристаллизации смещен в сторону меньших степеней переохлаждения. Поэтому с увеличением степени переохлаждения число зерен возрастает, а их размер уменьшается. Таким образом, увеличение степени переохлаждения при кристаллизации способствует мелкозернистости литого металла. Наибольшая степень измельчения структуры может быть получена при таких степенях переохлаждения, когда скорость роста уже уменьшается, а число возникающих зародышей еще продолжает расти.
Изменение размера зерен при кристаллизации можно описать зависимостью, обнаруженной экспериментально:
d = A Vî−õën ,
где d – размер зерна или дендритной ячейки; Vî−õën – скорость охлажде-
ния при кристаллизции; A, n – константы, которые мало отличаются для различных сплавов.
Расчеты, подтвержденные экспериментально, показывают, что для алюминиевых, магниевых, никелевых сплавов при А = 100 мкм, n = 0,4 и высокой скорости скорости кристаллизации 106 °С/с размер дендритной ячейки составляет d = 0,4 мкм, что на несколько порядков меньше размера зерна сплавов, кристаллизуемых с малыми скоростями охлаждения (например, 10 °С/с).
При еще больших скоростях охлаждения, например, после оплавления поверхности металла лучом лазера, образующиеся кристаллы могут получить размеры, соизмеримые с несколькими десятками межатомных расстояний, что соответствует формированию рентгеноаморфного состояния закристаллизованного металла.
На кинетику процесса кристаллизации, на количество и размеры кристаллизирующихся зерен, кроме чисто тепловых процессов, оказывают влияние вторичные факторы. К ним относится случайное (из шихтовых материалов) наличие в расплаве жидкости посторонних нерастворимых частиц, их специальное введение модифицированием, возникновение в расплаве флуктуаций свободной энергии под действием дополнительного воздействия, например, при обработке расплава ультразвуком или механической вибрацией.
Кристаллизация без каких-либо посторонних воздействий или без наличия готовых центров кристаллизации называется самопроизвольной, при наличии готовых центров – несамопроизвольной.
Материаловедение. Учеб. пособие |
-65- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
Изменяя число активных частиц – катализаторов кристаллизации, можно изменять размер зерна в широких пределах. На этом основан широко применяемый в металлургии способ получения мелкого зерна, называемый модифицированием. Существует несколько способов модифицирования, изучаемых в специальных курсах металлургии металлов и сплавов. Согласно одному из них, в расплав вводят множество дисперсных нерастворимых частиц, которые при последующем охлаждении способствуют интенсивному развитию несамопроизвольной кристаллизации, в результате чего отливка получается мелкозернистой. В другом случае в жидкий металл вводят небольшое количество растворимых добавок, которые понижают поверхностное натяжение на границе раздела между жидкой и твердой фазами, снижая флуктуации свободной энергии, необходимой для образования зародыша, что в конечном счете приводит к образованию большого числа зародышевых центров.
При обработке расплава ультразвуком в процессе кристаллизации возможно несколько механизмов измельчения зерна литого материала. Вопервых, осуществляется ввод колебаний в расплав с помощью металлических инструментов. Ультразвуковая эрозия рабочего торца волновода приводит к попаданию в расплав мельчайших частиц материала волновода, которые модифицируют сплав, изменяя зерно.
Во-вторых, ввод ультразвуковых колебаний в расплав приводит к развитию процессов кавитации, при которой в расплаве возникают локальные скачки давления в его микрообъемах, достигающие нескольких сот или тысяч атмосфер. Такое локальное выделение энергии в расплаве действует как модифицирование, увеличивая количество центров кристаллизации.
В-третьих, кавитационные процессы, развивающиеся в процессе кристаллизации, могут разрушать, диспергировать уже образовавшиеся сравнительно крупные зародышевые кристаллы, тем самым увеличивая их количество. Возникновение ультразвукового ветра способствует активному перемешиванию расплава, обеспечивающего равномерное распределение образовавшихся зародышевых центров в объеме расплава. Ультразвуковые колебания способствуют измельчению не только макростроения отливки или слитка, но и микроструктуры металла.
Применение вибрации при кристаллизации вызывает аналогичное действие за исключением специфических особенностей воздействия ультразвука. В процессе вибрационной кристаллизации также изменяется макростроение отливок.
Строение слитка во многом определяется условиями его получения, технологией литья, скоростью и способом охлаждения металла (рис. 2.14). Различают слитки, полученные кристаллизацией в изложнице и в кристаллизаторе. Классические представления о строении слитка были разработаны впервые Д.К. Черновым еще в ХIХ в. Они не потеряли своего значения и в настоящее время.
Материаловедение. Учеб. пособие |
-66- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
Рис. 2.14. Строение слитка, полученного литьем в изложницу: 1 – зона прикорковых мелких дендритов; 2 – зона столбчатых кристаллов; 3 – зона равноосных кристаллов (центральная часть слитка; 4 – усадочная
раковина
При заливке металла в изложницу на характер образования и роста дендритов оказывают влияние стенки изложницы.
Преимущественные направления роста дендритов зависят от направления теплоотвода, поэтому основная масса главных осей дендритов оказывается ориентированной вдоль направления теплопотока, т.е. в направлении, перпендикулярном стенкам изложницы. Слиток стали обычно состоит из трех зон: 1 – мелких дендритов (корка), 2 – столбчатых кристаллов, 3 – крупных беспорядочно ориентированных дендритов. В верхней части слитка образуется усадочная раковина (4). Во всех зонах слитка может располагаться междендритная усадочная пористость.
2.7. Фазовыепревращениявтвердомсостоянии
Превращения в металлах и сплавах в твердом состоянии по своей физической сущности во многом напоминают кристаллизацию жидких металлов. Эти превращения называют фазовой перекристаллизацией, а при их исследованиях используют те же подходы в отношении механизмов и кинетики формирования новой фазы, включая образование зародышей и последующий их рост.
В чистых металлах основными превращениями в твердом состоянии являются аллотропические (полиморфные), а также магнитные превращения. В сплавах превращения в твердом состоянии дополняются целым рядом превращений, таких как эвтектоидное, перитектоидное, растворение и выделение избыточных фаз и др. Их изучение потребует знания диаграмм фазового равновесия и будет кратко рассмотрено позже.
Аллотропическим (полиморфным) превращением называют изменение пространственной решетки кристаллического тела. В качестве примеров аллотропических превращений можно привести превращение низкотемпературной аллотропической формы α-Fe с объемно-центрированной кубической решеткой в высокотемпературную форму γ-Fe с гранецентрированной куби-
Материаловедение. Учеб. пособие |
-67- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
ческой решеткой, при температуре 911 °С и последующее превращение при температуре 1392 °С γ-Fe в δ-Fe с объемно-центрированной кубической решеткой, аналогичной α-Fe. Аналогичные превращения можно наблюдать в титане, цирконии и т.д. В титане и цирконии низкотемпературной аллотропической формой являются α-Ti, α-Zr с гексагональной плотноупакованной решеткой. При температуре выше 882 °С для титана и 862 °С для циркония образуются β-Ti и β-Zr, обладающие объемно-центрированной решеткой.
Аллотропическое превращение заключается в том, что атомное строение кристаллического тела изменяется при нагреве и охлаждении при переходе через критическую точку. Сам процесс перестройки кристаллической решетки происходит изотермически при постоянной температуре, кривая охлаждения сплава, претерпевающая аллотропические превращения, аналогична кривой, наблюдаемой при затвердевании жидкого металла (рис. 2.15). Температура перехода называется критической точкой превращения. При температуре Т0 наблюдается фазовое равновесие двух аллотропических разновидностей.
Аналогично процессу кристаллизации аллотропическое превращение идет с поглощением тепла при нагреве и выделением его при охлаждении. Аллотропическое превращение (также по аналогии с процессом кристаллизации) происходит путем образования зародышей и их последующего роста, в связи с чем оно протекает всегда с наличием переохлаждения (при охлаждении) и перенагрева (при нагреве).
Рис. 2.15. Термическая кривая аллотропи- |
Рис. 2.16. Изменение свободной энергии сис- |
ческого превращения при охлаждении |
темы при аллотропическом превращении |
Аллотропическое превращение происходит так же, как и процесс кристаллизации, в связи со стремлением системы к уменьшению свободной энергии и с тем, что линии, характеризующие изменения свободной энергии в зависимости от температуры, пересекаются при температуре Т0 (рис. 2.16).
При температурах выше Т0 стабильной является β-фаза, при более низкой температуре стабильной оказывается α-фаза, имеющая меньший запас свободной энергии.
Материаловедение. Учеб. пособие |
-68- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
Впроцессах кристаллизации основным препятствием образования твердых кристаллов являются затраты энергии на образование границы раздела фаз. Это вызывает необходимость переохлаждения для начала процесса кристаллизации.
При аллотропическом превращении кроме энергии, затрачиваемой на образование границы раздела фаз, нужны дополнительные затраты энергии на преодоление упругого сопротивления твердой фазы, связанные с тем, что полиморфные превращения всегда приводят к изменениям объема. Поскольку затраты энергии для образования зародышей при аллотропическом превращении больше, чем при кристаллизации из жидкого состояния, то переохлаждение при превращениях в твердом состоянии должны быть гораздо больше, чем при кристаллизации.
Аллотропические превращения могут протекать по двум механизмам: диффузионным (нормальным) путем; бездиффузионным (мартенситным, сдвиговым) путем.
Вотдельных металлах эти превращения могут протекать как по одному, так и по другому механизму, что будет зависеть от скорости охлаждения.
Диффузионный механизм аллотропического превращения заключается
втом, что атомы, располагающиеся в решетке высокотемпературной модификации путем диффузионного перемещения, занимают новые места, характерные для новой аллотропической формы: низкотемпературной модификации.
Следовательно, развитие диффузионного механизма аллотропического превращения наиболее благоприятно при высоких температурах, обеспечивающих большую скорость диффузионного перемещения атомов. Кроме того, если температура превращения настолько высока, что обеспечивает высокую пластичность, то затраты энергии на преодоление упругого сопротивления тела образованию и росту новой фазы, отличающейся от новой фазы удельным объемом, становятся меньше, в связи с чем аллотропическое превращение протекает при минимальном переохлаждении.
Зародыши новой фазы появляются на границах зерен старой фазы и на других дефектах кристаллов. В дальнейшем происходит рост этих зародышей за счет перехода атомов из старой фазы в новую. Наряду с этим наблюдается продолжение зарождения новых зародышей образующейся фазы.
При переходе металла из одного кристаллографического состояния в другое происходит не только изменение кристаллической структуры, но и имеет место полный процесс фазовой перекристаллизации, при которой на месте старых зерен образуются совершенно новые зерна с новым расположением границ. Причем на месте старого одного зерна могут возникнуть несколько новых или на месте нескольких старых – одно новое зерно.
Этот процесс зависит главным образом от скорости охлаждения и степени переохлаждения, которые в основном определяют количество образующихся в единицу времени центров кристаллизации и скорость роста новой фазы. Чем выше скорость охлаждения и выше степени переохлаждения,
Материаловедение. Учеб. пособие |
-69- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
тем больше количество центов кристаллизации, тем более дисперсными являются зерна новой фазы.
Поскольку аллотропические превращения происходят в твердой среде, наиболее интенсивно процесс фазовой перекристаллизации будет происходить в том случае, если длина диффузных путей будет минимальной. А это означает, что при образовании зародышей должен соблюдаться принцип структурного и размерного соответствия. Он сформулирован С.Т. Конобе-
евским и заключается в том, что «форма и ориентировка зародышей новой фазы при кристаллизации должны соответствовать минимуму поверхностной энергии при данном объеме, а минимум поверхностной энергии обеспечивается при максимальном сходстве в расположении атомов на соприкасающихся гранях старой и новой фаз».
Поэтому зарождение новой фазы начинается на плоскостях, которые являются наиболее сходными у обеих кристаллических решеток. Например, при переходе γ-Fe в α-Fe наибольшее сходство имеют плоскости {111} в γ-Fe
и {110} в α-Fe (рис. 2.17).
Рис. 2.17. Близкие по строению плоскости {110} в решетке ОЦК
и {111} в ГЦК-решетке
Рассматриваемое аллотропическое превращение во всем объеме металла протекает за счет преобразования плоскостей {111} γ в {110} α и направлений [110] γ в [111] α. При этом происходит лишь небольшой поворот кристаллографических направлений, при котором обеспечиваются углы 70°30′ и 54°45′, соответствующие расположению атомов в объемно-центрированном кубе.
Форма выделений новой фазы в основном определяется упругой энергией, возникающей при выделении. Если при аллотропическом превращении наблюдается большая степень размерного и структурного соответствия кристаллов старой и новой фаз, упругая энергия системы минимальна, а кристаллы новой фазы имеют форму дисков (пластин). Кроме того, на форму выделяющихся кристаллов оказывает влияние степень анизотропии упругих свойств обеих фаз. Если модули упругости возникающей фазы для всех направлений меньше, чем модули переходной фазы, в этом случае форма выделений – диски или пластины. Если модуль новой фазы только для одного из
Материаловедение. Учеб. пособие |
-70- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
направлений меньше, чем модуль исходной фазы, то может появиться игольчатая форма выделений.
Появление новой фазы с новым удельным объемом может способствовать развитию сопутствующих процессов, таких как наклеп (фазовый) и рекристаллизации. Кроме того, на развитие аллотропии может оказывать влияние наличие примесей, которые могут играть роль дополнительных зародышевых центров. Все эти дополнительные параметры могут оказать влияние на окончательную структуру и свойства металла, претерпевшего аллотропическое превращение. В результате собирательной рекристаллизации, сопутствующей аллотропическому превращению, происходит укрупнение зерна, причем тем больше, чем выше температура нагрева. В случае же нагрева до температур, лежащих выше критической точки, когда происходит образование зерен новой фазы, но не успевает начаться укрупнение зерна, обычно получается очень маленькое зерно.
Бездиффузионный сдвиговой, или мартенситный, механизм аллотро-
пического превращения осуществляется при низких температурах, при которых диффузия или самодиффузия почти не осуществляется. Это превращение происходит или в металлах с низкой температурой аллотропического перехода или при сильном переохлаждении высокотемпературной аллотропической формы в металлах с высокой температурой превращения. Так, у кобальта при Т0 = 420 °С аллотропическое превращение идет только бездиффузионным путем. В железе, титане, цирконии и других металлах с высокой температурой Т0 при большом переохлаждении превращение идет бездиффузионным путем, а при малом переохлаждении – диффузионным.
При мартенситном аллотропическом превращении новая фаза образуется путем кооперативного и закономерного перемещения атомов таким образом, что они сохраняют своих соседей и смещаются по отношению один к другому на расстояния, не превышающие междуатомные.
Сущность мартенситного превращения заключается в том, что в процессе перехода старой фазы в новую сохраняется сопряженность (когерентность) их пространственных решеток. При наличии когерентности двух фаз поверхностная энергия границы очень мала, что способствует интенсивному росту образовавшихся кристаллов.
Упругая энергия сравнительно велика, она возрастает в процессе роста кристалла до тех пор, пока не будет превзойден предел упругости в переходной зоне. При этом в ней происходит пластический сдвиг, нарушающий когерентность кристаллических решеток старой и новой фаз. Возникновение некогерентной границы приостанавливает рост данного кристалла мартенситной фазы. Дальнейшее увеличение количества образующейся фазы происходит путем образования новых зародышей и мгновенного их роста. Скорость роста кристаллов при мартенситном превращении очень велика и достигает скорости звука. Скорость образования центров кристаллизации подчиняется общим закономерностям фазовых превращений. При развитии мартенситного механизма аллотропического превращения участки новой фазы располагаются вдоль определенных кристаллографических плоскостей ста-
Материаловедение. Учеб. пособие |
-71- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
рой фазы и выглядят под микроскопом в виде иголок или пластин. Это явля-
ется результатом структурного и размерного соответствия, устанавливаю-
щегося между решетками старой и новой фаз.
Важной особенностью мартенситного превращения является то, что в изотермических условиях превращения только часть старой фазы переходит в новую. Дальнейшее превращение может протекать только при понижении температуры. Мартенситное превращение происходит в интервале температур. Различают точки Мн и Мк – начало и конец мартенситного превращения. Во многих случаях превращение не доходит до конца даже при очень низких температурах. Установлено, что мартенситное превращение, как и нормальное (диффузионное), обратимо. Образование высокотемпературной формы из низкотемпературной при достаточной степени перенагрева может происходить бездиффузионным путем.
Магнитное превращение, наблюдаемое в ферромагнитных материалах, не является обычным фазовым превращением. Оно не связано с перемещением диффузией атомов, а вызывается только изменением взаимодействия магнитно нескомпенсированных d- или f-электронов, обусловливающих возникновение ферромагнетизма. Характер изменения магнитных свойств зависит от физической природы металла. Температура потери магнитных свойств, называемая точкой Кюри, не зависит от скорости нагрева или охлаждения. Эта температура постоянна для каждого металла. Для железа она равна 768 °С, ни-
келя – 365–370 °С, кобальта – 1 050 °С.
2.8. Изменениеструктурыисвойствметаллов припластическойдеформации
Механизмы пластического деформирования. Деформация может быть упругой, исчезающей после снятия нагрузи, и пластической, остающейся после снятия нагрузки.
При пластическом деформировании одна часть кристалла перемешается по отношению к другой. Если нагрузку снять, то перемещенная часть кристалла не возвратится на старое место, и деформация сохранится.
Теория дислокаций, объясняет процесс пластического деформирования путем сдвига (рис. 2.18).
Дислокация (обозначаемая значком ) под действием силы Р или касательных напряжений перемещается вправо только вследствие того, что изменяется «соседство» атомов по обе стороны от плоскости АА. При перемещении дислокации на одно межатомное расстояние разрывается только одна межатомная связь, а атомы смещаются на доли межатомных расстояний. В результате дислокация выходит на поверхность кристалла (граница зерна или блок мозаики) и исчезает (рис. 2.18, в).
Рассмотренная схема пластической деформации позволяет сделать вывод, что процесс сдвига в кристалле будет происходить тем легче, чем больше дислокаций в металле. В металле, в котором нет дислокаций, сдвиг воз-
Материаловедение. Учеб. пособие |
-72- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
можен только за счет одновременного смещения всей части кристалла, и прочность бездислокационного металла должна быть равна теоретической.
а |
б |
в |
Рис. 2.18. Дислокационная схема пластического сдвига: а – перед деформацией; б, в – последующие стадии деформации
Способность реального металла пластически деформироваться используют при различных технологических процессах – при прокатке, протяжке проволоки, операциях гибки, высадки, вытяжки, штамповки и т. д. Большое значение он имеет и для обеспечения конструктивной прочности или надежности металлических конструкций, деталей машин и других изделий из металла.
Пластическая деформация осуществляется скольжением и двойникованием. Скольжение в кристаллической решетке протекает по плоскостям и направлениям с наиболее плотной упаковкой атомов, где наименьшее сопротивление сдвигу.
Это объясняется тем, что расстояние между соседними атомными плоскостями наибольшее, т.е. связь между ними наименьшая. Плоскости скольжения и направления скольжения, лежащие в этих плоскостях, образу-
ют систему скольжения. В металлах могут действовать одна или одновременно несколько систем скольжения. Металлы с кубической кристаллической решеткой (ГЦК и ОЦК) обладают высокой пластичностью, так как скольжение в них происходит во многих направлениях. Металлы с ГПУструктурой менее пластичны и поэтому труднее, чем металлы с кубической структурой, поддаются прокатке, штамповке и другим видам деформации.
Скольжение осуществляется в результате перемещения в кристалле дислокаций. На начальной стадии пластическая деформация монокристалла осуществляется движением дислокации по одной системе плоскостей – стадия легкого скольжения. Дислокации на этой стадии перемещаются сравнительно беспрепятственно на большие расстояния, обеспечивая прогрессивную деформацию без значительного роста действующих напряжений (стадия I деформационного упрочнения). После этого начинается стадия множественного скольжения – движение дислокации в двух и более системах. На этой стадии после значительной деформации дислокационная структура металла сильно усложняется и плотность дислокаций («лес» дислокаций) возрастает
Материаловедение. Учеб. пособие |
-73- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
по сравнению с исходным состоянием на четыре-шесть порядков, достигая 1011–1012 см-2. Вследствие упругого взаимодействия между дислокациями сопротивление их движению сильно возрастает, и для их продвижения внешнее напряжение резко возрастает (стадия II деформационного упрочнения). Под влиянием все возрастающего напряжения развивается поперечное скольжение винтовых дислокации, т.е. скольжение с переходом из одной плоскости скольжения в другую. Это приводит к частичной релаксации напряжений, аннигиляции отдельных дислокаций разного знака и группировке дислокации в объемные ячейки, внутри которых плотность дислокации меньше, чем в стенках ячеек. Наступает III стадия деформации, когда происходит так называемый динамический возврат, который приводит к уменьшению деформационного упрочнения. Дислокации, движущиеся в деформированном металле, порождают большое число дислоцированных атомов и вакансий.
Пластическая деформация металлов, имеющих плотноупакованные решетки, может осуществляться не только скольжением, но и двойникованием, которое сводится к переориентации части кристалла в положение, симметричное по отношению к первой части относительно плоскости, называемой плоскостью двойникования. Двойникование, подобно скольжению, сопровождается прохождением дислокаций сквозь кристалл. В металлах с ГЦК- и ОЦКрешеткой двойникование наблюдается только при больших степенях деформирования и низких температурах.
Деформирование поликристаллов. Пластическая деформация поли-
кристаллического металла протекает аналогично деформации монокристалла путем сдвига (скольжения) или двойникования. Формоизменение металла при обработке давлением происходит в результате пластической деформации каждого зерна. Плоскости и направления скольжения в каждом зерне различные. При увеличении внешней силы скольжение первоначально начинается в наиболее благоприятно ориентированных зернах, где достигнуто критическое касательное напряжение. Движение дислокации, начавшееся в одном зерне, не может переходить в соседнее зерно, т.к. в нем системы скольжения ориентированы по-иному.
Достигнув границы зерна, дислокации останавливаются. Однако напряжения от скопления дислокации у границы зерна могут упруго распространяться через границу и привести в действие источники Франка-Рида в соседнем зерне. В этом случае имеет место «эстафетная» передача деформации от одного зерна к другому. Границы зерна тормозят движение дислокации. Поэтому в поликристаллическом металле первая стадия практически отсутствует, а во второй стадии деформационного упрочнения коэффициент упрочнения выше.
При деформации в результате процессов скольжения зерна меняют свою форму. До деформации зерно имело округлую, близкую к равновесной форму, после деформации в результате смещения по плоскостям скольжения зерна вытягиваются в направлении действующих сил, образуя волокнистую или слоистую структуру. Одновременно с изменением формы зерна внутри
Материаловедение. Учеб. пособие |
-74- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
него происходит формирование субзерен и увеличение угла разориентировки между ними (рис. 2.19).
а |
б |
в |
г |
Рис. 2.19. Изменение микроструктуры поликристаллического металла при дефор-
мации: а – исходное состояние (ε = 0 %); б – ε = 1%; в – ε = 40 %; г – ε = 80 – 90 %
Текстура деформации. При большой степени деформации возникает преимущественная ориентация кристаллографических плоскостей и направлений в зернах. Закономерная ориентация кристаллитов относительно внешних деформационных сил получила название текстуры (текстура деформации).
Чем больше степень деформации, тем большая часть кристаллических зерен получает преимущественную ориентацию (текстуру). Характер текстуры зависит от природы металла и вида деформации (прокатка, волочение и т.д.). Кристаллографическую текстуру не следует отождествлять c волокнистой структурой, волокнистость иногда может и не сопровождаться текстурой. Образование текстуры способствует появлению анизотропии механических и физических свойств. Вид текстуры определяется типом обработки давлением и природой металлического материала. Текстура волочения является аксиальной, она характеризуется параллельным оси волочения кристаллографическим направлением, вокруг которого решетка поворачивается. У ГЦК металлов это направление <111> и <100>, у ОЦК – <110>. Текстура прокатки характеризуется кристаллографической плоскостью и направлением, параллельными плоскости и направлению прокатки. У α-железа это {112} <110>, а
также {110} <110>.
Деформационное упрочнение поликристаллического металла.
С увеличением степени холодной (ниже 0,15–0,2 Тпл) деформации свойства, характеризующие сопротивление деформации (σв, σ0,2, HВ и др.), повышаются, а способность к пластической деформации уменьшается. Это явление получило название наклепа. Зависимость механических свойств стали 08кп от степени обжатия ε при холодной прокатке показана на рис. 2.20.
Металлы с ГЦК-решеткой упрочняются сильнее, чем металлы с ОЦКрешеткой. В результате холодной деформации уменьшаются плотность, сопротивление коррозии и повышается электросопротивление. Холодная деформация ферромагнитных металлов (например железа) повышает коэрцитивную силу и уменьшает магнитную проницаемость.
Неравновесная структура, созданная холодной деформацией, у большинства металлов устойчива при температуре 25 °С. Переход металла в бо-
Материаловедение. Учеб. пособие |
-75- |
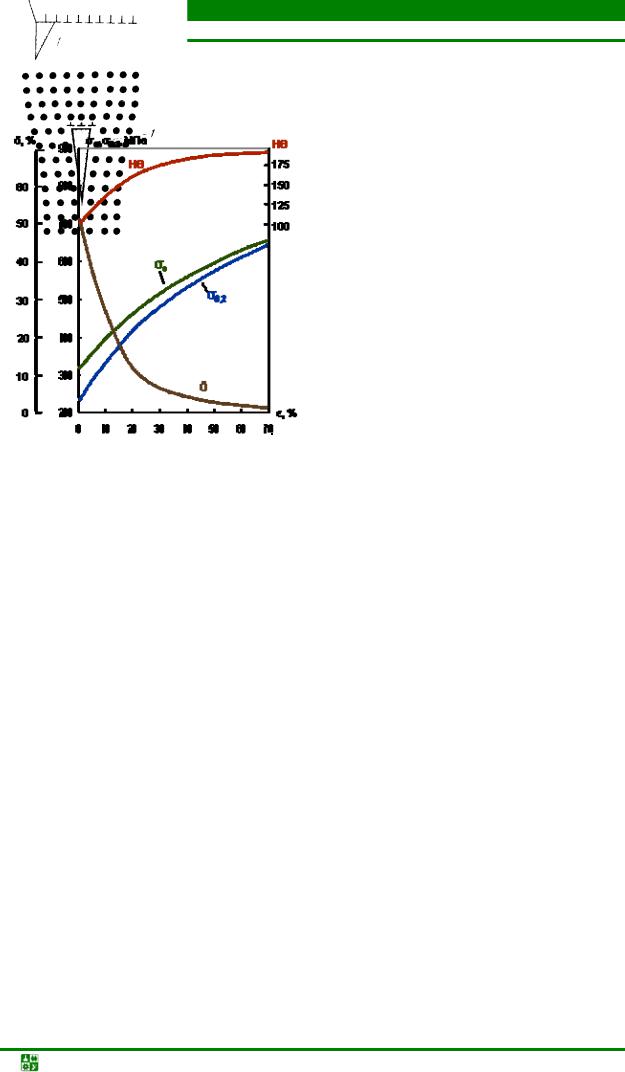
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
лее стабильное состояние происходит при нагреве. При повышении температуры ускоряется перемещение точечных дефектов и создаются условия для перераспределения дислокации и уменьшения их количества.
Рис. 2.20. Зависимостьмеханических свойств |
Рис. 2.21. Схема образования |
стали 08кп от степени обжатия ε при холод- |
трещины: 1 − трещина |
ной прокатке |
|
Разрушение металлов. Под разрушением понимают процесс зарождения и развития в металле трещин, приводящий к разделению его на части. Разрушение происходит в результате развития нескольких трещин или слияния рядом расположенных трещин в одну магистральную трещину, по которой происходит полное разрушение.
Разрушение может быть хрупким (в металлах – квазихрупким) и (или) вязким. Механизм зарождения трещин одинаков как при хрупком, так и при вязком разрушении. Возникновение микротрещин чаще происходит благодаря скоплению движущихся дислокации (пластической деформации) перед препятствием (границами зерен, межфазными границами, перед всевозможными включениями и т.д.).
В месте скопления дислокации они могут прийти в столь тесное соприкосновение, что их экстраплоскости сливаются, а под ними образуется зародышевая трещина (рис. 2.21).
При хрупком разрушении возникшая трещина становится нестабильной и растет самопроизвольно, если ее длина (при заданном напряжении) превышает некоторое критическое значение, а вершина трещины сохраняет остроту, соизмеримую (по радиусу у вершины) с атомными размерами. В этом случае напряжения на краю трещин оказываются достаточными для нарушения межатомной связи.
При разрушении распространяющая трещина будет окаймлена узкой зоной пластической деформации, на создание которой затрачивается дополнительная энергия.
Материаловедение. Учеб. пособие |
-76- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
Вязкое и хрупкое разрушения различаются между собой по величине пластической зоны у вершины трещины. При хрупком разрушении величина пластической зоны в устье трещины мала. При вязком разрушении величина пластической зоны, идущей впереди распространяющейся трещины, велика, а сама трещина затупляется у своей вершины. Вязкое разрушение обусловлено малой скоростью распространения трещины. Скорость распространения хрупкой трещины весьма велика. Для стали скорость роста трещины достигает 2 500 м/с. Поэтому нередко хрупкое разрушение называют «внезапным», или «катастрофическим», разрушением. Вязкое и хрупкое разрушения можно связать с энергоемкостью процесса разрушения при том или ином виде испытания. Вязкому разрушению соответствуют обычно высокие значения поглощенной энергии, т.е. большая работа распространения трещины. Энергоемкость хрупкого разрушения мала, и соответственно работа распространения трещины также мала.
В зависимости от особенностей микроструктуры выделяют два вида разрушения: транскристаллитное (внутризеренное) и интеркристаллитное
(межзеренное). При транскристаллитном разрушении трещина распространяется по телу зерна, а при интеркристаллитном она проходит по границам зерен.
Разрушение по границам зерен, как правило, является хрупким с малой долей пластической деформации. При распространении трещины по телу зерна может происходить как вязкое, так и хрупкое разрушение.
Изучение тонкой структуры излома с помощью электронного микроскопа (микрофрактография) позволяет более уверенно судить о вязком или хрупком характере разрушения. Вязкое разрушение характеризуется ямочным («чашечным») изломом; ямка – микроуглубление на поверхности излома, возникающее в результате образования, роста и слияния микропустот. Глубина ямки определяется способностью металла к локальной пластической деформации.
Излом при хрупком разрушении имеет ручьистый узор, представляющий собой систему сходящихся ступенек скола, образующихся в результате разрушения перемычек между хрупкими трещинами, распространяющимися путем скола по параллельным, близко расположенным кристаллографическим плоскостям. В отличие от вязкого, хрупкое разрушение распространяется внутри отдельных зерен вдоль плоскости с наиболее плотной упаковкой атомов, называемой плоскостью скола.
Вязкий чашечный и хрупкий ручьистый изломы относятся к транскристаллическому разрушению.
При исследовании на электронном микроскопе хрупкое разрушение, идущее по границам зерен, выявляется в виде гладких поверхностей, так называемых фасеток зернограничного скола, часто с некоторым количеством выделившихся частиц. Межзеренное разрушение происходит легче при выделении по границам зерен частиц хрупкой фазы.
Одни и те же (по составу) сплавы в зависимости от предшествующей обработки и метода испытания могут быть и вязкими и хрупкими. Многие металлы (Fе, Мо, W, Zn и др.), имеющие кристаллические решетки ОЦК и
Материаловедение. Учеб. пособие |
-77- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
ГПУ, в зависимости от температуры могут разрушаться как вязко, так и хрупко. Понижение температуры обусловливает переход от вязкого к хрупкому разрушению. Это явление получило название хладноломкости. Явление хладноломкости можно объяснить схемой А.Ф. Иоффе. Понижение температуры практически не изменяет сопротивление отрыву (разрушающего напряжения), но повышает сопротивление пластической деформации σт (предел текучести). Поэтому металлы, вязкие при сравнительно высоких температурах, могут при низких температурах разрушаться хрупко. В указанных условиях сопротивление отрыву достигается при напряжениях, меньших, чем предел текучести. Точка пересечения кривых σт и Sотр, соответствующая температуре перехода металла от вязкого разрушения к хрупкому, получила на-
звание критической температуры хрупкости, или порога хладноломкости tп.
Чем выше скорость деформации, тем больше склонность металла к хрупкому разрушению. Все концентраторы напряжений способствуют хрупкому разрушению. С увеличением остроты и глубины надреза склонность к хрупкому разрушению возрастает. Чем больше размеры изделия, тем больше вероятность хрупкого разрушения (масштабный фактор).
2.9. Структураисвойстваметалловпринагреве послепластическойдеформации
Процессы, происходящие при нагреве, подразделяют на две основные стадии: возврат и рекристаллизацию. Обе стадии сопровождаются выделением теплоты и уменьшением свободной энергии.
Возвратом называют перестройку тонкой структуры и свойств, которые не сопровождаются изменением микроструктуры деформированного металла, т.е. размер и форма зерен при возврате не меняются.
Рекристаллизацией называют процесс образования и роста новых зерен с более совершенной структурой, за счет исходных деформированных зерен той же фазы.
Возврат, в свою очередь, подразделяют на две стадии: отдых и полигонизацию. Отдых при нагреве деформированных металлов происходит всегда, а полигонизация развивается лишь при определенных условиях.
Отдыхом холоднодеформированного металла называют стадию возврата, при которой уменьшается количество точечных дефектов, в основном вакансий; в ряде металлов, таких как алюминий и железо, отдых включает также переползание дислокаций, которое сопровождается взаимодействием дислокаций разных знаков и приводит к заметному уменьшению их плотности. Перераспределение дислокаций сопровождается также уменьшением остаточных напряжений. Отдых уменьшает удельное электрическое сопротивление и повышает плотность металла.
Полигонизацией называют стадию возврата, при которой в пределах каждого кристалла образуются новые малоугловые границы. Границы возникают путем скольжения и переползания дислокации; в результате кри-
Материаловедение. Учеб. пособие |
-78- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
сталл разделяется на субзерна – микрообъемы, свободные от дислокации
(рис. 2.22).
а
|
Рис. 2.22. Схема полигонизации накле- |
|
|
панного металла: а – до полигонизации; |
|
|
||
|
б – после полигониэации |
|
б |
||
|
Полигонизация в металлах технической чистоты и в сплавах – твердых растворах – наблюдается только после небольших степеней деформаций и не у всех металлов. Так, этот процесс редко развивается в меди и ее сплавах и хорошо выражен в алюминии, железе, молибдене и их сплавах. Полигонизация холоднодеформированного металла обычно приводит к незначительному уменьшению твердости и характеристик прочности.
Субзеренная структура, возникшая благодаря полигонизации, весьма устойчива и сохраняется почти до температуры плавления. После формирования блочной структуры рекристаллизация не наступает, полигонизация и рекристаллизация оказываются конкурентами.
Пластически деформированные металлы могут рекристаллизоваться лишь после деформации, степень которой превышает определенное критическое значение, которое называется критической степенью деформации. Если степень деформации меньше критической, то зарождения новых зерен при нагреве не происходит. Критическая степень деформации невелика (2–8 %); для алюминия она близка к 2 % , для железа и меди – к 5 %. На рис. 2.23 показано влияние степени деформации ε на размер зерна d, полученного при последующем отжиге. Максимальный размер зерна наблюдался при критической степени деформации, равной 1,8 %.
Материаловедение. Учеб. пособие |
-79- |
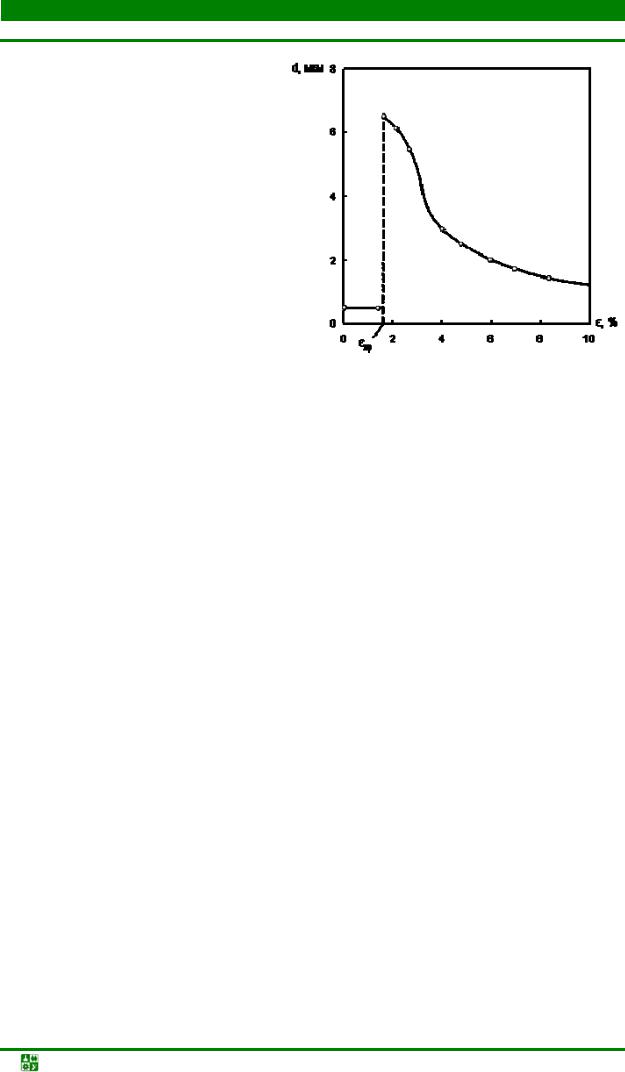
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
Рис. 2.23. Влияние степени деформации ε на размер зерна d, полученного при отжиге
Нагрев деформированных металлов и сплавов выше определенной температуры, называемой температурным порогом рекристаллизации, при-
водит к изменению структурного состояния, при котором происходит образование и рост новых зерен. Изменение структуры развиваются в следующей последовательности: первичная, собирательная и вторичная рекристаллизация. Температура рекристаллизации по правилу Бочвара составляет некоторую долю от температуры плавления металла:
Трекр = α Тпл, К.
Значение коэффициента α зависит от чистоты металла и степени пластической деформации. Для металлов химически чистых металлов α = 0,25–0,3; для сплавов α = 0,5–0,6.
Зарождение новых зерен при рекристаллизации происходит в участках с наибольшей плотностью дислокации, обычно на границах деформированных зерен. Чем выше степень пластической деформации, тем больше возникает центров рекристаллизации. Они представляют собой субмикроскопические области с минимальным количеством точечных и линейных дефектов строения. Эти области возникают путем перераспределения и частичного уничтожения дислокации; при этом между центром рекристаллизации и деформированной основой появляется высокоугловая граница.
С течением времени образовавшиеся центры новых зерен увеличиваются в размерах вследствие перехода атомов от деформированного окружения к более совершенной решетке; при этом высокоугловые границы новых зерен перемещаются в глубь наклепанного металла.
Рассмотренная стадия рекристаллизации называется первичной рекристаллизацией, или рекристаллизацией обработки. Первичная рекристаллизация заканчивается при полном замещении новыми зернами всего объема деформированного металла (рис. 2.24).
Материаловедение. Учеб. пособие |
-80- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
а |
б |
в |
г |
д |
Рис. 2.24. Схема изменения микроструктуры холоднодеформированного металла при нагреве: а – после деформации; б – начало первичной рекристаллизации; в – завершение первичной рекристаллизации; г, д – стадии собирательной рекристаллизации
По завершении первичной рекристаллизации происходит рост образовавшихся зерен при увеличении выдержки или температуры; эта стадия рекристаллизации называется собирательной рекристаллизацией. Этот процесс самопроизвольно развивается при достаточно высоких температурах в связи с тем, что укрупнение зерен приводит к уменьшению свободной энергии металла из-за уменьшения поверхностной энергии (чем крупнее кристаллы, тем меньше суммарная поверхность границ).
Рост зерен происходит в результате перехода атомов от одного зерна к соседнему через границу раздела; одни зерна при этом постепенно уменьшаются в размерах и затем исчезают, а другие становятся более крупными, поглощая соседние зерна. С повышением температуры рост зерен ускоряется. Чем выше температура нагрева, тем более крупными окажутся рекристаллизованные зерна.
Первичная рекристаллизация полностью снимает наклеп, созданный при пластической деформации; металл приобретает равновесную структуру с минимальным количеством дефектов кристаллического строения. Свойства металла после рекристаллизации близки к свойствам отожженного металла.
Деформирование металлов подразделяют на холодное и горячее в зависимости от температуры. Холодное деформирование проводят ниже температуры рекристаллизации, металл наклепывается и сохраняет наклеп. Горячее деформирование проводят выше температуры рекристаллизации, когда получаемый наклеп снимается одновременно протекающей рекристаллизацией. Если рекристаллизация не устраняет наклеп, то он сохраняется частично или полностью.
Пластичность и вязкость металлов и сплавов зависят от размера зерен. С уменьшением размера зерен вязкость улучшается. Размер зерен, образующихся в результате рекристаллизации, зависит в основном от степени пластической деформации и от температуры, при которой происходила рекристаллизация. Рис. 2.25 иллюстрирует зависимость размера рекристаллизованного зерна алюминия А7 от температуры отжига в течение 1 ч.
Материаловедение. Учеб. пособие |
-81- |
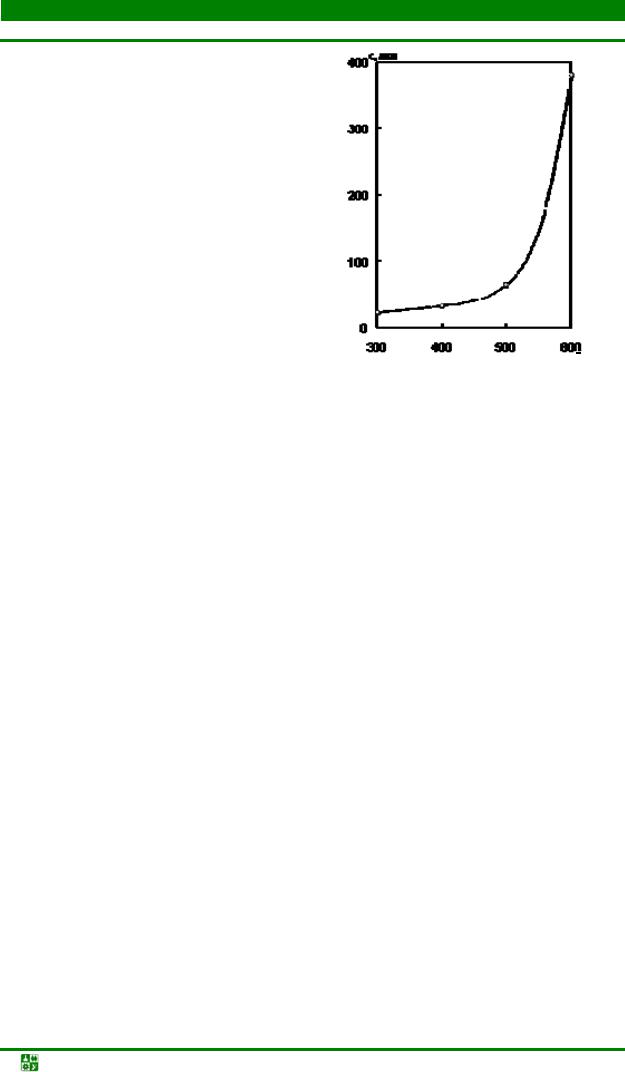
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
Рис. 2.25. Зависимость размера рекристал- |
|
лизованного зерна d алюминия А7 от |
Тотж, оС |
температуры отжига Тотж в течение 1 ч |
Увеличение выдержки при нагреве способствует росту зерен, но эффект значительно меньше, чем при повышении температуры нагрева. Зависимость размера зерен от степени деформации и температуры обычно демонстрируют при помощи диаграмм рекристаллизации (рис. 2.26).
Для конструкционных материалов общего назначения анизотропия свойств нежелательна. Рекристаллизованные сплавы, как правило, однородны по свойствам и анизотропии не обнаруживают. Однако при известных условиях в рекристаллизованном металле появляется предпочтительная ориентация зерен, которую называют текстурой рекристаллизации. Ее вид зависит от химического состава сплава, характера деформирования, природы и количества примесей, технологических факторов. Образование текстуры рекристаллизации имеет практическое значение для сплавов с особыми физическими свойствами, когда требуется улучшить то или иное свойство в определенном направлении изделия. Например, в листах трансформаторной стали образование текстуры дает возможность уменьшить потери на перемагничивание по определенным направлениям листа.
Материаловедение. Учеб. пособие |
-82- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
а |
б |
Рис. 2.26. Диаграммы рекристаллизации: а – зависимость размера зерна D рекристаллизованного металла от деформации (Dо – размер исходного зерна); б – диаграмма рекристаллизации технически чистого железа
Рекристаллизация многофазных сплавов представляет собой более сложный процесс, в котором на зарождении и росте новых рекристаллизованных зерен сказываются различия свойств каждой фазы, характер структуры и объемные соотношения между фазами, а также состав сплава. Особое значение имеют размер частиц второй фазы и среднее расстояние между частицами. Чем ближе друг к другу расположены частицы второй фазы, тем труднее перемещаться границе нового зерна и тем сильнее тормозится рекристаллизация. Это проявляется в повышении температуры рекристаллизации и увеличении времени для завершения первичной рекристаллизации многофазного сплава по сравнению с однофазным сплавом – твердым раствором аналогичного химического состава. Близость частиц второй фазы обеспечивается при достаточно высоком их содержании в сплаве. Когда частиц мало и они далеко друг от друга, их роль в рекристаллизации незначительна. Мелкие частицы размерами приблизительно 0,1 мкм и меньше тормозят рекристаллизацию. Более крупные частицы размерами свыше 0,1–0,5 мкм тормозят рекристаллизацию, когда располагаются близко друг к другу, и ускоряют ее, когда расстояние между ними увеличено. В последнем случае сказывается влияние межфазной границы, на которой преимущественно зарождаются новые зерна.
Тормозящее влияние дисперсных частиц второй фазы на рекристаллизацию успешно используется в промышленных сплавах для увеличения предельных рабочих температур. Присутствие в сплавах элементов антирекристаллизаторов повышают температуру рекристаллизации и способствуют формированию нерекристаллизованной структуры изделий и полуфабрикатов.
Сверхпластичное состояние металла проявляется при горячем деформировании материалов с ультрамелким зерном (0,5–10 мкм). При низких скоростях деформирования металл течет равномерно, не упрочняясь, относительные удлинения достигают 10–15 %.
Материаловедение. Учеб. пособие |
-83- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
Огромные деформации в сверхпластичном состоянии складываются из зернограничного скольжения, дополненного направленным (под действием напряжений) диффузионным переносом атомов и обычным скольжением внутри зерен. Для того чтобы реализовать сверхпластичное состояние, требуется не только получить ультрамелкие зерна, но и сохранить эту структуру в течение всего периода деформирования при температуре выше 0,5Тпл (порядка нескольких десятков минут). В однофазных сплавах зерна твердого раствора успевают вырасти за это время так, что сверхпластичность теряется. Промышленные сверхпластичные сплавы имеют двухфазную структуру (лучшее сочетание объемов обеих фаз 1:1; при этом максимальна поверхность межфазных границ) и поэтому сохраняют исходную мелкозернистость в течение всего срока изготовления изделий. К числу таких сплавов принадлежат различные эвтектические и эвтектоидные смеси и т.п.
Сверхпластичное состояние используют на практике для производства изделий весьма сложной формы при помощи пневматического формования листов или объемного прессования. Несмотря на медленность самого процесса формования и сравнительно высокие рабочие температуры, процесс выгоден, а в ряде случаев является единственным способом получения изделий, когда металл нужно без разрушения деформировать на 200–300 % и выше.
Контрольныевопросыизадания
1. Какие существуют отличия в строении жидкого и твердого метал-
ла?
2.Как изменяется объем при плавлении различных металлов?
3.Что означают понятия ближний и дальний порядок в расположении атомов? Каким фазовым состояниям присущ ближний и дальний порядок?
4.Из каких стадий состоит процесс кристаллизации?
5.Чтоявляетсятермодинамическимстимуломкристаллизацииметаллов?
6.Почему кристаллизация чистых металлов происходит в изотермических условиях?
7.Почему для начала процесса кристаллизации металлов необходимо переохлаждение?
8.Охарактеризуйте общее изменение свободной энергии системы при кристаллизации металлов. Из чего складывается объемная и поверхностная межфазная энергия?
9.Где образуются зародыши твердой фазы при гомогенной и гетерогенной кристаллизации металла?
10.Как изменяется суммарная свободная энергия системы в зависи-
мости от размера кристалла при разных степенях переохлаждения при кристаллизации?
11. Какой размер зародыша кристалла называется критическим?
Материаловедение. Учеб. пособие |
-84- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 2. Кристаллизация металлов и их фазовые превращения в твердом состоянии
12.Почему с увеличением степени переохлаждения при кристаллизации размер критического зародыша уменьшается?
13.Почему зародыши кристалла размером меньше критического растворяются в жидкости?
14.Изобразите кривые охлаждения металла при разных степенях ох-
лаждения.
15.Как зависят скорость образования центров кристаллизации n, и
линейная скорость роста кристаллов с от Т при затвердевании металлов?
16.Какие механизмы роста кристаллов возможны при затвердевании
металлов?
17.Каково строение межфазной границы раздела жидкость–кристалл
умеди и висмута?
18.Что способствует ускорению роста кристаллов при атомногладкой и межфазной поверхности жидкость–кристалл?
19.Опишите механизм роста кристаллов при гладкой и атомношероховатой межфазной поверхности жидкость–кристалл.
20.Какие формы роста при затвердевании принимают кристаллы чистых металлов?
21.Изобразите структуру сплава системы Cu–Ni после равновесной кристаллизации.
22.Какие превращения относятся к полиморфным превращениям?
23.Какие изменения в кристаллическом строении происходят при полиморфных превращениях железа?
24.Охарактеризуйте изменение свободной энергии системы при полиморфном превращении. Почему для начала процесса необходимо большее переохлаждение, чем при кристаллизации металлов?
25.В чем заключается принцип размерного и структурного соответствия при превращениях в твердом состоянии? Как он реализуется при полиморфном превращении железа и его сплавов?
26.Изобразите структуру металла после холодной деформации. Чем отличаетсятекстурадеформацииотволокнистойструктурыметалловисплавов?
27.Как изменяется структура деформированных металлов при нагревах после деформации?
28.Изобразите структуру металла после холодной деформации и рекристаллизационного отжига.
29.Как изменяются свойства холоднодеформированного металла после нагрева?
Материаловедение. Учеб. пособие |
-85- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава3. Фазовыеравновесия
вдвойныхитройныхсистемах
3.1.Основныетерминыипонятия
Свойства конструкционных материалов определяются их структурным и фазовым состоянием, которое зависит от химического состава сплавов, условий кристаллизации и фазовых превращений, протекающих при охлаждении от жидкого состояния до комнатной температуры, а также при термической обработке сплавов.
Фазовое и структурное состояние описывается графически диаграммами фазового равновесия. Важнейшую роль для характеристики состояния большого количества сплавов играют двойные, наиболее простые диаграммы, которые оказывается возможным изображать на плоскости.
Более сложными являются тройные системы. Для их графического представления требуется использование объемных изображений или их разрезов, сечений и проекций на площадь концентрационного треугольника. Трехкомпонентные диаграммы состояния более точно описывают фазовое и структурное состояние сплавов, которые чаще всего представляют собой многокомпонентные системы.
Двойные, тройные и многокомпонентные системы являются совокупностью фаз, главные из них – твердые растворы и промежуточные фазы.
Чистые металлы применяют в технике очень редко в связи с тем, что они в большинстве случаев не могут обеспечить необходимых значений механических и физических свойств, которые удается получить в сплавах.
В связи с изучением сплавов необходимо дать определение некоторым металлографическим понятиям.
Компонентами системы называют самостоятельные составляющие, из которых могут при определенных условиях образоваться все фазы данной системы и которые не могут превратиться друг в друга, но имеют возможность переходить из одной фазы в другую.
Фазой называют однородные составные части сплава (системы), имеющие одинаковый состав, одно и то же агрегатное состояние и отделяющиеся от остальных частей поверхностями раздела.
Системой называется совокупность фаз в сплаве, находящихся в состоянии стабильного либо метастабильного равновесия.
Структурная составляющая – это гомогенная или квазигомогенная составляющая системы, состоящая из одной или нескольких фаз, имеющая характерное регулярное строение, форму и одинаковый средний химический состав.
Система может быть простой или сложной. Простая система состоит из одного компонента, например, из железа или одного химического соединения, например, Fe3C. Сложная система включает в себя два или более компонентов. Например, система Pb–Sb является двойной, а система Al–Cu–Mn – тройной и т.д. Простая система может быть однородной, т.е. состоящей из
Материаловедение. Учеб. пособие |
-86- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
одной фазы, например вода (жидкость) и неоднородной, состоящей из двух или трех фаз, например вода, лед (жидкость + твердое тело); или пар, вода, лед (жидкость + твердое тело + газ). Фазовое состояние системы, составленной из двух компонентов, в зависимости от внешних условий может характеризоваться диаграммой состояния или (что то же самое) диаграммой фазового равновесия.
Система называется равновесной, если в ней изменение фазового состояния при изменении внешних условий совершается обратимо, т.е. когда процессы при изменении состояния системы в одном направлении в точности возмещаются процессами, происходящими при изменении системы в обратном направлении.
Зависимость между числом фаз системы, числом ее компонентов и числом внешних независимых переменных определяется правилом фаз.
В общем случае правило фаз Гиббса выражается следующим уравнени-
ем
С = К – Ф + П,
где С – число степеней свободы или вариантность системы; К – количество компонентов системы; Ф – количество фаз в системе; П – количество независимых переменных.
Внешними независимыми переменными является температура и давление. Действие каких-либо дополнительных параметров увеличивает значение П (каждый на единицу). В металлографии при рассмотрении конденсированных систем (твердых тел, жидкостей) давление не оказывает решающего влияния на состояние системы, поэтому внешним независимым фактором является температура, при этом П = 1 и С = К – Ф + 1.
Вариантность системы не может быть отрицательной. Для равновесия системы необходимо, чтобы количество фаз в структуре не превышало числа компонентов более чем на 1, т.е. чтобы Ф < К + 1.
В том случае, когда в равновесии находится максимальное количество фаз, т.е. Ф = К + 1 и С = 0, система называется безвариантной, или нонвариантной. Примером такой системы является кристаллизация, аллотропическое превращение в чистом металле, где Ф = 2 при К = 1, а также эвтектическое или перитектическое превращение в двухкомпонентной системе, где Ф = 3 [L + (α + β)], при К = 2. Система, в которой С = 1, т.е. когда Ф = К, является одновариантной, или моновариантной. Примером является кристаллизация твердогораствора. ПриС= 2 системадвухвариантная, илибивариантная.
3.2. Фазывметаллическихсистемах исистемахметалловинеметаллов
Твердые фазы в металлографии принято делить на два основных вида: твердые растворы и промежуточные фазы. Среди промежуточных фаз, кроме того, можно выделить группу собственно химических соединений.
Материаловедение. Учеб. пособие |
-87- |
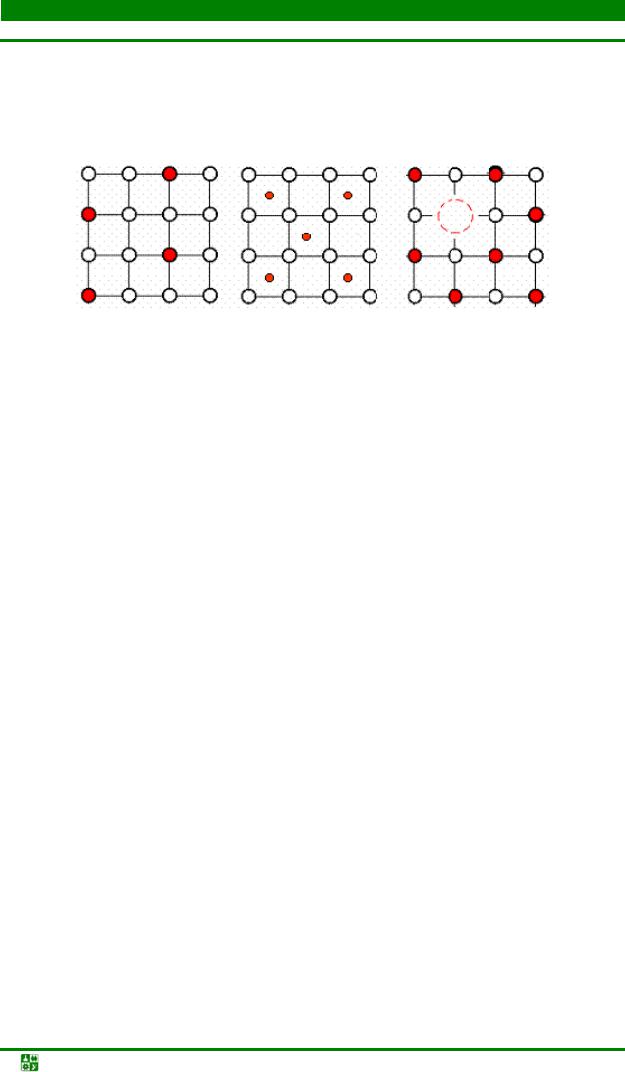
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Твердые растворы – это такие твердые фазы в сплавах, которые образованы на основе кристаллической решетки компонента-растворителя (рис. 3.1). При этом атомы растворенного вещества занимают определенные места в решетке растворителя.
а |
б |
в |
Рис. 3.1. Типы твердых растворов: а – замещения; б – внедрения; в – вычитания
Если содержание растворенного вещества невелико, то твердый раствор по свойствам мало отличается от металла растворителя. Атомное строение твердого раствора такое же, как и металла растворителя. Различие заключается только в изменении периода решетки.
Различают непрерывные твердые растворы (растворы замещения) и ограниченные (растворы замещения, внедрения и вычитания).
Твердые растворы замещения (рис. 3.1, а) образуются путем замены атомов растворителя в его кристаллической решетке атомами растворенного компонента.
На образование неограниченных твердых растворов влияют несколько факторов:
1.Тип кристаллической решетки растворителя и растворенного вещества (при этом оба компонента должны обладать одинаковым типом кристаллических решеток, этому условию удовлетворяют в основном металлы, расположенные в одних и тех же группах периодической системы Менделеева в пределах одного периода или близких групп или периодов).
2.Электронная концентрация твердого раствора – отношение числа валентных электронов к числу атомов (непрерывные твердые растворы могут быть образованы в том случае, если электронная концентрация для каждой кристаллической решетки не превышает критическую, для гранецентрированной кубической решетки эта величина составляет 1,36, для объемноцентрированной – 1,48).
3.Соотношение атомных размеров компонента раствора (непрерывные твердые растворы могут быть образованы, если различие в диаметрах атомов компонентов не превышает 14-15 %, однако иногда даже при таких соотношениях атомных диаметров непрерывный ряд твердых растворов не образуется).
Материаловедение. Учеб. пособие |
-88- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
При отклонении от этих правил могут возникать ограниченные твердые растворы замещения. Твердые растворы замещения, в которых атомы растворенного вещества занимают любые из мест в кристаллической решетке растворителя, располагаясь произвольно, называют неупорядоченными.
При определенных условиях, например, в результате медленного охлаждения сплавов до температуры ниже точки Курнакова, некоторые плоскости кристаллической решетки могут оказаться обогащенными атомами одного из компонентов, причем это расположение носит закономерный характер в макрообъеме сплава. Такой твердый раствор называется упорядоченным, или сверхструктурой.
Упорядоченные твердые растворы по существу представляют собой фазы, промежуточные между обычными неупорядоченными растворами и химическими соединениями. При упорядочивании значительно уменьшается удельное электросопротивление, повышается твердость, предел прочности, снижается пластичность.
Иногда достижение полного порядка в твердом растворе оказывается затруднительным. В этом случае сталкиваются с понятием частичной упорядоченности. Количественная оценка этой величины выражается степенью упорядоченности, под которой понимается отношение числа атомов, расположенных упорядоченно к общему числу атомов в кристаллической решетке. Она изменяется в пределах от 0 до 1.
Твердые растворы внедрения (рис. 3.1, б) образуются путем размеще-
ния атомов растворенного компонента в свободных промежутках между атомами решетки растворителя, пустотах. Растворы внедрения получаются, если отношение атомных диаметров растворенного элемента и растворителя < 0,59. Как правило, растворы внедрения образуются на базе переходных металлов (Fe, Co, Mn и др.) в которых растворяются металлоиды (C, H, O, N) с малыми атомными диаметрами.
В таких системах образуются промежуточные фазы внедрения, которые необходимо отличать от растворов внедрения.
Твердые растворы вычитания, или растворы с «дефектной» решеткой (рис. 3.1, в), образуются только на базе химических соединений (промежуточных фаз). В твердых растворах вычитания избыточные (относительно среднего состава соединения) атомы одного из компонентов занимают нормальные места в кристаллической решетке, иногда как места, которые должны были бы быть заняты другим компонентом, оказываются частично свободными. Аналогичной структурой обладает раствор кислорода в закиси железа FeO.
Группа химических соединений и промежуточных фаз включает сле-
дующие разновидности: химические соединения с нормальной валентностью; фазы никель-арсенидного типа; электронные соединения; фазы внедрения; σ- фазы (сигма-фазы); фазы Лавеса.
Химические соединения с нормальной валентностью образуются между элементами с резко металлическими свойствами и элементами, переходными к металлоидам. Формулы этих соединений могут быть подсчитаны по валентностям компонентов. Эти химические соединения образуют особую кристаллическую решетку, отличную от решеток входящих в него компонентов,
Материаловедение. Учеб. пособие |
-89- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
с наличием ионных связей. Такие химические соединения характеризуются почти полным отсутствием растворимости компонентов в твердом состоянии. На диаграмме состояния они выражаются ординатой, соответствующей составу химического соединения. Области гомогенности, примыкающие к линии состава соединения, отсутствуют. Химические соединения, как правило, обладают более высокой твердостью, чем каждый из отдельных элемен-
тов NaCl, Mg2Si, AuAl2.
Фазы никель-арсенидного типа являются переходной ступенью от фаз металлического характера к химическим соединениях с явно выраженной ковалентной связью. Эти фазы образуются в результате взаимодействия одновалентных или двухвалентных металлов (Cu, Ag, Zn, Al) или переходных с простыми металлами с высокой валентностью (от 4 до 6) или металлоидами. Они являются фазами переменного состава; на диаграммах состояния им соответствуют однофазные области. Кристаллические решетки этих фаз могут быть типа замещения, внедрения или вычитания. Плавление происходит аналогично устойчивому или неустойчивому химическому соединению. Приме-
ры: ZnS, AlP, BeTe, CdSe.
Фазы внедрения образуются путем соединения переходных металлов (Mo, W, Zr, Ti, Ta, Pd, V, Nb и др.) с углеродом, азотом, водородом и бором, с образованием карбидов, нитридов, гидридов и боридов. Отношение диаметров атомных радиусов металлоида и металла обычно колеблется в пределах 0,41–0,59, при этом решетки фаз внедрения могут быть: кубической гранецентрированной (К = 12), кубической объемно-центрированной (К = 8), гексагональной плотноупакованной (Г = 12) или простой гексагональной решеткой (Г = 8). При отношении диаметров атомов > 0,59 образуются соединения со сложными кристаллическими решетками, не соответствующие структуре фаз внедрения.
Особенностями фаз внедрения, по сравнению с твердыми растворами внедрения, является то, что они часто имеют кристаллические решетки, отличные от кристаллических решеток металла, на основе которого они образуются. Фазы внедрения имеют металлический характер. Обычно их электропроводность высока и некоторые из них обладают сверхпроводимостью. Фазы внедрения имеют переменный состав. Изменение состава происходит в основном за счет растворения металлических компонентов. Кроме того фазы внедрения с однотипными кристаллическими решетками образуют между собой непрерывные ряды твердых растворов (TiC – VC; TiC – NiN и др.). Фазы внедрения обладают высокой температурой плавления и очень высокой твердостью, близкой к твердости алмаза.
Соединения между двумя (или более) типичными металлами называются интерметаллидами. Типичными интерметаллидами являются электронные соединения, σ-фазы и фазы Лавеса.
Электронными соединениями называют такие соединения двух металлов, которые характеризуются постоянной электронной концентрацией, т.е. постоянным отношением числа валентных электронов к общему числу атомов.
Существуют три значения электронной концентрации, соответствующие различным фазам: 3/2; 21/13 и 7/4. CuZn (1 1 + 1 2):2 = 3/2; Cu5Sn (5 1 + 1 4):6 = = 3/2; Cu3Al (3 1 + 1 3):4 = 3/2.
Материаловедение. Учеб. пособие |
-90- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
При концентрации 3/2 получается β-фаза, которая в различных соединениях может иметь объемно-центрированную кубическую решетку CuZn (основная), сложную кубическую решетку CuSi (20 атомов) или гексагональную плотноупакованную AgZn. При концентрации 21/13 образуется γ-фаза со сложной кристаллической решеткой, α-Mn, состоящей из 52 атомов (Cu5Zn8). При концентрации 7/4 образуется ε-фаза с гексагональной плотноупакованной решеткой (CuZn3).
Электронные соединения способны растворять в твердом состоянии избыток каждого из компонентов и давать, таким образом, твердые растворы. Чем больше разница в атомных диаметрах, тем меньше растворимость компонентов. Однако электронные соединения вплоть до температуры плавления проявляют свойства химического соединения. Они имеют резко выраженный максимум на линии ликвидуса, а также могут плавиться инконгруэнтно. Образование соединений происходит с большим выделением тепла. Однако электронные соединения нельзя отнести ни к твердым растворам, ни к химическим соединениям. Они представляют собой специфические промежуточные металлические фазы.
Сигма-фазы (σ-фазы) образуются при взаимодействии двух переходных металлов (Fe–Mo, Fe–W, Fe–Cr, Cr–Mn и т.д.). Устойчивые σ-фазы образуются в основном при разнице атомных размеров не более 8 %. При увеличении ее выше 10 % σ-фаза оказывается стабильной при высокой температуре и распадающейся при охлаждении по эвтектоидной реакции. Сигма-фаза может быть устойчивой до температуры плавления, а может распадаться по перитектической реакции. Решетка σ-фазы имеет слоистую тетрагональную решетку, содержащую 30 атомов.
Фазы Лавеса являются фазами практически постоянного состава. В этих фазах отсутствует или очень мала растворимость металловкомпонентов, образующих рассматриваемое соединение. Эти фазы образуются при большом различии атомных диаметров компонентов (около 20 %). Их компоненты могут принадлежать к любой группе таблицы Менделеева. Образование фаз не подчиняется законам валентности. Эти соединения образуют кристаллы кубической или гексагональной симметрии. Большинство фаз Лавеса плавятся по перитектической реакции. Примеры фаз Лавеса: TiFe2, CaMg2, AgBe2 и т.д.
3.3.Понятияодиаграммахфазовогоравновесия
Кнастоящему времени построено несколько тысяч двойных диаграмм состояния, соответствующих фазовому равновесию в системах между почти всеми известными элементами периодической системы Д.И. Менделеева, главными из которых являются металлы, активно взаимодействующие между собой, а также с неметаллическими веществами. Знание диаграмм фазового равновесия позволяет создавать новые сплавы, управлять их структурой на основе регулирования химического состава и создания различных технологических процессов их получения и обработки.
Материаловедение. Учеб. пособие |
-91- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Очень большое число известных двойных и более сложных диаграмм состояния требует классификации их видов в связи с развивающимися в реальных системах различными фазовыми превращениями как при кристаллизации жидкости, так и в твердом состоянии в условиях развития фазовых переходов.
Классифицируя двойные диаграммы состояния по типам превращений, протекающих при кристаллизации и формировании структуры сплавов в твердом состоянии, целесообразно рассмотреть классы диаграмм, описывающих кристаллизацию твердых растворов, развитие эвтектического и перитектического превращений, образование промежуточных фаз, расслоение жидких и твердых растворов, а также развитие полиморфных и иных превращений в твердом состоянии.
Основными методами, используемыми для построения диаграмм состояния, являются термический, микроструктурный и рентгеноструктурный методы. К числу дополнительных методов относятся: исследование микротвердости структурных составляющих, механические свойства, определение электропроводности, теплопроводности, дилатометрический и магнитный методы, а также применение радиоактивных изотопов.
Наиболее наглядным и простым методом построения диаграмм состояния является термический метод, заключающийся в исследовании кинетических кривых охлаждения сплавов различных составов. Наблюдая по пирометру изменение температуры при медленном охлаждении металла и откладывая на графике это снижение температуры в зависимости от времени, получают серии кривых для каждого из сплавов исследуемых систем (рис. 3.2).
а
б
Рис. 3.2. Построениедиаграммфазовогоравновесиясприменениемтермического анализа: а – в системе без растворимости компонентов в твердом состоянии;
б– с непрерывным рядом твердых и жидких растворов; 1–4 – номера сплавов
исоответствующие им термические кривые для разных типов диаграмм
Материаловедение. Учеб. пособие |
-92- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Существование горизонтальной площадки на кривой охлаждения чистого металла при его затвердевании или аллотропическом превращении вытекает из правила фаз, поскольку вариантность системы при этом С = 0. Такую же площадку имеет кривая и при протекании эвтектического превращения. На термических кривых кристаллизации сплавов 2 и 4 перед горизонтальными участками наблюдается изменение наклона кривых охлаждения, что соответствует выделению кристаллов компонентов А или В из жидкой фазы, происходящему в интервале температур. В системе с непрерывным рядом жидких и твердых растворов все термические кривые сплавов (за исключением чистых компонентов) однотипны. Кристаллизация всех сплавов диаграммы полностью происходит в интервале температур. Следовательно, по правилу фаз вариантность в этих случаях равна С = 2 – 2 + 1 = 1, где в равновесии находятся две фазы во всем температурном интервале кристаллизации твердого раствора (L + α).
Для построения диаграммы фазового равновесия обнаруженные на термических кривых критические точки (точки перегиба, температуры ступенек) наносят на диаграммное поле в координатах состав – температура и соединяют их плавными кривыми.
Кривые, разграничивающие жидкое состояние сплава от твердо-жидкого и являющиеся линиями начала кристаллизации, называют линиями ликвидуса. Выше этих линий сплавы находятся в жидком состоянии. Линии, ниже которых сплавы находятся в твердом состоянии, называются линиями солидуса.
Построенные с помощью термического метода диаграммы уточняются различными методами металлографического исследования и измерениями физико-механических свойств сплавов, составляющих данную систему. Диаграммы состояния дают в сжатой и наглядной форме картину строения и свойств сплава при изменении его концентрации и температуры, позволяют определить температуру плавления, затвердевания и аллотропических превращений в сплавах, дают возможность изучить происхождение структур, наблюдаемых под микроскопом, и увязать их структуру с механическими технологическими и физико-химическими свойствами. При изыскании новых сплавов диаграммы позволяют заменить старый рецептурный метод новым, научным методом, при помощи которого можно скорее и лучше подобрать их оптимальный состав.
Практическим недостатком диаграмм состояния (диаграмм фазового равновесия) является то, что они не содержат фактора времени и соответствуют только условиям равновесия, т.е. условиям очень медленного нагрева и охлаждения. В производственных условиях применяют большие скорости охлаждения, при которых критические точки резко изменяют свое положение, а в ряде случаев могут изменяться даже формы фазовых переходов.
Материаловедение. Учеб. пособие |
-93- |
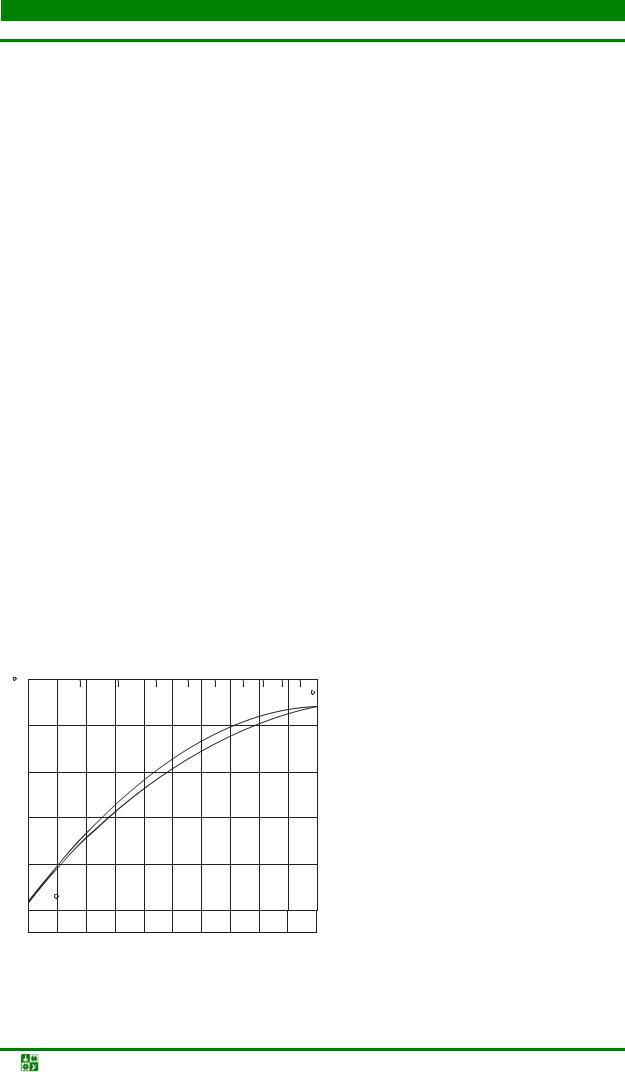
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
3.4. Диаграммасостоянияснеограниченной растворимостьювжидкомитвердомсостояниях
Образование твердых растворов свойственно большинству компонентов, образующих двойные и более сложные системы. Поэтому рассматриваемые ниже механизмы и особенности кинетики кристаллизации твердых растворов свойственны многим диаграммам состояния. Следует иметь, однако, в виду, что степень проявления этих механизмов кристаллизации может оказаться различной в связи с разной растворимостью компонентов друг в друге, поскольку, наряду с системами с непрерывными рядами жидких и твердых растворов, большинство систем проявляет ограниченную растворимость между компонентами. Но даже диаграммам состояния, соответствующим непрерывным рядам твердых растворов, свойственны некоторые особенности формы ликвидуса и солидуса, которые могут образовывать точки экстремума с максимумом температуры плавления или минимумом при определенных соотношениях между компонентами.
Ниже рассматриваются в первую очередь диаграммы с неограниченной растворимостью. Далее будут рассмотрены диаграммы состояния различного типа, в которых наличие взаимной ограниченной растворимости потребует учитывать это явление при рассмотрении процессов кристаллизации и формировании соответствующих структур в твердом состоянии.
Следует также помнить, что образование в системах твердых растворов является теоретическим основанием развития диффузионных процессов в твердых телах.
Типичными представителями диаграмм с непрерывным рядом твердых и жидких растворов являются системы медь–никель, серебро–золото, палла- дий–платина и др. (рис. 3.3).
|
|
|
|
Pt, % (по массе) |
|
|
|
|
|
|
||
0 |
|
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
|
Т, С |
|
|
|
|
|
|
|
|
|
1769 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1750 |
|
|
|
Ж |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
1700 |
|
|
|
|
|
|
|
|
|
|
|
|
1650 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
(Pd, Pt) |
|
|
|
|
|
|
1550 |
1550 |
|
|
|
|
|
|
|
|
|
|
Рис. 3.3. Диаграмма состояния системы |
0 |
10 |
20 |
30 |
40 |
50 |
60 |
70 |
80 |
90 |
100 |
Pd–Pt с непрерывным рядом жидких |
|
Pd |
|
|
|
Pt, % (am.) |
|
|
|
|
Pt |
и твердых растворов |
||
|
|
|
Материаловедение. Учеб. пособие |
-94- |
||||||||
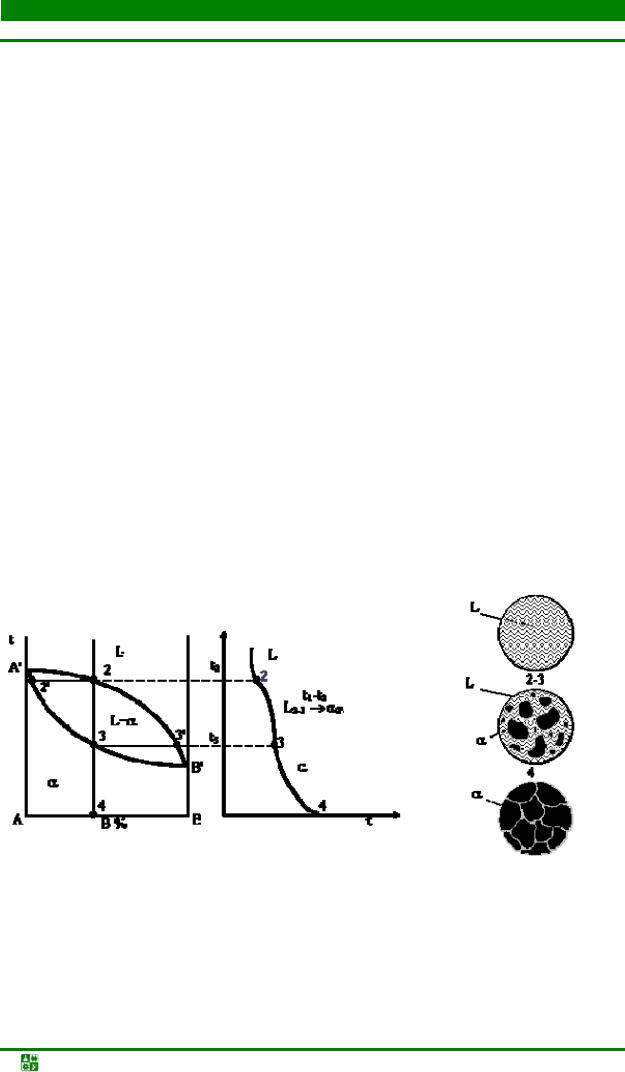
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Диаграмма фазового равновесия с неограниченной растворимостью в жидком и твердом состоянии, построенная в координатах температура–состав, состоит из двух линий: верхняя соответствует началу кристаллизации всех сплавов системы (ликвидус), а нижняя – концу их кристаллизации (солидус) (рис. 3.4). Выше ликвидуса расположена область однородного жидкого раствора, L ниже солидуса – область однородного α-твердого раствора. Между ликвидусом и солидусом заключена двухфазная область (L + α).
Кристаллизация твердых растворов, фазовые превращения в сплавах.
Все сплавы данной системы кристаллизуются в интервале температур с образованием α-фазы со структурой твердого раствора. Равновесная структура сплава формируется, вследствие того, что при кристаллизации в полном объеме успевают завершаться процессы формирования кристаллов, а также диффузионные процессы, обеспечивающие достижение равновесных концентраций твердой и жидкой фаз в течение всего периода затвердевания сплава.
Рассмотрим последовательность затвердевания сплава (рис. 3.4) и диффузионные процессы, реализуемые при равновесной кристаллизации. Выше ликвидуса сплав находится в состоянии ненасыщенного жидкого раствора. При охлаждении жидкого сплава до температуры ликвидуса (точка 2), жидкий раствор оказывается предельно насыщенным наиболее тугоплавким компонентом (в рассматриваемой системе компонентом А). Переохлаждение ниже точки 2 приводит к появлению первого, очень тонкого зародыша α- твердого раствора, который преимущественно приобретает форму разветвленного дендритного кристалла.
Рис. 3.4. Диаграмма состояния системы с непрерывным рядом жидких и твердых растворов. Кривая охлаждения, структура сплава
Чтобы определить состав фаз в двухфазной области, необходимо провести коноду – горизонтальную линию до пересечения с линиями диаграммы, соответствующую заданной температуре. Концы коноды (точки пересечения с соответствующими линиями) на линиях ликвидуса и солидуса пока-
Материаловедение. Учеб. пособие |
-95- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
зывают состав жидкой и твердой фаз. В соответствии с конодой состав первого зародыша в момент начала кристаллизации твердого раствора определяется точкой 2' на линии солидус фазовой диаграммы.
Особенности диффузионных процессов в фазах системы при кри-
сталлизации твердых растворов. Первый зародыш возникает флуктуационно без обеднения окружающей жидкости по компоненту А, составляющему основу твердого раствора. Однако рост зародыша в условиях даже небольшого переохлаждения ниже линии ликвидус требует опережающего переноса компонента А, по сравнению с компонентом В, через межфазную границу от жидкого раствора к твердому. Такой перенос веществ через границу раздела фаз (разделительная диффузия) является одним из диффузионных процессов, развивающихся при кристаллизации. Разделительная диффузия обеспечивает поддержание равновесных концентраций фаз в непосредственной близости от межфазной границы жидкость–кристалл. Равновесные концентрации компонентов на межфазной границе определяются точно с помощью коноды по кривым ликвидуса и солидуса, практически независимо от условий кристаллизации. Процесс разделительной диффузии характеризуется переносом веществ на очень малых диффузионных путях (единичный атомный перескок от жидкости к поверхностному атомному слою твердого кристалла). Поэтому разделительная диффузия происходит с большими скоростями. Она обеспечивает поддержание равновесных концентраций компонентов сплава в жидкой и твердой фазах, контактирующих между собой, по крайней мере, в моноатомных слоях, примыкающих к межфазной границе. Равновесные концентрации устанавливаются даже в условиях очень больших скоростей охлаждения при кристаллизации.
Таким образом, рост кристалла в жидкости в условиях переохлаждения сопровождается быстрым уменьшением концентрации прилежащего слоя жидкого раствора до равновесной концентрации, соответствующей новой более низкой температуре в период охлаждения. При этом жидкость вдали от межфазной границы еще имеет состав, отвечающий равновесной концентрации на предыдущей температурной стадии.
Поэтому в жидкости создается градиент концентрации, который становится движущим фактором второго обязательного диффузионного процесса, развивающегося в период кристаллизации – гомогенизирующей диффузии в жидкости. Данная диффузия обеспечивает выравнивание жидкости по составу, но нарушает при этом равновесную концентрацию на межфазной границе.
Восстановление равновесия достигается путем кристаллизации нового слоя твердого раствора за счет разделительной (обменной) диффузии на границе раздела фаз. Такая последовательность диффузионных процессов должна привести к устранению градиента концентрации по сечению жидкости и установлению во всем ее объеме одинаковой концентрации, соответствующей равновесной для данных температурных условий.
Для полного завершения таких процессов требуется время, контролируемое скоростью диффузии компонентов в жидком растворе на относительно большие расстояния. Поэтому эти процессы протекают медленнее, чем
Материаловедение. Учеб. пособие |
-96- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
обменная диффузия на границе раздела фаз. При непрерывном охлаждении в кристаллизационном интервале температур рассмотренные процессы, приводящие к равновесию в жидкости, могут протекать лишь при относительно малых скоростях охлаждения.
Рассмотрим процесс кристаллизации в этих же температурных условиях, но со стороны твердого растущего кристалла. При переохлаждении до более низкой температуры, чем точка 2, образующийся новый моноатомный слой твердой фазы на подложке первого, затвердевшего при более высокой температуре кристалла, имеет состав, отвечающий новой равновесной концентрации. А состав ранее выпавшего слоя твердого раствора остается с исходной концентрацией, полученной на предыдущем этапе кристаллизации в соответствии с линией солидуса.
Таким образом, внутри растущего твердого кристалла также устанавливается градиент концентрации, который становится движущим фактором выравнивающей (гомогенизирующей) диффузии внутри твердого растущего кристалла. Этот массоперенос внутри растущего кристалла является третьим обязательным диффузионным процессом, обеспечивающим равновесные условия кристаллизации твердых растворов.
Диффузионный перенос компонента В от поверхности в глубь кристалла нарушает равновесную концентрацию твердого раствора на межфазной границе. Равновесие восстанавливается за счет обменной диффузии на границе раздела фаз. При этом происходит кристаллизация нового моноатомного слоя твердого раствора с равновесной концентрацией.
Гомогенизирующая диффузия в твердой фазе является наиболее медленно протекающим процессом по сравнению с двумя ранее рассмотренными, а именно разделительной (обменной) диффузией на межфазной границе и гомогенизацией жидкости. Поэтому формирование равновесной структуры однородного твердого раствора будет контролироваться скоростью течения именно этого последнего процесса.
Равновесная структура сплава системы Cu–Ni с непрерывным рядом жидких и твердыхрастворовпредставленанарис. 3.5.
При понижении температуры от точки 2 до точки 3, с учетом рассмотренных диффузионных процессов при кристаллизации, в сплаве увеличиваются размеры и количество кристаллов α-твердого раствора. Расчет количества твердой и жидкой фаз при любой температуре в интервале кристаллизации определяется с помощью правила рычага, или правила отрезков, а составы твердой и жидкой фаз – по прави-
лу коноды. Количество твердой фазы, в соответствии с правилом рычага, рассчитывают как отношение отрезка, примыкающего к составу жидкой фазы, к длине всего рычага (коноды), а количество жидкой фазы – как отно-
Материаловедение. Учеб. пособие |
-97- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
шение отрезка, примыкающего к составу твердой фазы, к длине всего рычага.
Равновесие жидкости и α-кристаллов при затвердевании сплава является моновариантным: С = К – Ф + 1 = 2 – 2 + 1 = 1 и реализуется в некотором интервале температур. На кривой охлаждения сплава отмечаются две критические точки (перегибы), связанные с температурами начала и конца кристаллизации. При затвердевании твердого раствора выделяется скрытая теплота кристаллизации, и поэтому на кривой охлаждения сплавов в интервале температур наблюдается выпуклый криволинейный участок. В результате кристаллизации и последующего охлаждения сплава, в условиях, обеспечивающих достижение фазового равновесия в системе, образуется структура однородного α-твердого раствора. Последовательность этапов фазовых и структурных превращений при кристаллизации и охлаждении сплава показана на рис. 3.4.
3.5. Диаграммысостоянияэвтектическоготипа
Двухкомпонентные системы без растворимости (практически) в
твердом состоянии. В системе эвтектического типа данного типа (рис. 3.6) из жидкости при затвердевании выпадают чистые компоненты А и В, не образующие в твердом состоянии растворов и соединений. Относительно чистые, поскольку между любыми веществами всегда присутствует хотя бы ничтожно малое физико-химическое взаимодействие. Это требует называть образующиеся структурные составляющие типа смесей физико-химической смесью, а не механической, как неправильно характеризуют такие структуры некоторые авторы. Такая диаграмма характеризуется понижением температуры плавления при введении в каждый из компонентов (А или В) некоторого количества второго элемента. Кривые ликвидус пересекаются при некоторой минимальной температуре. Точка их пересечения называется эвтектической точкой. Горизонтальная линия, проходящая через эвтектическую точку, на-
зывается эвтектической линией, или линией эвтектики.
Пример диаграммы эвтектического типа без растворимости приведен на рис. 3.6. Эвтектический сплав II (точка Е) в условиях стабильного равновесия плавится и затвердевает при постоянной температуре, которая назы-
вается эвтектической.
Вся диаграмма состоит из четырех областей. Выше линии A'ЕB' сплавы находятся в виде однородного жидкого раствора. В области A'Еа – смесь жидкой фазы и кристаллов компонента А. В области B'Eв – твердожидкое состояние, состоящее из жидкой фазы и кристаллов компонента В. Ниже линии эвтектики аEв сплавы находятся в твердом состоянии. Сплавы от точки а до точки Е относятся к доэвтектическим, а от точки Е до точки в – к заэвтектическим. Структура сплава I состоит из первичных кристаллов компонента А и эвтектики (А + В), являющейся физико-химической смесью мелкодисперсных частиц компонента А и компонента В. Структура сплава III состоит из первичных кристаллов В и эвтектики (А + В).
Материаловедение. Учеб. пособие |
-98- |
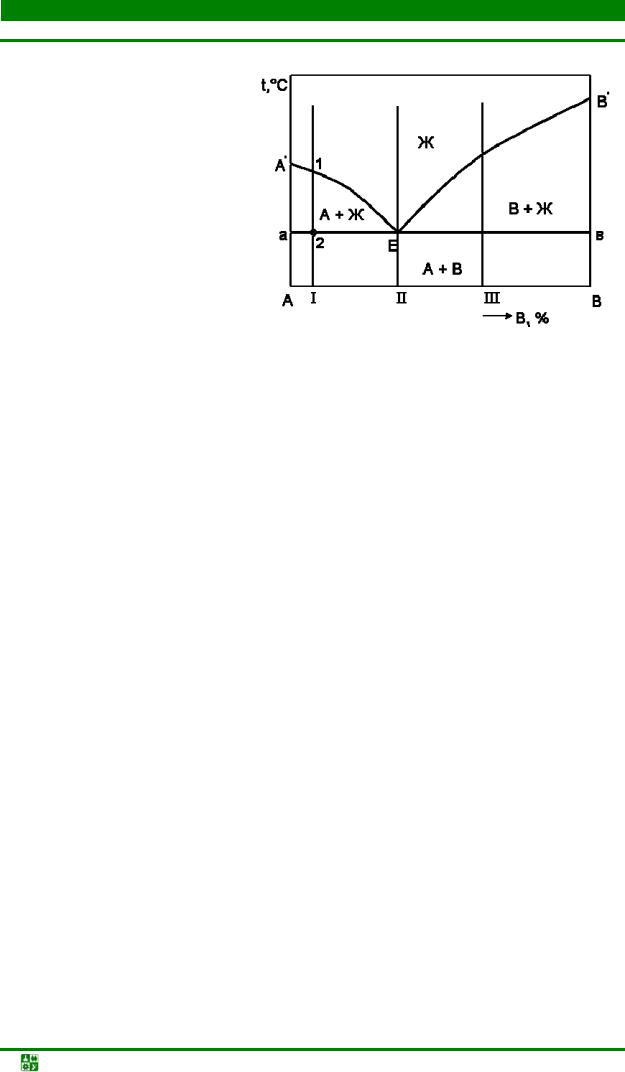
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Рис. 3.6. Диаграмма эвтектического типа без растворимости в твердом состоянии
Сплавам системы эвтектического типа свойственны следующие превращения при охлаждении. В доэвтектическом сплаве, охлажденном из жидкого состояния, по достижении температуры линии A'Е начинается выделение твердых кристаллов. Чтобы определить состав фаз при данной температуре необходимо провести горизонтальную линию, соответствующую заданной температуре (коноду). Перемещения концов коноды вдоль пересекающих ее кривых определяет состав фаз. Твердой фазой в данном случае является кристаллы компонента А, состав жидкой фазы определяется кривой A'Е. Относительное количество твердой и жидкой фаз вычисляется по правилу рычага, согласно которому количество твердой фазы определяют отношением длины плеча, примыкающего к составу жидкой фазы, к длине всего рычага, а для определения количества жидкой фазы - отношением длины рычага, примыкающего к составу твердой фазы, к длине всего рычага (коноды).
При охлаждении сплава I ниже линии ликвидус из жидкой фазы выделяются избыточные кристаллы А до тех пор, пока система не достигает температуры эвтектического превращения. Количество оставшейся незакристал-
лизованной жидкой фазы при эвтектической температуре составляет аЕa2 . Со-
став ее, изменяясь по линии A'Е, при температуре точки Е достигает эвтектического состава, и при этой температуре часть жидкости кристаллизуется по эвтектическому механизму, согласно которому происходит одновременная кристаллизация переплетающихся в виде регулярно чередующегося бикристалла компонента А и компонента В. Ранее выпавшие первичные кристаллы компонента А оказываются окруженными этой тонко-дифференцированной эвтектической физико-химической смесью.
Чисто по эвтектическому механизму кристаллизуется лишь II сплав. Кристаллизация заэвтектического сплава III начинается выделением избыточных кристаллов компонента В. Состав твердой и жидкой фаз и их относительное количество определяется тем же способом, что и для доэвтектического сплава.
Материаловедение. Учеб. пособие |
-99- |
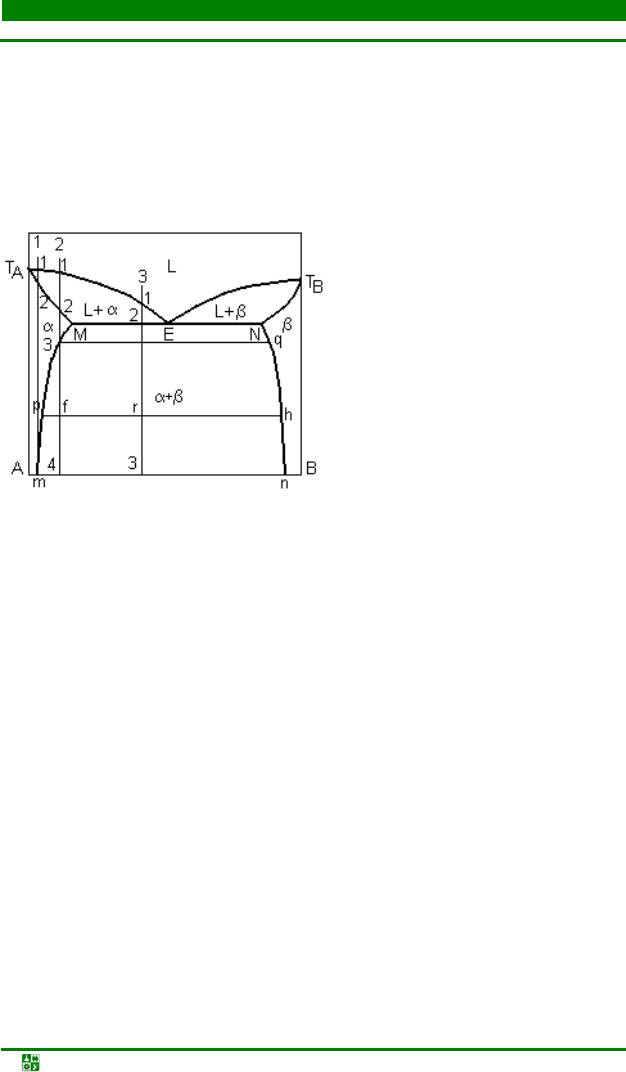
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Двухкомпонентные системы с ограниченной растворимостью в твердом состоянии. За исключением небольшого числа компонентов, образующих непрерывные ряды твердых и жидких растворов, большинство металлов ограниченно растворяются друг в друге. Поэтому, в системах таких компонентов области ограниченных твердых растворов разделяются двухфазными областями смесей этих твердых растворов. Такие области могут иметь вид эвтектической системы (рис. 3.7).
Рис. 3.7 Диаграмма состояния системы с ограниченной переменной растворимостью в твердом состоянии эвтектического типа
На диаграмме эвтектического типа с переменной ограниченной растворимостью компонентов друг в друге верхняя линия ТАEТВ – линия ликвидуса, ТАMENТВ – линия солидуса. Важнейшими линиями этой системы являются: Мm – кривая ограниченной растворимости компонента В в α-твердом растворе и Nn – кривая ограниченной растворимости компонента А в β-твердом растворе. Область ТАMmА – область твердого раствора компонента В в А (α-фаза), область ТВNnB – область твердого раствора компонента А в В (β-фаза). Область mМЕNn – область двухфазного состояния (α + β).
Кривые ликвидус пересекаются в точке E или e, которая называется эвтектической точкой. Горизонтальная линия MEN, проходящая через эвтектическую точку, называется эвтектической линией, или линией эвтектики, она характеризует эвтектическое равновесие LE ↔ αM + βN. Сплавы, фигуративная линия которых пересекает горизонталь МЕ, называют доэвтектическими, а сплавы, которые пересекают горизонталь ЕN – заэвтектиче-
скимим.
Проследим процессы формирования структуры сплавов при кристаллизации и превращениях в твердом состоянии. При температуре выше линии ликвидуса все сплавы диаграммы находятся в состоянии однородного жидкого раствора.
В сплаве 1 при понижении температуры от точки 1 до точки 2 происходит кристаллизация α-твердого раствора L → α, точно так же, как и в случае неограниченных твердых растворов. Ниже солидуса сплав 1 охлаждается без
Материаловедение. Учеб. пособие |
-100- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
изменения фазового состава. Структура однофазного сплава при комнатной температуре представлена одной структурной составляющей – кристаллами α-твердого раствора.
Кристаллизация сплава 2 происходит аналогично сплаву 1. Ниже точки 2 сплав находится в состоянии однородного α-твердого раствора. В точке 3 твердый раствор достигает предела растворимости для данной температуры и при дальнейшем охлаждении, в связи с уменьшением растворимости компонента B в А, из твердого раствора должен выделяться избыток компонента В. Однако в данной системе компонент В может в себе также растворять компонент А, образуя твердый раствор β, поэтому избыток компонента В в сплаве 2 выпадает в виде кристаллов β-фазы. При этом избыточная β-фаза выделяется в равновесных условиях в форме ободков по границам зерен. При охлаждении от точки 3 до 4 состав α-твердого раствора будет изменяться по линии 3m, а состав выделяющегося твердого раствора β по линии qn. Соответственно изменяется и относительное количество фаз α и β в сплаве. Количество β-
фазы при температуре точки f по правилу рычага будет равно PhPf 100% , ко-
личество α-фазы – Phfh 100% . Кристаллы фаз, выделяющиеся при превраще-
ниях в твердом состоянии, называются вторичными и имеют размеры значительно меньше первичных.
Структура сплава 2 фазового состава (α + β) при комнатной температуре содержит две структурные составляющие: первичные кристаллы α-твердого раствора, составляющие основу сплава и вторичные кристаллы β-твердого раствора, располагающиеся по границам зерен.
Рассмотрим превращения при охлаждении доэвтектического сплава (рис. 3.8, а). От температуры точки 1 до температуры точки 2 в сплаве, аналогично предыдущим, в результате первичной кристаллизации происходит выделение первичных кристаллов α-твердого раствора. Состав α-фазы в интервале кристаллизации изменяется по линии 1'–a, жидкости – по линии 1–е. На термической кривой охлаждения сплава появляется выпуклый участок – результат выделения скрытой теплоты кристаллизации.
Материаловедение. Учеб. пособие |
-101- |
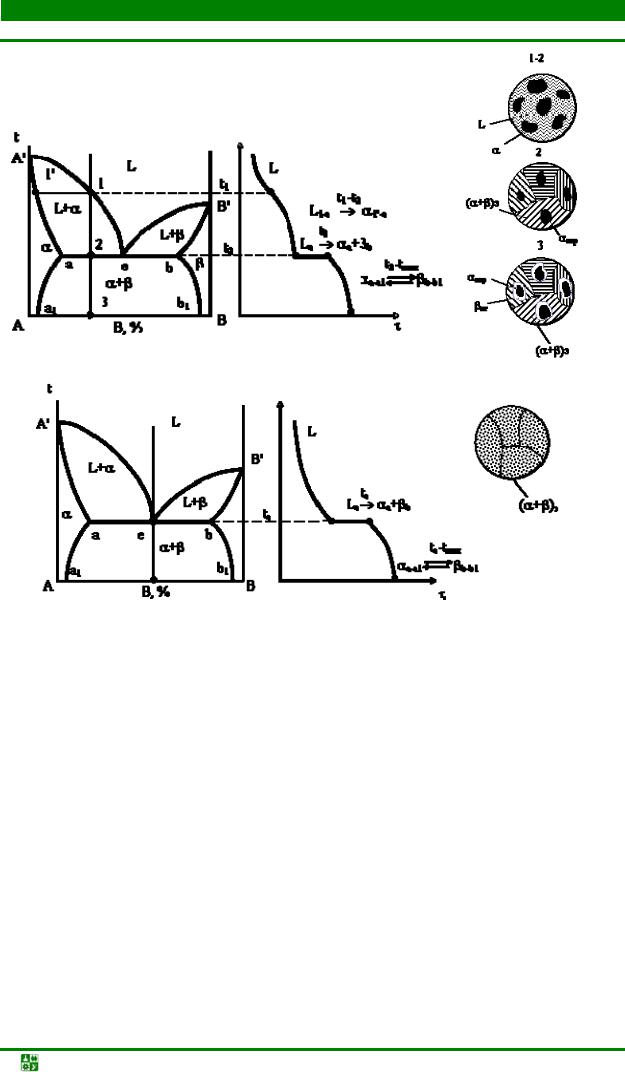
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
а
б
Рис. 3.8. Диаграмма состояния системы эвтектического типа с ограниченной переменной растворимостью в твердом состоянии: а – доэвтектический сплав; б – эвтектический сплав
При эвтектической температуре точки 2 в сплаве остается некоторое количество жидкости, равное аае2 100% , состав которой отвечает точке е,
т.е. жидкость предельно насыщена как компонентом В, так и компонентом А. В связи с этим при постоянной температуре te жидкость распадается на физи- ко-химическую смесь фаз Lе → (αа + βb)э, т.е. в сплаве происходит эвтектическая кристаллизация с образованием колоний эвтектики, состоящей из кристаллов α и β твердых растворов, состав которых будет соответствовать точкам а и b. На термической кривой охлаждения сплава появляется изотерма, свидетельствующая о выделении значительной теплоты кристаллизации при эвтектическом превращении. По правилу фаз Гиббса С = К – Ф + 1= 2 – 3 + 1 = 0, т.е. эвтектическое равновесие нонвариантно.
Материаловедение. Учеб. пособие |
-102- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Эвтектическая кристаллизация – это процесс образования и совместного роста разветвленных, регулярно чередующихся кристаллов α- и β-фаз, составляющих эвтектическую колонию. Каждая эвтектическая колония представляет собой двухфазный бикристалл. Ранее выпавшие первичные кристаллы α- фазы оказываются окруженными колониями тонко-дифференцированной эвтектической физико-химической смеси двух фаз (α + β)э – эвтектикой.
Таким образом, структура доэвтектического сплава ниже линии эвтектики будет состоять из первичных кристаллов α-твердого раствора и эвтек-
тики (α + β)э.
С понижением температуры ниже эвтектической, в соответствии с представленной диаграммой, уменьшается растворимость компонента В в α-твердом растворе и компонента А в β-твердом растворе, а концентрация α- и β-твердых растворов изменяется по линиям аа1 и bb1. Соответственно, изменяется и относительное количество α- и β-фаз.
Поэтому доэвтектический сплав (рис. 3.8, а) при охлаждении ниже линии эвтектики претерпевает фазовое превращение в твердом состоянии, в результате которого из первичных и эвтектических кристаллов α-фазы происходит выделение вторичных кристаллов β-фазы, а из эвтектических кристаллов β-фазы – выделение вторичных кристаллов α-фазы. На кривой охлаждения сплава ниже горизонтальной площадки имеется небольшой перегиб, что свидетельствует о выделении теплоты превращения при фазовом переходе α ↔ β. Выделения вторичных кристаллов из составляющих эвтектики структурно не проявляются. В результате структура доэвтектического, двухфазного (α и β) сплава, при комнатной температуре состоит из первичных кристаллов α-твердого раствора, эвтектики (α + β)э и вторичных кристаллов β-фазы.
Сплав, по составу совпадающий с точкой е, называется эвтектическим, он кристаллизуется при постоянной температуре te с образованием эвтектики (αа + βb)э в виде эвтектических колоний. Фазовые и структурные превращения в эвтектическом сплаве представлены и описаны на рис. 3.8, б. Затвердевание заэвтектического сплава отличается от доэвтектического только выделением других первичных кристаллов. Кристаллизация заэвтектического сплава начинается с выделения первичных кристаллов β-фазы. Состав твердой и жидкой фаз и их относительное количество определяются тем же способом, что и для доэвтектического сплава. Структура заэвтектического сплава имеет вид, подобный структуре доэвтектического сплава (рис. 3.8, а)
Механизмы эвтектической кристаллизации. Рассмотрим последова-
тельность кристаллизации эвтектической колонии по механизму, предложенному А.А. Бочваром. При переохлаждении эвтектического сплава ниже температуры te происходит пересыщение жидкости состава точки d компонентом А и В (сравнить концентрации точки d с точкой f и концентрации точки d с точкой с соответственно) (рис. 3.9).
Материаловедение. Учеб. пособие |
-103- |
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
ТА |
|
|
Ж |
ТВ |
Те |
α |
|
е |
β |
|
|
|||
Т1 |
c |
d |
f |
|
А |
|
|
|
В |
α |
Концентра- |
β |
ция компо- |
α |
нента В в |
жидкости |
Рис. 3.9. Распределение компонента В в жидкости перед двухфазным фронтом кристаллизации эвтектической колонии
В этих условиях возможно одновременное зарождение кристаллов α, обогащенных компонентом А, и β, обогащенных компонентом В, составляющих основу эвтектических колоний. Обычно зарождение колоний начинается с выделения плоского кристалла фазы, имеющей высокую энтропию плавления. Такую фазу называют ведущей. Примерами ведущих фаз являются химическое соединение Fe3C в системе Fe–Fe3C; CuAl2 в системе Al–Cu; Si в системе Al–Si. На фронте затвердевания перед растущим кристаллом ведущей фазы β, обогащенной, например, атомами компонента В, создается пересыщение жидкости атомами компонента А, что дает возможность образования на межфазной границе L → β зародыша второй фазы α. Вторая фаза в эвтектике зарождается и растет в форме дендрита на кристалле ведущей фазы.
Далее происходит прорастание ведущей фазы β через дендритные промежутки второй фазы α и их последующий кооперативный, совместный рост. Парный совместный рост эвтектического бикристалла (чаще трикристалла, где центральной фазой оказывается ведущая, а с обеих сторон от нее – ведомая фаза) происходит достаточно быстро. В жидкости, прилегающей к поверхности α и β двухфазного кристалла, устанавливается неодинаковая равновесная концентрация атомов компонентов на межфазных границах: L–α, (точка f) и L–β (точка с), т.е. происходит разделительная диффузия в жидкости на короткие расстояния. Равновесные концентрации определяются пересечением продолжений линий ликвидуса с линией температуры переохлаждения. Наличие разной концентрации атомов в жидкости перед двухфазным фронтом кристаллизации является движущим фактором выравнивающей диффузии в жидкости.
Поэтому в результате диффузионных процессов в жидкости атомы А присоединяются к α-эвтектическим кристаллам, а атомы В к β- эвтектическим кристаллам и происходит быстрый совместный рост разветвляющегося по мере роста би-(три-)кристалла (α + β)-фаз. Таким образом, эвтектическая колония растет до столкновения с соседней колонией.
На рис. 3.10 для примера показана последовательность этапов кристаллизации сотового ледебурита при эвтектическом превращении в системе Fe– Fe3C.
Материаловедение. Учеб. пособие |
-104- |
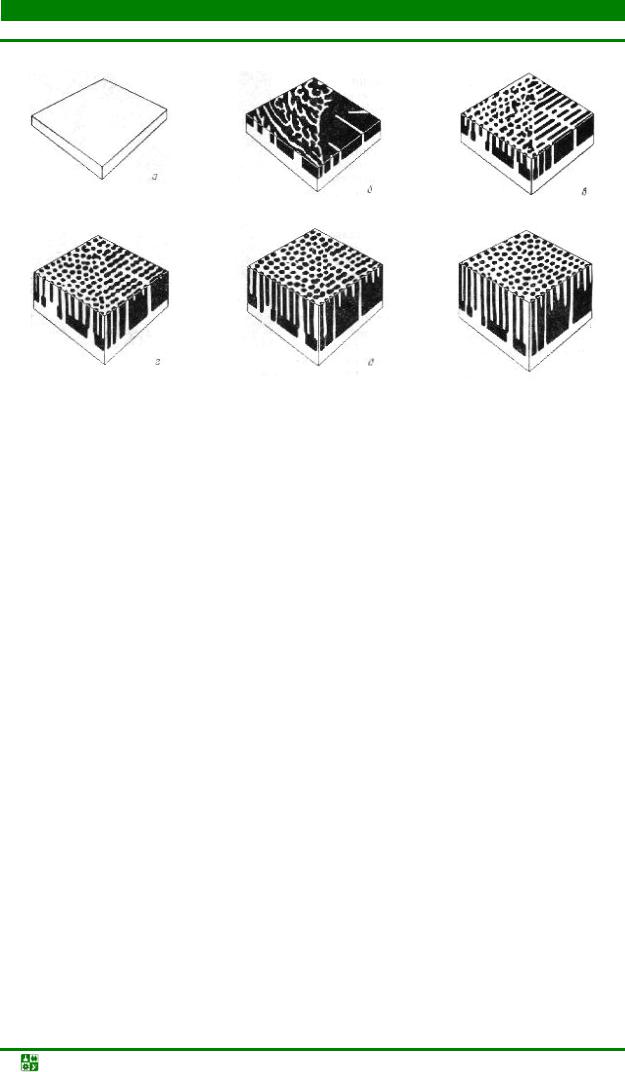
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
а |
|
б |
|
в |
|
|
|
|
|||
|
|
|
|||
|
|
|
|||
|
|
|
|
|
|
|
|
|
|
|
|
г |
д |
е |
Рис. 3.10. Схема формирования эвтектической колонии ледебурита: а – кристалл ведущей фазы, Fe3C; б – основание колонии ледебурита (γ + Fe3C); в-е – совместный рост Fe3C и γ- фаз и образование сотового ледебурита
Форма и строение эвтектических колоний зависит от степени переохлаждения расплава. При малых переохлаждениях основание эвтектических колоний, например, ледебурита, растёт в виде пластин с преобладанием сотовой структуры. С увеличением переохлаждения, в условиях некоторого замедления выравнивающей диффузии, происходит разветвление дендритов в пластинчатом пакете эвтектики. Объем колонии, занимаемой сотовой структурой, уменьшается.
В условиях больших переохлаждений начинается веерное разветвление эвтектического пакета, общая пластинчатая форма колонии искажается, и формируются сильно разветвленные колонии (рис. 3.11, а). При глубоком переохлаждении расплава колонии разделяются на сектора с последующим образованием сферолитов (рис. 3.11, в).
Кристаллы эвтектических фаз так же, как и первичные, могут расти округлыми и ограненными. Форму кристаллов связывают с особенностями кристаллохимической природы фаз и с величиной энтропии плавления. При малой величине энтропийного критерия растут округлые кристаллы с атом- но-шероховатой поверхностью раздела. Эта форма роста характерна для типичных металлов и твердых растворов на их основе. Высокоэнтропийные фазы образуют ограненные кристаллы, для которых характерна атомно-гладкая поверхность раздела и ступенчатый, тангенциальный механизм роста.
Материаловедение. Учеб. пособие |
-105- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
а |
б |
в |
Рис. 3.11. Веерное разветвление пластинчатого пакета фаз (а, б) и рост сферолита эвтектики в системе Fe + Fe3C (в): а – ×250; б – ×100; в – ×300
Нормальная и аномальная эвтектика, вырожденная эвтектика. По характеру микроструктуры на шлифе выделяют пластинчатую, зернистую, скелетную, игольчатую эвтектики (рис. 3.12, рис. 3.13).
o
а б в г
Рис. 3.12 Пластинчатая (а), зернистая (б), игольчатая (в), скелетная (г) эвтектики
При этом форма эвтектики при наблюдении в микроскопе часто определяется лишь условиями пересечения непрерывной колонии плоскостью шлифа и не дает общего представления о фактическом строении эвтектических кристаллов.
Если на шлифах обнаруживается регулярное строение, в случае пластинчатой и скелетной эвтектики (рис. 3.13, а, г), то данную эвтектику называют нормальной. Эвтектика, в колониях которой на шлифах не выявляется регулярное расположение фаз, считают аномальной.
Материаловедение. Учеб. пособие |
-106- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
а |
б |
в |
г |
Рис. 3.13. Структура пластинчатой эвтектики α(Al) + CuAl2 (а); зернистой эвтектики Cu + Cu2O (б); игольчатой эвтектики α(Al) + Si (в); скелетной эвтектики γ(Fe) + (W, Fe)6C (г)
К аномальной относят игольчатую эвтектику, например эвтектику в сплавах системы Al–Si (рис. 3.13, в) или графито-аустенитную эвтектику в серых чугунах. На шлифах графитная фаза выглядит в виде изолированных включений, хаотически ориентированных в непрерывной матрице твёрдого раствора – аустенита (рис. 3.14). Исследования К. П. Бунина и его сотрудников показали, что графито-аустенитная эвтектика формируется путём зарождения и роста бикристаллитных колоний. В слабо переохлаждённых расплавах колония приобретает грубое, а в сильно переохлажденных – тонкое строение. Графит представляет собой непрерывно разветвлённый скелет колонии, заключённый в непрерывной аустенитной матрице.
Цементитно-аустенитная эвтектика белых чугунов – ледебурит – является типичным примером нормальной, регулярной сотовой или пластинчатой эвтектики (рис. 3.15).
Ледебуритная колония является бикристаллом, в основе которой находится цементит, с тонкоразветвлённым дендритом эвтектического аустенита.
Материаловедение. Учеб. пособие |
-107- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
|
а |
|
б |
|
|
|
|
|
|
|
|
в |
г |
Рис. 3.14. Микроструктура (а, б) и схемы строения колоний (в, г) грубопластинчатой (а, в) и тонкоразветвлённой (б, г) графитной эвтектики
Рис. 3.15. Микроструктура колонии ледебурита
В качестве примера реальной диаграммы состояния эвтектического типа представлена двойная система Pb–Sb (рис. 3.16, а). Сурьма растворима в свинце, концентрация сурьмы при эвтектической температуре составляет 6,8 % ат., и поэтому со стороны свинца образуется область ограниченного α-твердого раствора замещения сурьмы в свинце. Напротив, свинец слабо растворим в сурьме, следовательно, на диаграмме практически отсутствует область β-твердого раствора и при кристаллизации сплавов рассматриваемой системы анализируется фазовый состав и структура с участием чистой сурьмы.
Диаграмма состоит из четырех областей. Выше линии ликвидус сплавы находятся в виде однородного жидкого раствора. Между линиями ликвидус и солидус расположена двухфазная область жидкой и твердой фаз. Ниже линии эвтектики все сплавы находятся в твердом состоянии. Причем при содержании Sb до 13 % по массе (17,5 % ат.) затвердевший доэвтектический сплав состоит из избыточных кристаллов α-твердого раствора и эвтектики, являющейся физико-химической смесью мелкодисперсных частиц α-твердого раствора и сурьмы (рис. 3.16, б).
Материаловедение. Учеб. пособие |
-108- |
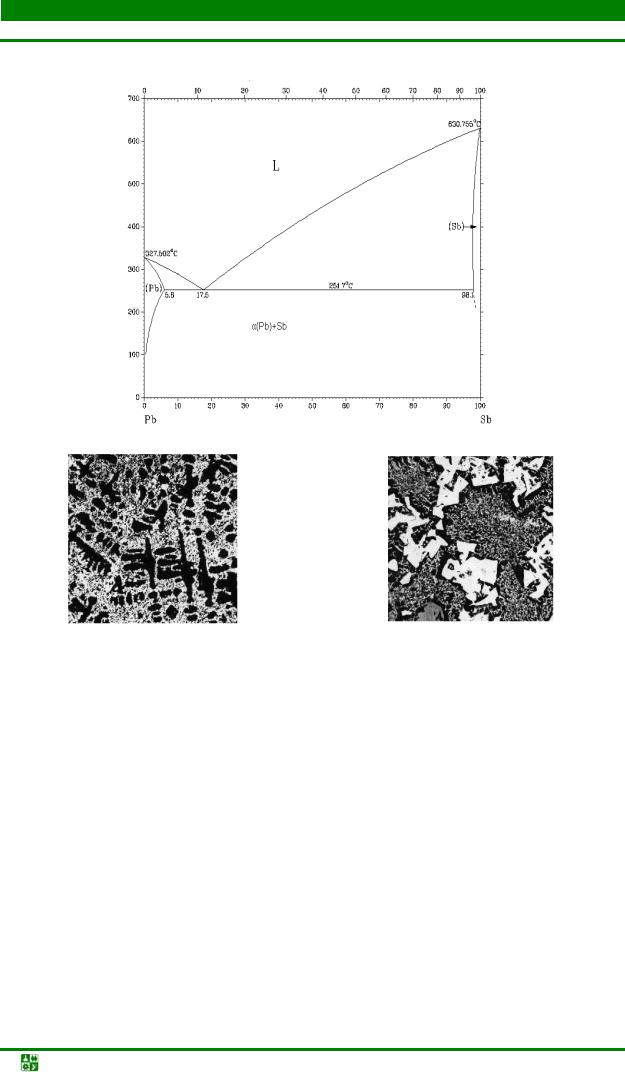
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
а
б |
в |
Рис. 3.16 Диаграмма состояния системы Pb–Sb (а); литая структура сплавов: Pb–9 % Sb, (б) структурные составляющие: первичные кристаллы α-раствора Sb в Pb и эвтектика (α + Sb); Pb–25 % Sb (в) структурные составляющие: первичные кристаллы Sb и эвтектика (α + Sb)э. ×100
Сплав, содержащий более 13 % сурьмы, по составу заэвтектический. Структура заэвтектического сплава содержит первичные кристаллы сурьмы и эвтектику (α + Sb)э (рис. 3.16, в).
В реальных условиях неравновесной кристаллизации происходит существенное изменение равновесного состояния сплавов. Перераспределение компонентов А и B между твердыми растворами α и β и соответственное изменение количества этих фаз происходят в твердом состоянии диффузионным путем. Следовательно, для протекания этого процесса необходимы значительные затраты времени. Для практики важным является особенность дендритной ликвации при неравновесной кристаллизации сплавов в системах эвтектического типа, образующих твердые растворы с ограниченной раство-
Материаловедение. Учеб. пособие |
-109- |
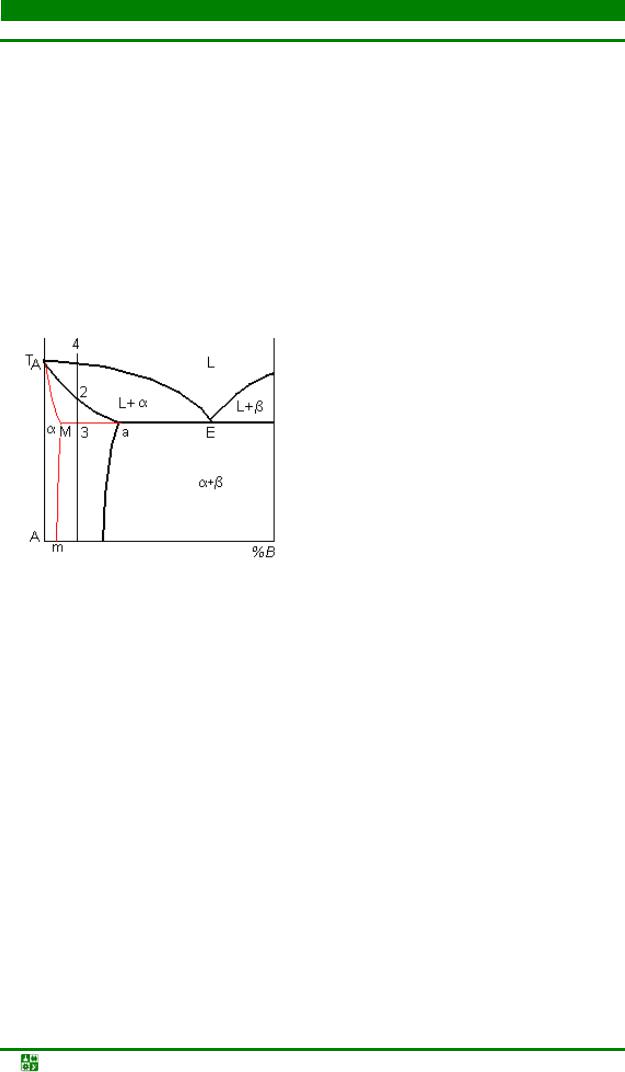
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
римостью. Дендритная ликвация доэвтектического сплава (рис. 3.16, б) проявляется не только образованием химической неоднородности по сечению дендритов твердого раствора, но и присутствием в структуре литого сплава неравновесной эвтектики.
Причина появления неравновесной эвтектики в сплавах типа твердых растворов связана с изменением положения линий равновесной диаграммы состояния.
Подавление диффузии в твердой фазе в условиях ускоренного охлаждения при кристаллизации сдвигает влево концентрационную границу появления второй фазы при эвтектическом превращении, понижает температуру окончания кристаллизации и приводит к образованию неравновесного соли-
дуса (рис. 3.17).
Рис. 3.17. Неравновесный солидус ТАМa в эвтектической системе
В сплаве 4 при охлаждении до температуры точки 3 сохраняется некоторое количество MEM3 100 % жидкой фазы, которая претерпевает эвтектиче-
скую реакцию.
Вследствие малого количества эвтектической жидкости эвтектика может структурно вырождаться в одну фазу. Такую структурную составляющую называют вырожденной эвтектикой (рис. 3.18, б).
При этом одна из фаз эвтектики, например, частицы Cu2S, откладывается на поверхности первичных кристаллов α-твердого раствора. В результате структура сплава в литом состоянии представлена кристаллами α-твердого раствора и кристаллами второй фазы эвтектического происхождения (вырожденная эвтектика). Образующаяся неравновесная эвтектика, в том числе вырожденная, усиливает влияние дендритной ликвации на свойства сплава, резко ухудшая пластичность.
Материаловедение. Учеб. пособие |
-110- |
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Т С |
|
|
|
|
|
|
1200 |
|
ж1+ж2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ж2+ |
β |
1131 |
|
|
|
|
|
||
1100 |
1,55 |
1105 |
|
17,9 |
|
|
1,45 |
|
|
|
|
|
|
|
+ β |
|
|
|
|
|
|
ж1 |
|
1067 |
|
|
|
1000 |
|
Cu(α) +Cu2 S(β) |
|
|
|
|
|
|
|
|
|
||
900 |
2 |
4 |
16 |
18 |
|
20 |
Cu |
|
|||||
|
|
|
|
|
S |
|
|
|
|
%,вес |
|
|
|
|
|
|
а |
|
|
б |
Рис. 3.18. Диаграмма состояния системы Cu–S (а),структура меди с примесью серы в литом состоянии (б), структурные составляющие: кристаллы Сu(α) и включения Cu2S (вырожденная эвтектика). ×250
Сплавам системы эвтектического типа свойственны также свои особенности превращений при охлаждении. Практически применяемые скорости охлаждения в интервале кристаллизации и развития иных фазовых превращений приводят к некоторым отступлениям от правил строения сплавов, предусмотренных фазовой диаграммой, с учетом того, что кристаллизация почти всегда происходит в условиях некоторого переохлаждения. Известно, что чем выше степень переохлаждения, тем меньше размер выделяющихся фаз и мельче эвтектика.
Отклонения от равновесных условий кристаллизации сплавов часто приводят к образованию эвтектической структуры без образования первичных составляющих для сплавов неэвтектического состава. Такая структура сплава называется «квазиэвтектической» (рис. 3.19). Это объясняется тем, что с увеличением степени переохлаждения изменение линейной скорости роста первичных кристаллов фаз и эвтектических колоний происходит не одинаково. При некоторых условиях переохлаждения линейная скорость роста колоний эвтектики может оказаться больше линейной скорости роста первичных кристаллов избыточных фаз. В этих условиях образование эвтектики во всем объеме металла завершается еще до того, как образуются первичные кристаллы избыточных фаз.
Материаловедение. Учеб. пособие |
-111- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Рис. 3.19. Схема определения области образования квазиэвтектических структур в сплавах
Область образования квазиэвтектики ограничивается зоной, составленной продолжением линий ликвидуса системы, причем чем больше степень переохлаждения, тем в более широком интервале концентраций сплавов возможно образование квазиэвтектики.
Применение ускоренного охлаждения при затвердевании может привести, кроме того, к подавлению перераспределения компонентов и получению метастабильного состояния сплавов в виде пересыщенных твердых растворов.
Поскольку такое состояние оказывается нестабильным, то при дальнейшей выдержке при комнатной или несколько повышенной температуре будет происходить выделение из пересыщенного твердого раствора избыточной фазы, что может привести к нежелательному изменению свойств сплавов (механических, коррозионных и др.).
Вдвойных системах, рассмотренных ранее, концентрация компонентов
втвердых растворах при эвтектической температуре выше, чем в интервале кристаллизации, т.е. линия солидуса показывает обычное увеличение растворимости с понижением температуры. Взаимодействие компонентов в некоторых диаграммах состояния обуславливает другой характер растворимости в твердых растворах. Концентрация компонентов при эвтектической температуре может быть ниже, чем при кристаллизации. Солидус с нетипичным характером изменения растворимости получил название ретроградного. Он встречается в системах со значительной разницей в температурах плавления компонентов и незначительной растворимостью в твердом состоянии. К таким диаграммам состояния относятся Cu–B, Ni–S, системы на основе Ge и Si и некоторых промежуточных фаз. На диаграмме состояния Cu–B ретроградный солидус характеризует при кристаллизации пере- менную растворимость меди в твердом растворе на основе бора. С понижением температуры от 2 092 до 1 400 ºС растворимость меди в твердом растворе вначале увеличивается до 19 %, а затем уменьшается до 16 % при эвтектической температуре 1 013 ºС (рис. 3.20).
Материаловедение. Учеб. пособие |
-112- |
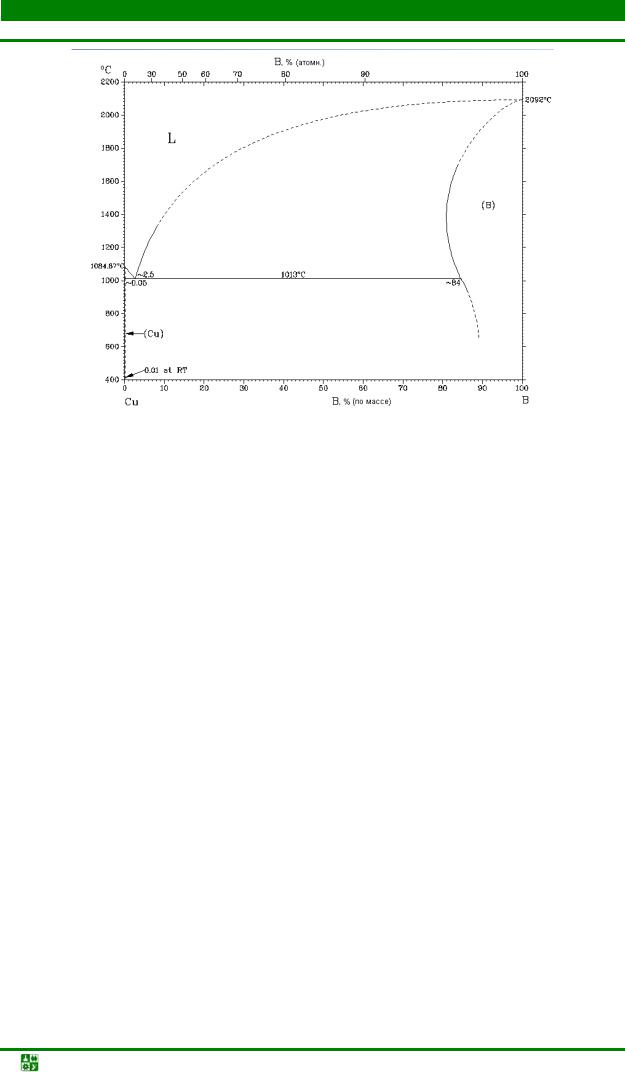
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Рис. 3.20. Диаграмма состояния системы Cu–B
Ретроградный характер кривой солидуса вызывает дополнительное фазовое превращение в сплавах диаграммы, фигуративная линия которых пересекает ретроградный солидус. Рассмотрим сплав системы Cu–B с содержанием Cu 82 %. Первичная кристаллизация β(В)-твердого раствора на основе бора заканчивается при достижении сплавом температуры солидуса. Охлаждение твердого раствора в некотором интервале температур не приводит к изменению фазового состава. В дальнейшем с понижением температуры сплав достигает линии ретроградного солидуса и реализуется превращение β(В) → Ж, т.е. происходит оплавление кристаллов ранее затвердевшего β(В)- раствора. Сплав такого состава заканчивает кристаллизацию при эвтектической температуре 1 013 ºС с образованием эвтектики [Cu + β(В)]. На кривой охлаждения оплавление кристаллов выявляется по перегибу кривой, т.к. фазовый переход β(В) → Ж сопровождается выделением теплоты превращения.
Наличие ретроградного солидуса следует учитывать при назначении режимов термической обработки некоторых сплавов, чтобы при охлаждении исключить появление жидкой фазы.
3.6. Диаграммысостояниясистемперитектическоготипа
Механизмы перитектической кристаллизации. Компоненты, обра-
зующие ограниченные твердые растворы, могут образовывать системы, в которых происходит кристаллизация по перитектическому механизму.
На диаграмме фазового равновесия такой системы (рис. 3.21) перитектическая точка p горизонтали pb располагается по одну сторону от точек а и
Материаловедение. Учеб. пособие |
-113- |
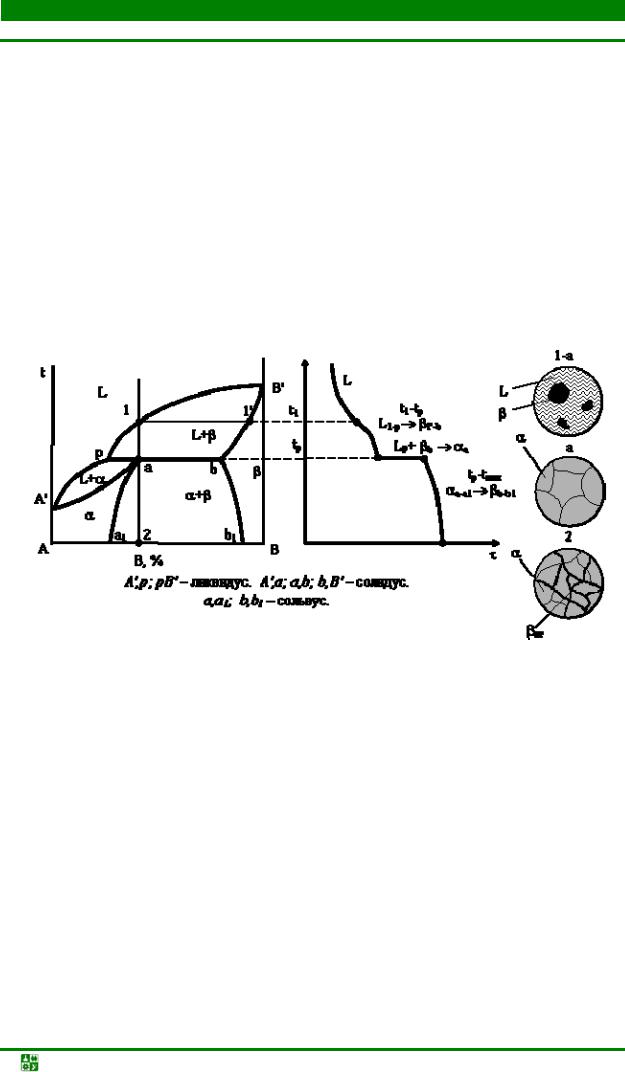
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
b максимальной взаимной растворимости компонентов в твердом состоянии. Перитектическая реакция Lp + βb → αa, протекающая при кристаллизации сплавов участка p–b, заключается во взаимодействии жидкости Lp с выпавшими ранее первичными βb-кристаллами, в результате которого образуются новые αa-кристаллы. Иначе говоря, жидкость Lp растворяет выпавшие при более высоких температурах βb-кристаллы, одновременно кристаллизуясь в виде новых кристаллов αa-твердого раствора.
Кристаллизация и формирование структуры сплавов. Кристаллиза-
ция сплава, состав которого соответствует перитектической точке р, начинается с образования кристаллов α-фазы, и перитектическая реакция в нем невозможна из-за отсутствия кристаллов β-фазы. Структура затвердевшего сплава соответствует однофазному состоянию и состоит только из зерен α- твердого раствора, разделенных высокоугловыми межзеренными границами.
Рис. 3.21. Диаграмма состояния системы перитектического типа. Кривая охлаждения сплава с составом точки а и его структура
В зависимости от состава сплавов от точки р до точки b, перитектическая реакция заканчивается по-разному. Единственным сплавом, в котором перитектическая реакция Lp + βb → αa протекает с одновременным и полным исчезновением обеих исходных фаз, является сплав, отвечающий по составу точке а (рис. 3.21).
Рассмотрим фазовые превращения, протекающие в сплаве. При первичной кристаллизации в интервале температур t1–tp состав β-кристаллов изменяется по кривой солидуса В'b от точки 1' к точке b, а состав кристаллизующейся жидкости – по кривой ликвидуса B'p от точки 1 к перитектической точке p или L1-p→β1' -b. По достижении температуры tp в равновесии оказываются жидкость Lp и βb – кристаллы, относительные количества которых определяются отношениями отрезков ab/pb и ap/pb. Жидкость Lp и первичные кристаллы βb взаимодействуют по перитектической реакции Lp + βb → αa полностью.
Материаловедение. Учеб. пособие |
-114- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
В результате такой реакции образуются кристаллы новой α-фазы состава точки а. С понижением температуры ниже перитектической из кристаллов α- фазы выделяются вторичные кристаллы β-фазы. Состав α-кристаллов изменяется по кривой сольвуса аа1, а вторичных β-кристаллов – по кривой сольвуса bb1, т.е. αa-a1 → βb-b1. При комнатной температуре αа1-кристаллы оказываются в равновесии с βb1-кристаллами. В структуре этого сплава – две структурные составляющие: α-кристаллы, образовавшиеся по перитектической реакции, и вторичные β-кристаллы, располагающиеся в виде прожилок по границам зерен. Кривая охлаждения и структура сплава представлены на рис. 3.21.
В сплавах, расположенных между точками а и b (рис. 3.22), перитектическая реакция протекает лишь до исчезновения жидкости Lp, расходуемой полностью для протекания перитектической реакции. Причем это происходит в тот момент, когда в сплаве еще сохраняется некоторое количество ока-
завшихся в избытке β-кристаллов: Lp + βb → αa(+βизб).
Количество кристаллов β-фазы, образовавшихся при первичной кристаллизации до начала перитектической реакции, определяется правилом рычага и равно Р2/Рb. После завершения перитектической кристаллизации количество избыточных кристаллов β-фазы в сплаве определяется соотношением а2/аb. Структура сплава после превращения состоит из оказавшихся в избытке β-кристаллов и α-кристаллов перитектического происхождения. В зависимости от того, где зарождаются α-кристаллы в сплавах, и соответствующих особенностей механизма перитектического превращения, в системе могут возникать быть два типа структур.
Во-первых, при перитектической реакции α-кристаллы могут зарождаться на поверхности β-кристаллов, окружая их сплошными ободками образующейся фазы. Такая структура носит название «структуры окружения», подобная структура изображена на рис. 3.22, а для сплава системы Sn–Sb – на рис. 3.23. В этом случае рост кристаллов новой фазы возможен только за счет продвижения межфазной границы L–α в сторону жидкости, а границы β–α в сторону β-кристаллов. Этот процесс сопровождается диффузией атомов через твердую α-фазу. Обычно в структуре окружения избыточная фаза из-за неоднородного растворения, зависящего от многих факторов, имеет неровную поверхность.
Материаловедение. Учеб. пособие |
-115- |
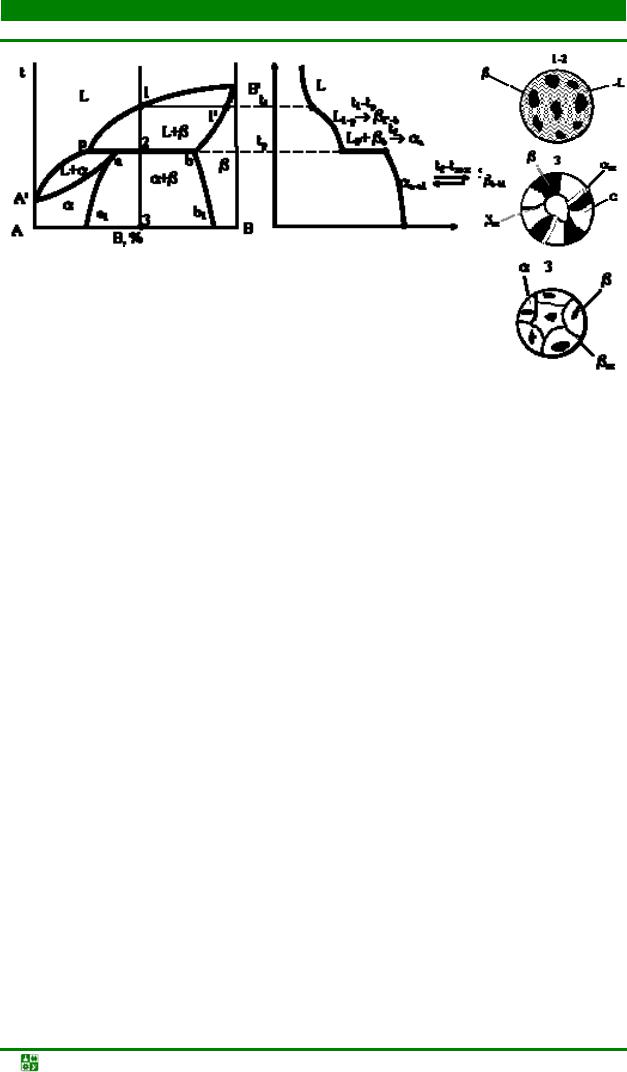
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Структура окружения
Рис. 3.22. Диаграмма состояния системы перитектического типа. Кривая охлаждения и структура сплава с избытком твердой фазы после перитектической реакции
Во-вторых, формирование структуры может быть связано с зарождением новых α-кристаллов при перитектическом превращении непосредственно в жидкости. При этом кристаллы α-фазы растут в окружении жидкости, а β- кристаллы в жидкости растворяются. Диффузия атомов при подобной кристаллизации, по сравнению с первой схемой, облегчена, т.к. атомы к межфазным границам перемещаются в жидкой фазе, а, как известно, диффузионные процессы в жидкости протекают на порядки быстрее, чем в твердом теле.
Кроме того, жидкость, окружающая растущие кристаллы, не препятствует свободному перемещению межфазной границы в направлении роста. В структуре сплавов наблюдаются отдельно α-кристаллы и отдельно избыточные β-кристаллы. Схематично такая структура представлена на рис. 3.23, б для сплава на основе системы Cu–Zn – на рис. 3.24, б.
Материаловедение. Учеб. пособие |
-116- |
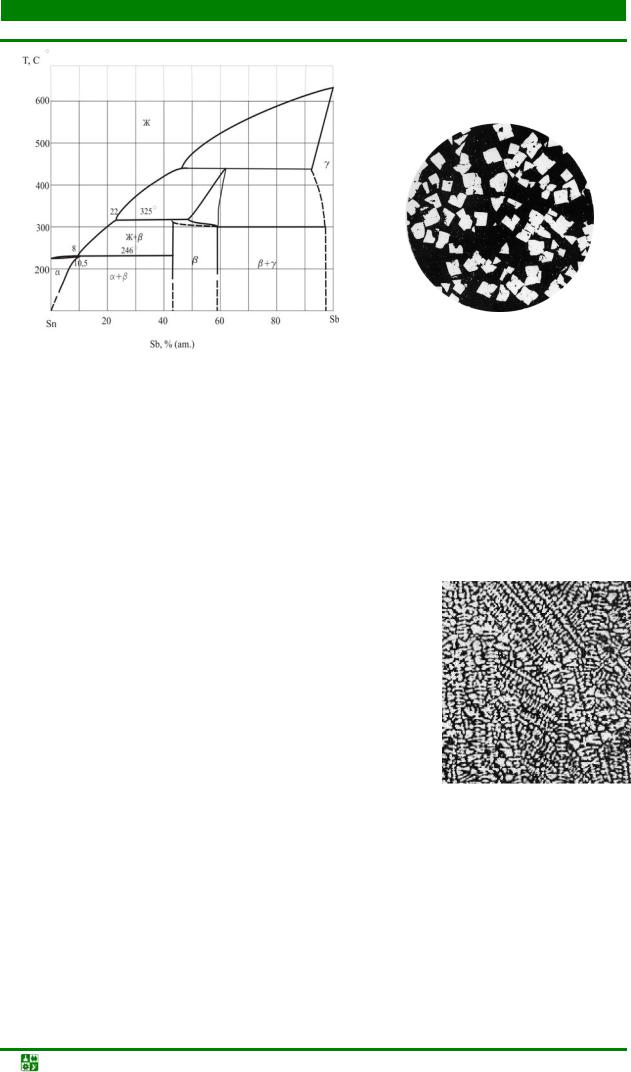
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
а |
б |
Рис. 3.23. Диаграмма состояния системы Sn–Sb (а); структура сплава Sn–20 % Sb
влитом состоянии (б); структурные составляющие: избыточные β-кристаллы (SnSb)
иα-кристаллы, образовавшиеся по перитектической реакции. ×100
а |
б |
Рис. 3.24. Диаграмма состояния Cu–Zn (а); структура сплава Cu–38 % Zn в литом состоянии (б); структурные составляющие: избыточные β-кристаллы (темные) и α-кристаллы (светлые), образовавшиеся по перитектической реакции. ×100
В сплавах, расположенных между точками p и a, перитектическая реакция заканчивается полным расходованием βb-кристаллов: Lp + βb → αa(+Lpост), поскольку в этом случае перитектическая реакция развивается в условиях из-
Материаловедение. Учеб. пособие |
-117- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
бытка жидкой фазы. При этом перитектическая реакция оказывается возможной лишь до тех пор, пока не будут в полном объеме израсходованы кристаллы β-фазы, количество которых в рассматриваемых сплавах оказывается недостаточным для полного завершения кристаллизации во всем объеме сплава.
В этом случае в сплаве после перитектического превращения остаются неизрасходованная избыточная жидкость и некоторое количество образовавшихся по перитектической реакции кристаллов новой α-фазы. Их количественное соотношение может быть определено по правилу рычага.
Рис. 3.25. Диаграмма состояния перитектического типа. Кривая охлаждения и структура сплава с избытком жидкой фазы после перитектической реакции
Последующее охлаждение в соответствии с диаграммой состояния приводит к продолжению кристаллизации α-твердого раствора, но уже непосредственно из жидкости по рассмотренному ранее механизму кристаллизации твердых растворов. После окончания кристаллизации в связи с уменьшением растворимости компонента В в α-твердом растворе происходит выделение на границах зерен α-фазы вторичных β-кристаллов. Кривая охлаждения и структура сплава показана на рис. 3.25.
На рис. 3.23 представлена диаграмма состояния Sn–Sb и структура литого сплава Sn–20 % Sb. При температуре 246 ºС жидкость с концентрацией 8 % ат. взаимодействует с промежуточной фазой β Sn3Sb2 состава 43 % ат., и в результате перитектической реакции образуется α-фаза – твердый раствор на основе олова с концентрацией 10,5 % ат.
3.7. Диаграммысостояниясистемспромежуточнымифазами
Диаграммы состояния с промежуточными фазами составляют подавляющее большинство всех известных систем. Это объясняется тем, что мно-
Материаловедение. Учеб. пособие |
-118- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
гие компоненты могут вступать между собой в химическое взаимодействие с образованием фаз с новой кристаллической решеткой. Типы образующихся в двойных системах фаз были рассмотрены выше. К ним относятся химические соединения с нормальной валентностью, фазы никель-арсенидного типа, фазы внедрения, электронные соединения, сигма-фазы, фазы Лавеса, а также сверхструктуры, природа которых лежит в области процессов упорядочения твердых растворов.
Каждая из таких фаз может претерпевать полиморфные превращения, эвтектоидный распад. Они могут иметь постоянный химический состав в широком интервале температур или переменный состав, в большей или меньшей степени растворять в себе компоненты, образуя области гомогенности. Промежуточные фазы могут кристаллизоваться непосредственно из жидкости при температуре, соответствующей сингулярной точке. Такие фазы носят название устойчивых конгруэнтно плавящихся фаз. Многие промежуточные фазы образуются по механизму перитектической кристаллизации путем химического взаимодействия твердой фазы и жидкости. Такие фазы называются инконгруэнтно плавящимися неустойчивыми соединениями.
Перитектическая кристаллизация инконгруэнтно плавящихся промежуточных фаз является не единственным механизмом их образования. Существуют системы, в которых промежуточная фаза образуется в результате химического взаимодействия двух жидкостей с различным химическим составом, предварительно образовавшихся в результате расслоения при охлаждении одного жидкого раствора. Такое взаимодействие жидкостей различного состава с образованием одного твердого химического соединения (например, в системе олово–фосфор) называется синтектическим превращением.
Наконец, промежуточные фазы могут формироваться в результате перитектоидной реакции в твердом состоянии. В этом случае в химическое взаимодействие с выделением значительной теплоты реакции вступают две твердые фазы с образованием химических соединений различных типов.
В настоящем разделе подробно будут рассмотрены только некоторые типы диаграмм, наиболее важные в практическом отношении. Остальные типы диаграмм могут стать предметом самостоятельного анализа студентов.
Диаграммы фазового равновесия в системах с конгруэнтно плавя-
щимися промежуточными фазами. Промежуточные фазы, при плавлении которых составы твердой и жидкой фаз совпадают, называют конгруэнтно плавящимися фазами (рис. 3.26). Если в качестве промежуточной фазы выступает химическое соединение АmВn (постоянного состава) и граничные растворы на основе компонентов А и В имеют узкие области гомогенности и ими можно пренебречь, то диаграмма состояния описывает фазовые равновесия между практически чистыми компонентами и А, В и химическим соединением АmВn (рис. 3.26, а). На диаграмме химическому соединению соответствует ордината, проведенная из точки на координатной оси, отвечающей его составу AmBn. Химическое соединение АmВn кристаллизуется (или плавится) при постоянной температуре tm1 , отвечающей точке максимума на ликвиду-
Материаловедение. Учеб. пособие |
-119- |
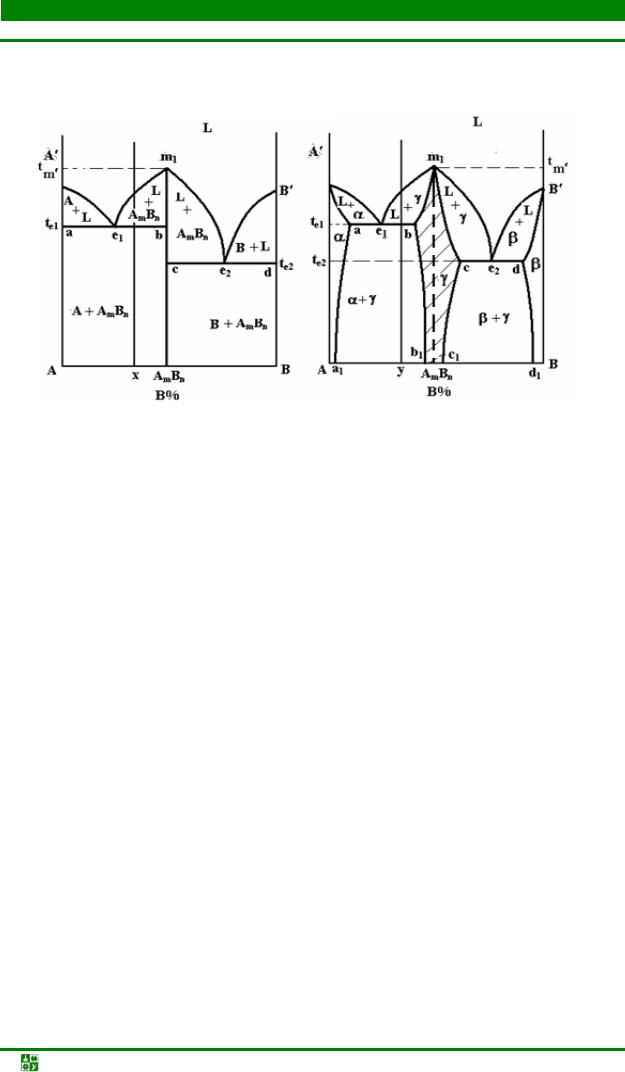
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
се. Такая точка называется сингулярной (точка m1). Именно она соответствует температуре плавления химического соединения.
а |
б |
Рис. 3.26. Диаграмма состояния системы с конгруэнтно плавящимися промежуточными фазами
Ордината делит диаграмму состояния на две части, каждая из которых может представлять собой диаграмму любого типа. В рассматриваемом случае (рис. 3.26) получаются две диаграммы эвтектического типа.
Такие диаграммы состояния характерны для систем, образованных металлами и элементами, которые обладают и металлическими, и неметаллическими свойствами, а промежуточная фаза представляет собой химическое соединение с нормальной валентностью или полупроводниковую фазу. Диаграмма с конгруэнтно плавящейся промежуточной фазой (рис. 3.26, б), в отличие от предыдущей, характеризуется наличием областей гомогенности приграничных твердых растворов на основе обоих компонентов и области гомогенности на основе промежуточной фазы.
Кристаллизация рассматриваемого сплава в системе с устойчивой промежуточной фазой (рис. 3.26) будет происходить аналогично кристаллизации сплавов в обычной эвтектической системе. При охлаждении сплава из жидкого состояния ниже линии ликвидус начинают выделяться кристаллы химического соединения AmBn. Состав жидкой фазы изменяется при кристаллизации по линии СE1. По мере понижения температуры в кристаллизационном интервале температур происходит увеличение количества выделяющихся кристаллов химического соединения (промежуточной фазы AmBn). Однако такая кристаллизация развивается лишь до температуры эвтектического превращения, и не завершается образованием ста процентов кристаллов этого соединения. Количество сохранившейся незакристаллизованной жидкости может быть определено по правилу рычага.
Материаловедение. Учеб. пособие |
-120- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
При достижении температуры эвтектической линии оставшаяся часть жидкости превращается в эвтектику (А + AmBn)э, представляющую собой фи- зико-химическую смесь кристаллов компонента A и химического соединения AmBn. Окончательно структуру этого сплава можно представить в виде первичных кристаллов химического соединения и эвтектики (рис. 3.27). Первичные кристаллы промежуточных фаз постоянного состава могут иметь игольчатую, пластинчатую, полиэдрическую, дендритную (разветвленную) форму.
Рис. 3.27. Диаграмма фазового равновесия системы с устойчивым (конгруэнтно плавящимся) химическим соединением
Если на диаграмме состояния с наличием химического соединения концентрацию элементов отложить в атомных процентах, то по диаграмме состояния (рис. 3.28) можно определить химическую формулу соединения.
Пересчет массовых процентов в атомные производится по формуле
à100%
α= Àà1 + b % àò. Â1À1
Обратный пересчет атомных процентов в массовые производится по формуле
à = |
|
À1α |
100%, |
мас., |
À α+Â β |
||||
|
1 |
1 |
|
|
где A1, B1 – атомные веса компонентов A и B; α, β – % компонента A и B; a, b – % мас. компонента A и B.
Материаловедение. Учеб. пособие |
-121- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Рис. 3.28. Определение формул двух химических соединений по диаграмме фазового
равновесия Cu–Mg
Например, в системе Cu–Mg при 16 и 44 % мас. Mg пересчет в атомные (33,3 и 66,7 % соответственно) показывает, что для 33,3 % ат. на 1 грамматом Mg приходится 2 грамм-атома Cu, следовательно, его формула Cu2Mg, а для 66,7 % ат. Mg на 1 грамм-атом меди приходится 2 грамм-атома Mg. Следовательно, формула химического соединения CuMg2.
Для диаграмм состояния с конгруэнтно плавящимися промежуточными фазами переменного состава (γ-фаза на рис. 3.26, б) характерны сравнительно широкие области граничных α- и β-растворов, и значительная растворимость компонентов А и В в химическом соединении АmВn, на основе которого образуется γ-твердый раствор. Линия m1AmBn в области промежуточной γ-фазы показывает средний стехиометрический состав соединения AmBn. Область m1bb1AmBn левее линии представляет собой γ-твердый раствор компонента А
вАmBn, а область правее линии m1cc1AmBn – γ-твердый раствор компонента B
вАmBn. В случае образовании твердых растворов замещения атомы компонента А замещают в подрешетке соединения АmBn атомы компонента В, и
наоборот. Таким образом в пределах γ-области твердые растворы на основе химического соединения АmВn содержат избыток одного из компонентов относительно стехиометрического состава или оба компонента, соответствующих стехиометрическому составу соединения АmВn.
Все твердые растворы в области гомогенности промежуточной γ-фазы являются ненасыщенными. Насыщенными относительно кристаллов граничных α или β-растворов при охлаждении становятся только те γ-растворы, фигуративные точки которых, попадая на кривые сольвуса bb1 и сс1 оказываются затем в двухфазных областях (α + γ) и (β + γ). Тогда из кристаллов промежуточной γ-фазы при охлаждении в связи с переменной ограниченной растворимостью в твердом состоянии выделяются вторичные α или β- кристаллы, которые в равновесных условиях, чаще всего, располагаются в виде пленок по границам зерен твердого раствора.
Перитектическая кристаллизация в системах с образованием инконгруэнтно плавящейся промежуточной фазой. Промежуточные фазы,
при плавлении которых состав образующейся жидкой фазы отличается от состава твердой фазы, называют инконгруэнтно плавящимися фазами. При
Материаловедение. Учеб. пособие |
-122- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
плавлении таких фаз, помимо жидкости, образуется новая твердая фаза, состав которой отличается от состава исходной твердой фазы (рис. 3.29).
а |
б |
|
|
Рис. 3.29. Диаграммы состояния систем с инконгруэнтно плавящимися промежуточными фазами: а – постоянного, б – переменного состава
Инконгруэнтно плавящаяся промежуточная фаза может иметь постоянный состав, т.е выступать как химическое соединение АmВn, а взаимная растворимость компонентов А и В в твердом состоянии может быть незначительной (рис. 3.29, а).
Если инконгруэнтно плавящаяся промежуточная γ-фаза может быть переменного состава с областью гомогенности scc1AmBn, то на основе компонентов А и В образуются граничные α и β-твердые растворы (рис. 3.33, б).
Инконгруэнтно плавящиеся промежуточные фазы называют также фазами со скрытым максимумом. На диаграмме состояния (рис. 3.29, а) видно, что скрытый максимум m' отвечает составу химического соединения АmВn, т.е. промежуточной фазы постоянного состава. Если промежуточная γ-фаза имеет переменный состав, то скрытый максимум m', который отвечает составу химического соединения АmВn, может оказаться за пределами области гомогенности промежуточной γ-фазы на основе этого соединения (рис. 3.29, б).
Формирование структур сплавов при кристаллизации в и охлажде-
нии в твердом состоянии. Рассмотрим фазовые превращения при охлаждении сплава I диаграммы состояния с инконгруэнтно плавящейся промежуточной фазой постоянного состава (рис. 3.30). В точке 1, соответствующей пересечению фигуративной линии сплава с линией ликвидус, начинается выделение кристаллов компонента B. Состав жидкой фазы изменяется по линии 1р.
При температуре точки 2 образуется ррb2 100 % кристаллов B и 2bрb 100 %
жидкого раствора состава точки р.
Материаловедение. Учеб. пособие |
-123- |
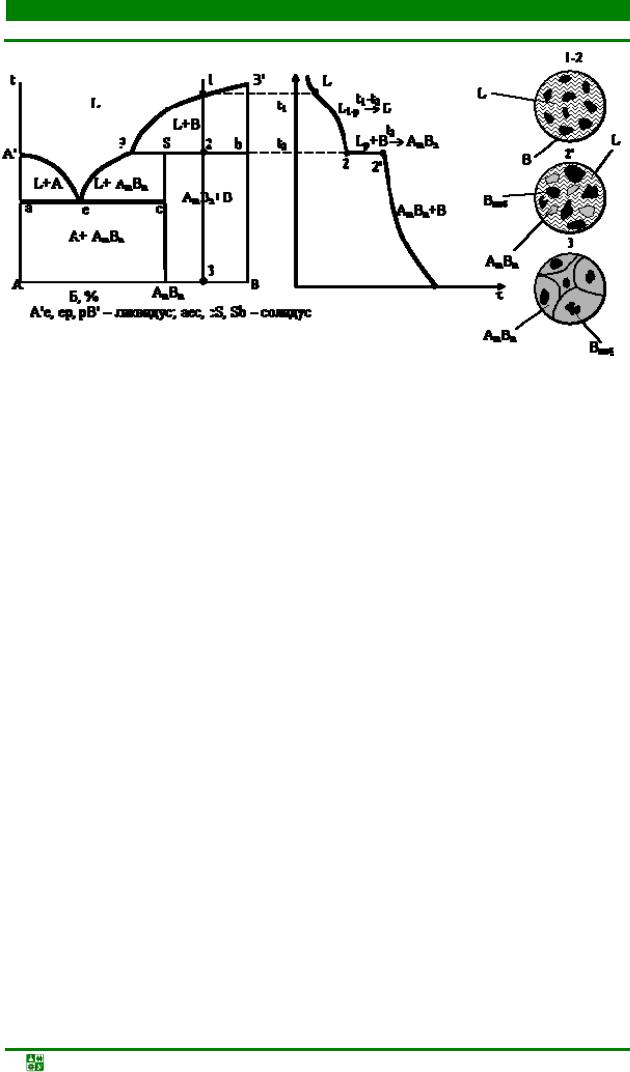
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Рис. 3.30. Диаграмма состояния системы с инконгруэнтно плавящейся промежуточной фазой постоянного состава. Кривая охлаждения и формирование структуры сплава
Ниже этой температуры становится устойчивым химическое соединение AmBn, в связи с чем, выделившиеся первичные кристаллы компонента B взаимодействуют по перитектической реакции с жидкостью состава точки р, образуя это соединение: Lр + B → AmBn .
При этом С = 2 – 3 + 1 = 0, т.е. превращение протекает при постоянной температуре, оно нонвариантно. Для образования химического соединения состава точки S требуется количественное соотношение твердой и жидкой
фаз, равное SbрS , а в сплаве I имеется р2b2 , т.е. присутствует избыток кристал-
лов В.
Неиспользованные в процессе перитектического превращения кристаллы В сохраняются в структуре сплава при охлаждении ниже линии перитектики. Окончательная структура сплава (рис. 3.31) представляет собой так называемую «структуру окружения», в которой первичные (избыточные) кристаллы В окружены со всех сторон перитектическими кристаллами химического соединения AmBn., т.е. состоит из двух структурных составляющих.
В сплаве II при достижении точки 1 начинается процесс кристаллизации с выделения тех же кристаллов компонента В (рис. 3.31).
Материаловедение. Учеб. пособие |
-124- |
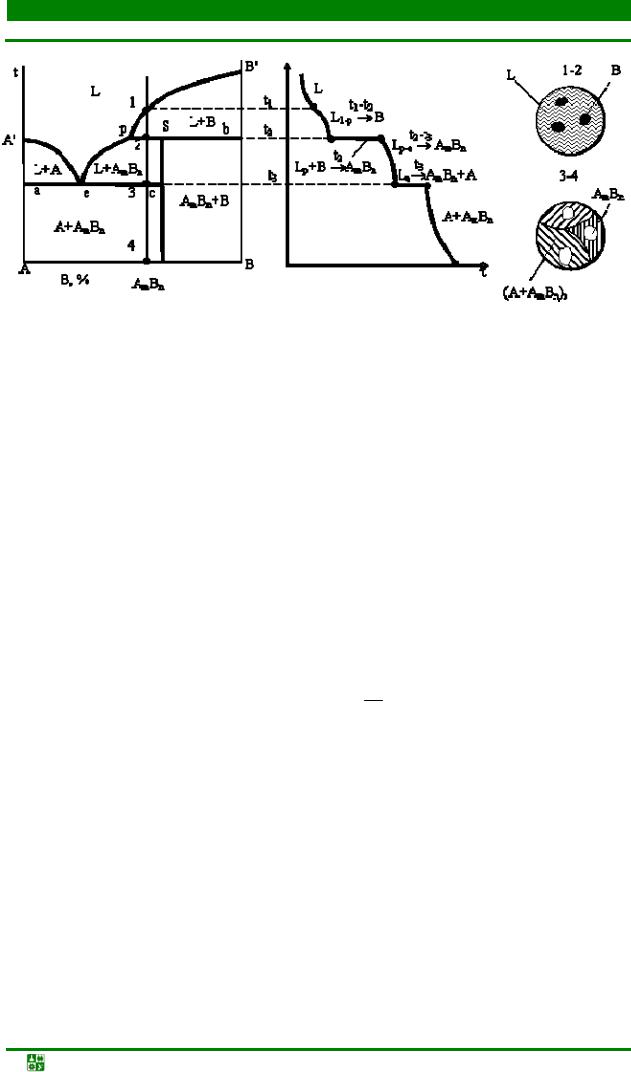
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Рис. 3.31. Диаграмма состояния системы с инконгруэнтно плавящейся промежуточной фазой. Кривая охлаждения и структура сплава
Понижение температуры приводит к увеличению количества кристаллов В и изменению концентрации жидкой фазы по линии 1р. При температу-
ре точки 2 в сплаве наблюдается |
р2 |
100 % твердых кристаллов компонента В |
||
|
|
|
рb |
|
и |
2b |
100 % жидкой фазы, т.е. |
имеется большой избыток жидкой фазы. |
|
|
рb |
|
|
|
Часть ее, взаимодействуя с кристаллами В, образует химическое соединение AmBn состава S. Избыток жидкой фазы сохраняется ниже линии перитектического превращения.
При последующем охлаждении выделяются кристаллы химического соединения AmBn. Количество химического соединения AmBn увеличивается с понижением температуры, а состав жидкой фазы изменяется по линии ре, достигая концентрации точки е при температуре точки 3. Количество жидко-
сти при температуре точки 3 соответствует 3есс 100% .
Это количество жидкости при температуре точки 3 претерпевает эвтектическое превращение, с образованием эвтектической физико-химической смеси (А + AmBn)э, т.е. Lр → (А + AmBn). В результате рассмотренных превращений в сплаве 2 наблюдаются две структурные составляющие: первичные кристаллы AmBn и колонии эвтектики (А + AmBn)э (рис. 3.31).
Если состав сплава совпадает с ординатой химического соединения AmBn (рис. 3.32), то в результате кристаллизации сплава образуется структура, представленная только кристаллами соединения AmBn.
Материаловедение. Учеб. пособие |
-125- |
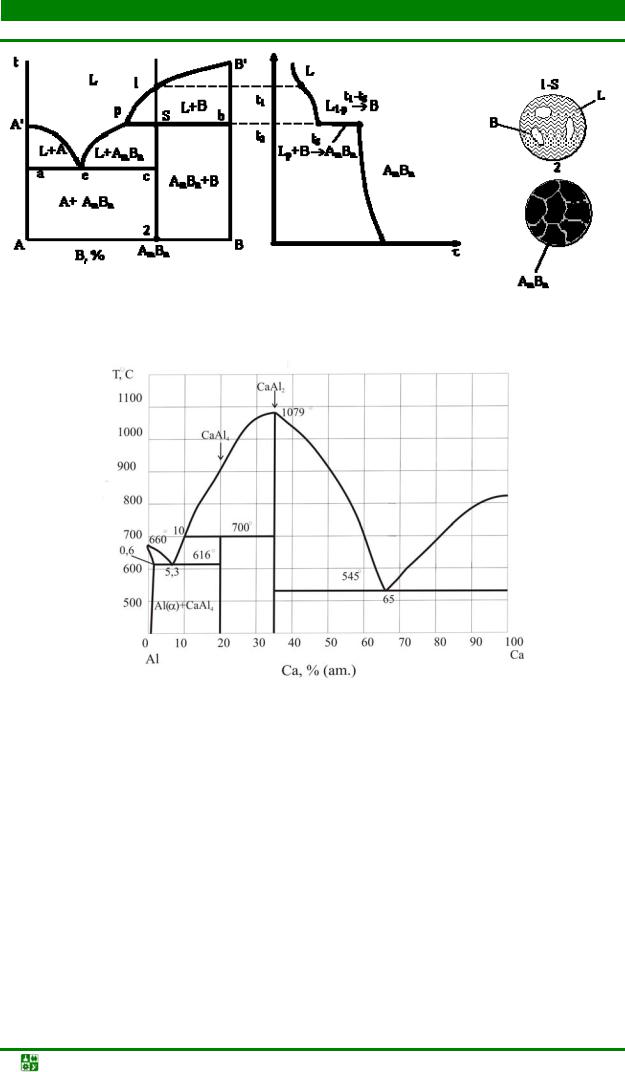
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Рис. 3.32. Диаграмма состояния системы с инконгруэнтно плавящейся промежуточной фазой постоянного состава. Кривая охлаждения и формирование структуры
Рис. 3.33. Диаграмма состояния Al–Ca
В качестве примера диаграммы состояния с конгруэнтно плавящейся при температуре 1 079 ºС промежуточной фазой постоянного состава CaAl2 и инконгруэнтно плавящейся при температуре 700 ºС промежуточной фазой постоянного состава CaAl4 представлена реальная диаграмма состояния
Al–Ca (рис. 3.33).
Эту систему следует рассматривать студентам в качестве задания для самостоятельного анализа превращений, протекающих при кристаллизации сплавов с конгруэнтно и инконгруэнтно плавящимися промежуточными фазами, и определения конечной структуры соответствующих сплавов.
Целесообразно при этом проанализировать доэвтектические, заэвтектические сплавы, сплавы, лежащие в области концентраций между составами двух промежуточных фаз.
Материаловедение. Учеб. пособие |
-126- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Перитектоидное превращение и образование промежуточной фазы в твердом состоянии. Неустойчивые при высоких температурах промежуточные фазы могут формироваться по механизму перитектоидной реакции в результате твердофазного химического взаимодействия между двумя твердыми фазами с образованием третьей, отличающейся от исходных собственной кристаллической решеткой и индивидуальными свойствами. Механизм перитектоидного превращения имеет те же этапы, что и перитектическое. Отличие его от перитектического заключается в особенностях кинетики, обусловленных малой скоростью развития диффузионных процессов.
Способствовать развитию таких превращений может высокая степень разветвленности межфазной поверхности между взаимодействующими фазами. Такие условия создаются в том случае, если исходные для перитектоидного превращения фазы были сформированы, например, предшествовавшей эвтектической кристаллизацией расплава.
Рис. 3.34. Диаграмма фазового равновесия никель–индий
Анализ диаграммы никель–индий (рис. 3.34) показывает, что при температуре 910 ºС и содержании индия 26,5 % ат. происходит эвтектическая реакция с образованием эвтектической тонкодифференцированной физикохимической смеси твердого раствора на основе никеля и интерметаллида
Ni13In9.
Однако уже при температуре 842 ºС те же фазы должны принять участие в перитектоидном превращении, его результатом должны были явиться кристаллы нового интерметаллида Ni3In, химический состав которого почти совпадает со средним составом эвтектики. Поэтому вместо эвтектических колоний при комнатной температуре в сплаве на их месте в микроструктуре проявляются интерметаллидные зерна, образовавшиеся при перитектоидной
Материаловедение. Учеб. пособие |
-127- |
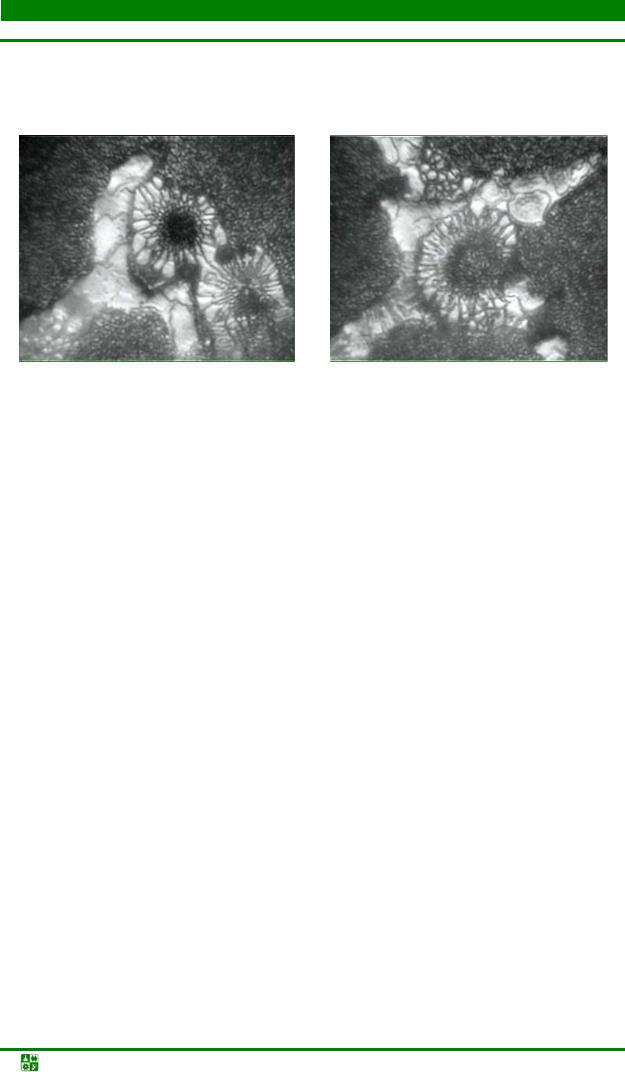
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
реакции из фаз, составлявших эвтектику при температурах от 910 до 842 ºС (рис. 3.35).
а |
б |
Рис. 3.35. Структурное состояние интерметаллидной фазы в зонах бывших эвтектических колоний литого сплава никель–индий. ×1 200
Такому механизму структурных превращений способствуют особенности развития эвтектической и перитектоидной реакций, которые заключаются в непосредственной близости по температурной шкале этих превращений. Высокая температура перитектоидной реакции, близкая по абсолютной величине к температуре плавления, обеспечивает обязательный характер такой последовательности превращений и конечной структуры таких сплавов.
Однако для многих систем температура эвтектической и перитектоидной реакций могут значительно отличаться. В этих условиях образования промежуточных фаз по перитектоидной реакции может не происходить по причине подавления диффузионного обмена на межфазной поверхности и гомогенизирующей диффузии в фазах, в связи с чем до комнатной температуры может сохраняться эвтектическое строение.
3.8.Диаграммыфазовогоравновесия
срасслоениемжидкихрастворов
Диаграммы состояния систем с монотектическим равновесием. В
некоторых случаях при взаимодействии компонентов в расплавленном состоянии могут оказаться две несмешивающиеся жидкости, разделенные между собой поверхностью раздела. С повышением температуры растворимость жидких фаз друг в друге возрастает и при определенной температуре, соответствующей критической точке k, составы обеих фаз сближаются настолько, что они превращаются в одну фазу. Кристаллизация таких жидкостей чаще всего происходит в три этапа, первый из которых заключается в монотектической реакции, при которой жидкость, богатая тугоплавким компонентом
Материаловедение. Учеб. пособие |
-128- |
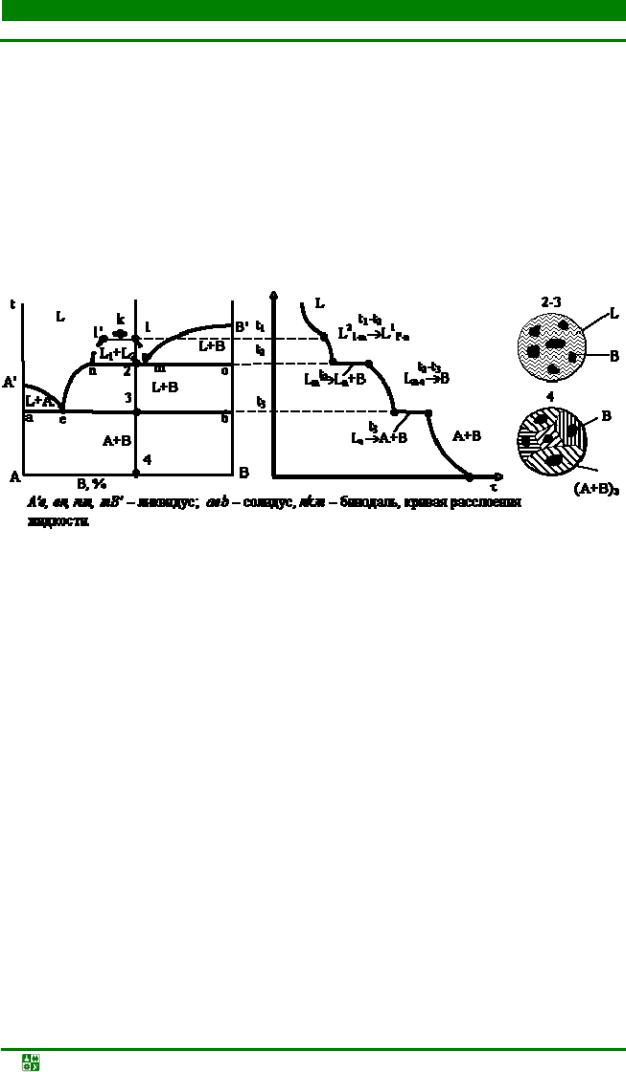
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
распадается на две фазы, одной из которых оказывается жидкость, богатая легкоплавким компонентом, а второй – твердые кристаллы фазы, богатой тугоплавким компонентом (L2 ↔ L1 + B).
Вторым этапом кристаллизации становится кристаллизация твердого раствора или чистого тугоплавкого компонента. Третьим этапом является эвтектическая кристаллизация оставшейся жидкости при температурах, несколько ниже температуры плавления легкоплавкого компонента.
Диаграмма состояния с ограниченной растворимостью компонентов в жидком состоянии, монотектическим и эвтектическим равновесиями, представлена на рис. 3.36.
Рис. 3.36. Диаграмма состояния системы с нонвариантным монотектическим равновесием. Кривая охлаждения и структура сплава
Выше линии nkm (бинодали) компоненты А и В неограниченно растворимы один в другом, т.е. образует ненасыщенный жидкий раствор. Область ограниченной растворимости, область расслоения в жидкости отделена на диаграмме пунктирной линией. Ниже линии nkm расположена двухфазная область жидких растворов L1 и L2 разных составов, насыщенных один относительно другого. В зависимости от плотности компонентов и, следовательно, жидких растворов L1 и L2, расслоение в двухфазной области может проявляться по-разному. При небольшой разнице в плотности образуется эмульсия. Если разница в плотности большая, то может наблюдаться ликвация по плотности, т.е. образование жидких слоев разного состава. Горизонтальная линия nmo является линией монотектического равновесия. Особенность данного равновесия заключается в том, что жидкий раствор состава точки m (L2) находится в равновесии с кристаллам компонента Bo и жидкостью состава точки n (L1), т.е. L(m) ↔ L(n) + Bo, или (L2 ↔ L1 + B). Монотектическое превращение так же, как и эвтектическое, происходит при постоянной тем-
пературе, т.к. С = 2 – 3 + 1 = 0.
Монотектическая реакция при охлаждении сплава составом точки m Lm → Ln + B – завершается исчезновением одной жидкости L1 состава точки m c
Материаловедение. Учеб. пособие |
-129- |
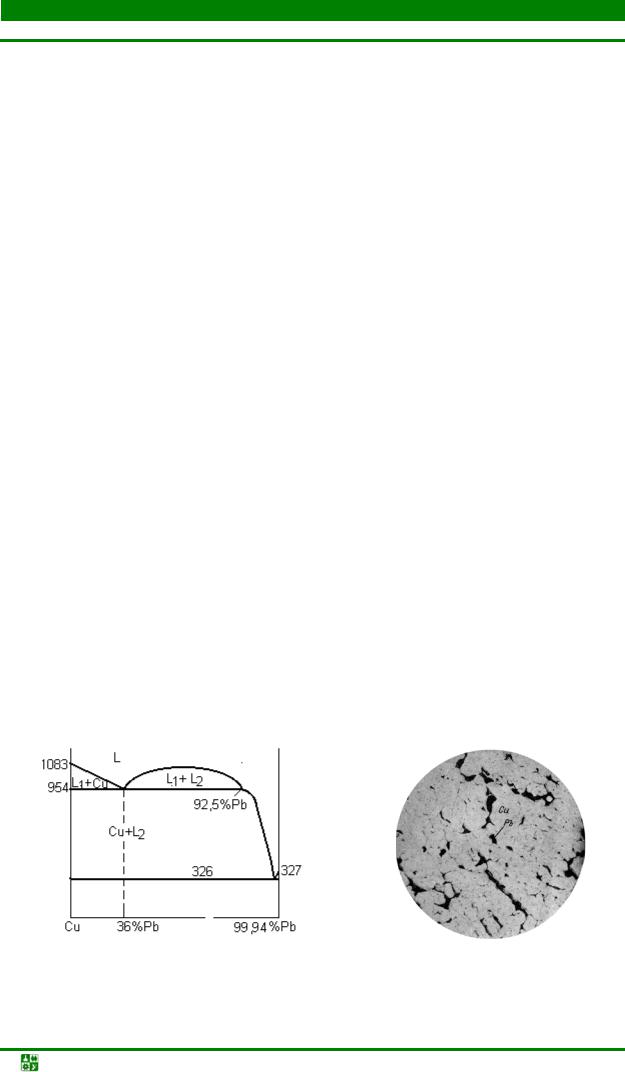
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
образованием другой жидкости L2 состава точки n и кристаллов твердой фазы, компонента В.
Рассмотрим фазовые превращения, протекающие в сплаве (рис. 3.36). Выше линии расслоения все сплавы диаграммы находятся в состоянии однородного жидкого раствора.
При охлаждении в интервале температур от точки 1 до точки 2 происходит расслоение жидкого раствора. Жидкость L1 меняет состав по линии 1'n ;жидкость L2 по линии 1m. Монотектическое превращение Lm → Ln + B происходит при постоянной температуре в точке 2. Последующее понижение температуры от точки 2 до точки 3 приводит к дополнительному выделению кристаллов В из жидкости: Ln-e → B. Кристаллизация сплава заканчивается при температуре точки 3 распадом жидкости по эвтектической реакции: Le → A + B. Сплав при комнатной температуре содержит две структурные составляющие: кристаллы компонента В, образовавшиеся при и после монотектической реакции, и эвтектические кристаллы (А + В)э.
Типичной диаграммой с наличием ограниченной растворимости в жидком состоянии является система Cu–Pb (рис. 3.37, а). В этой системе жидкость L1 при температуре 954 ºС содержит 64 % Cu и 36 % Pb, а L2 – 92,5 % Pb, т.е. почти чистый свинец.
При 954 ºС жидкость, обогащенная медью (L1 = 64 % Cu), выделяет кристаллы меди, обогащая остающуюся часть жидкости почти до чистого свинца (92,5 % Pb), которая обозначена L2. Ниже линии монотектического превращения сплав будет состоять из твердой меди и несколько обогащенного медью жидкого свинца. По мере охлаждения от 954 до 326 ºС жидкость L2 очищается от меди путем выделения дополнительного ее количества в связи с уменьшением растворимости до 99,94 % Pb. При 326 ºС затвердевает почти чистый свинец (эвтектика с содержанием меди 0,06 %). Все сплавы диаграммы при комнатной температуре содержат в структуре кристаллы меди и эвтектические включения (рис. 3.37, в, г). Мелкие включения представляют собой вырожденную эвтектику в виде тонких прожилок почти чистого свинца
(рис. 3.37, б).
а |
б |
Материаловедение. Учеб. пособие |
-130- |
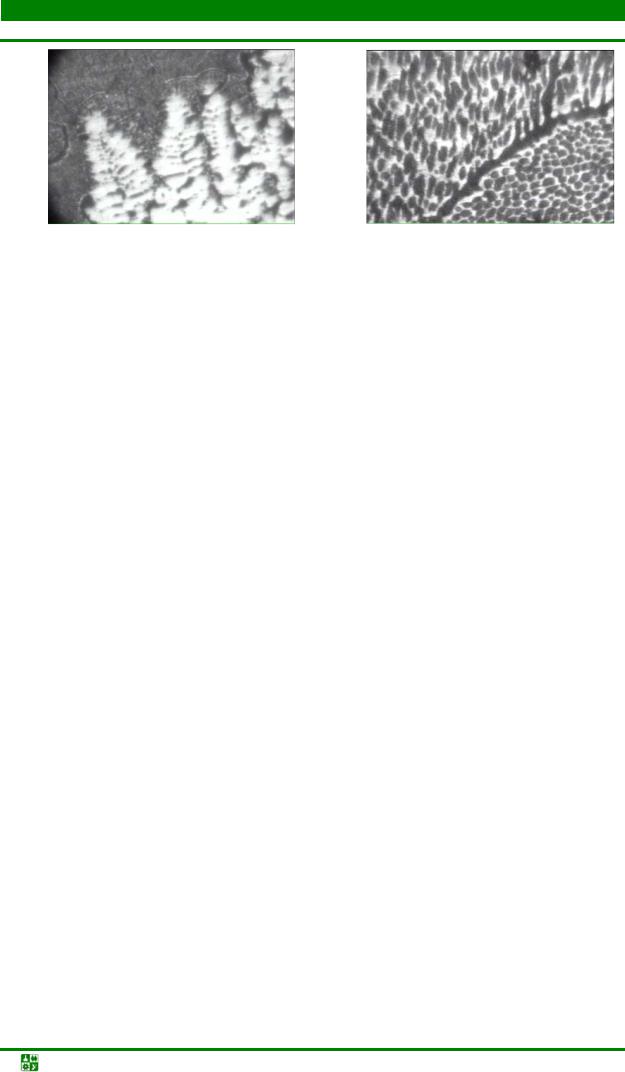
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
в |
г |
Рис. 3.37. Диаграмма состояния системыCu–Pb (а) и структура сплава Cu–30 % Pb (б) ×100, форма кристаллов на границе с эвтектикой (в) и структура эвтектики (г). ×1 000
При кристаллизации таких сплавов часто образуется сегрегация в слитках, появившаяся в результате разницы удельных весов двух фаз. Для уменьшения сегрегации, увеличения однородности слитков применяют ускоренное охлаждение, механическое и электромагнитное перемешивание расплава. Очень эффективным оказывается обработка сплавов при кристаллизации ультразвуковыми колебаниями.
Существует небольшое количество систем, в которых расслоение жидкости может завершаться синтектической реакцией, в которых расслоившиеся жидкости в силу своей высокой реакционной способности, способны к химическому взаимодействию с образованием химических соединений.
Диаграммы состояния систем с синтектическим равновесием. Фазовые превращения, структура сплавов. Как уже указывалось выше, обра-
зование промежуточных фаз в системах возможно при химическом взаимодействии двух разнородных жидкостей, в результате которого образуются твердые кристаллы с кристалллической решеткой, отличающейся от строения обоих компонентов, образующих рассматриваемую систему. Такая реакция носит название синтектической.
Возможность протекания этой реакции создается предварительным расслоением высокотемпературной жидкости на два жидких раствора, разделяющихся между собой некоторой поверхностью раздела. По мере понижения температуры расслаивающихся жидкостей их составы изменяются в направлении обогащения, соответственно, одним и другим компонентами, вплоть до тех концентраций, при которых оказывается возможным их химическое взаимодействие на межфазных границах с образованием твердых кристаллов промежуточной фазы. Такая реакция, как и все вышерассмотренные, соответствует трехфазному равновесию, что отвечает нонвариантным условиям, т.е. образование химического соединения (промежуточной фазы) по механизму синтектической реакции происходит при постоянной температуре.
Примером диаграммы синтектического типа может служить система олово–фосфор (рис. 3.38).
Материаловедение. Учеб. пособие |
-131- |
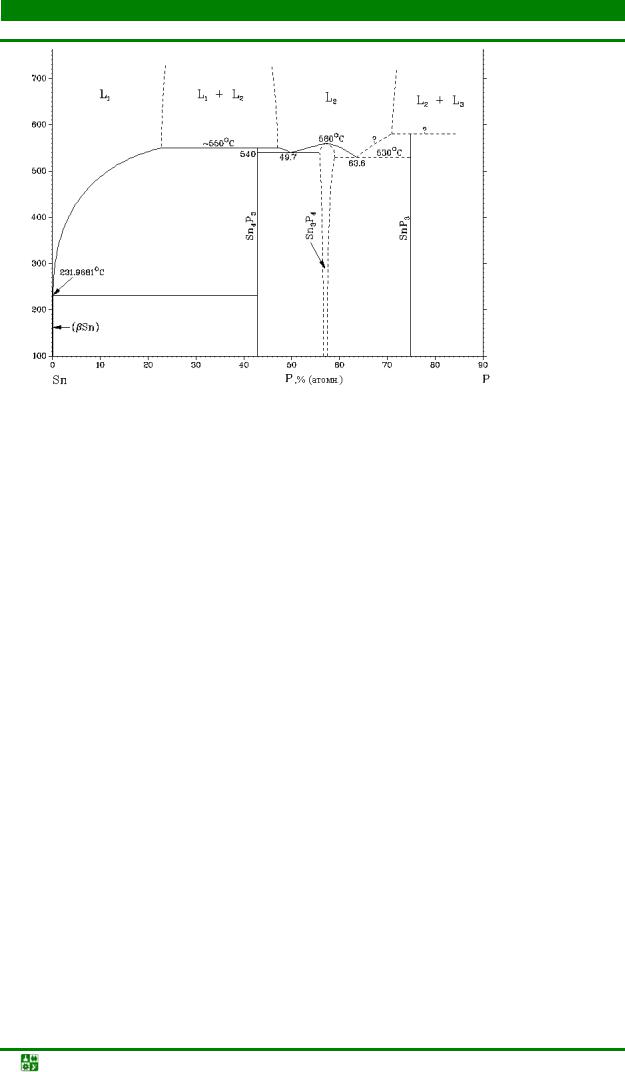
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Рис. 3.38. Диаграмма состояния олово–фосфор
Как видно из приведенной диаграммы, по механизму синтектической реакции в системе олово–фосфор образуются две из трех промежуточные фазы: Sn4P3 и SnP3. Оба эти соединения постоянного состава. Линии, соответствующие развитию синтектических реакций, указаны на диаграмме.
Температура первого из них соответствует 550 ºС, для другого соединения она окончательно не установлена.
3.9. Диаграммысостояниясистем наосновеполиморфныхкомпонентов
Полиморфизм связан с тем, что кристаллические вещества в зависимости от температуры и давления имеют различную кристаллическую решетку. К полиморфным металлам относятся Fe, Ti, Mn, Sn, их разные модификации обозначаются буквами α, β, γ. Железо имеет модификации Fe-α, Fe-γ, Fe-δ; титан имеет модификации Ti-α, Ti-β. При полиморфном превращении меняется не только тип кристаллической решетки, но и её компактность. Компактность решетки обычно уменьшается с повышением температуры. Полиморфное превращение относится к фазовым переходам первого рода и сопровождается выделением скрытой теплоты превращения. Изменение типа кристаллической решетки у металлов происходит при постоянной темпера-
туре: С = 2 – Ф = 2 – 2 = 0.
Если компоненты нерастворимы друг в друге и образуют систему эвтектического типа, причем хотя бы один из компонентов обладает полиморфизмом, то полиморфное превращение отразится на фазовой диаграмме по-
Материаловедение. Учеб. пособие |
-132- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
явлением горизонтальной линии, которая соответствует температуре перехода модификации Aβ в Aα (рис. 3.39).
Рис. 3.39. Диаграмма эвтектического типа, образованная компонентами, нерастворимыми друг в друге, один из которых (А) – полиморфный
Фаза Aβ превратится в Aα во всех сплавах, в каких бы структурных состояниях она ни находилась (в виде свободной избыточной фазы или кристаллов, входящих в состав эвтектики). Причем это превращение произойдет при постоянной температуре, поскольку: С = 2 – 3 + 1 = 0.
Если сплавы кристаллизуются с образованием ограниченных или неограниченных твердых растворов и одновременно претерпевают полиморфные превращения, то превращения в твердых растворах будут происходить с теми же закономерностями, которые были рассмотрены для различных случаев кристаллизации жидких растворов.
Как и в случае кристаллизации жидких растворов, при превращениях растворов в твердом состоянии можно наблюдать переход одного твердого раствора в другой или в смесь двух фазовых составляющих.
Основной особенностью превращений в твердом состоянии является значительно меньшая скорость диффузионных процессов, в связи с чем для протекания превращений по равновесному механизму требуются значительно меньшие скорости охлаждения. В реальных условиях охлаждения, наиболее часто применяемых на практике, превращения происходят с более значительными отступлениями от равновесных условий. Твердые растворы оказываются склонными к значительным переохлаждениям и к получению неравновесных состояний, что позволяет получать резко различные степени дисперсности образующихся фазовых и структурных составляющих.
Диаграммы состояния систем с нонвариантным эвтектоидным равновесием. Рассмотрим систему с ограниченной растворимостью компонентов твердом состоянии и наличием полиморфных превращений у обоих компонентов (рис. 3.40).
Материаловедение. Учеб. пособие |
-133- |
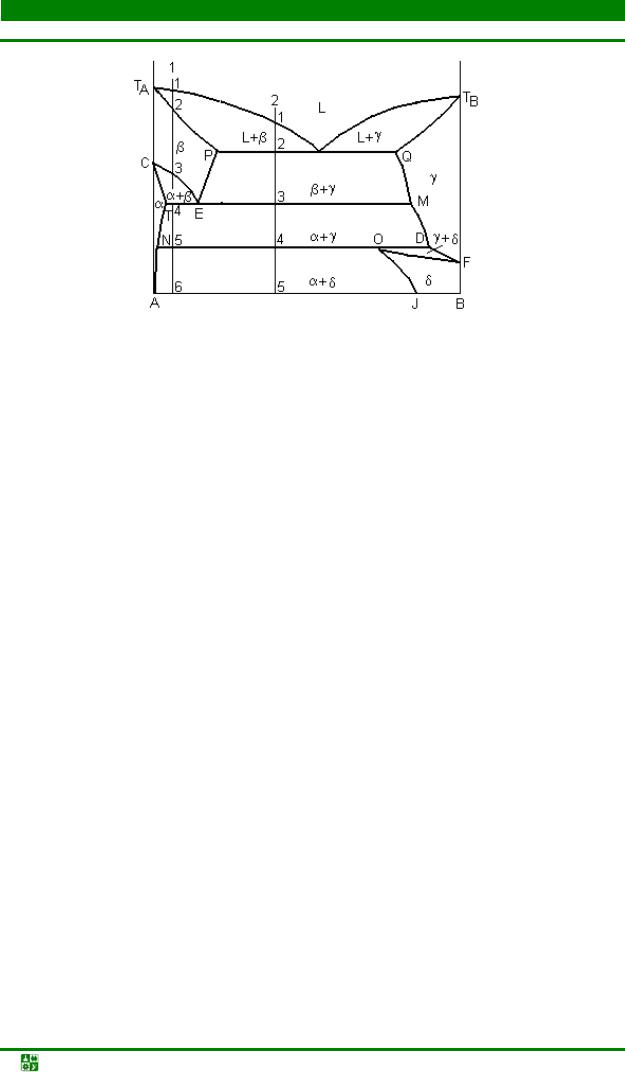
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Рис. 3.40. Диаграмма с ограниченной растворимостью компонентов в твердом состоянии и наличием полиморфных превращений у обоих компонентов
В сплаве 1 в интервале температур 1–2 происходит кристаллизация твердого раствора. При достижении солидуса кристаллизация сплава заканчивается, и от точки 2 до точки 3 образовавшийся β-твердый раствор никаких превращений не претерпевает. В точке 3 начинается процесс перекристалли-
зации (полиморфное, аллотропическое превращение твердого раствора).
При этом постепенно с понижением температуры от точки 3 до точки 4 увеличивается количество кристаллов α-фазы с новой кристаллической решеткой. Количество α- и β-фаз определяется конодами, проведенными при соответствующих температурах.
В точке 4, оставшаяся не превращенной часть β-твердого раствора, распадается на смесь кристаллов α- и γ-фаз. Это превращение аналогично эвтектическому. Отличие заключается лишь в том, что физико-химическая смесь двух фаз образуется путем распада не жидкого, а твердого раствора. Такое превращение называется β → αТ + γМ эвтектоидным, а смесь фаз (α + γ)э, полученная из твердого раствора, называется эвтектоидом. Точка Е –
эвтектоидная.
Распад одной твердой фазы на две другие твердые фазы сопровождается значительным диффузионным перераспределением атомов компонентов. Эвтектоид образуется в результате совместного зарождения и роста двух фаз. Эвтектоидная смесь кристаллов имеет более тонкое внутреннее строение по сравнению с эвтектической смесью, кристаллизующейся из расплава. На шлифах эвтектоид обычно характеризуется пластинчатым, реже мелкозернистым строением.
Кривые сольвуса ТN и МD определяют уменьшение растворимости компонентов в граничных α- и γ-твердых растворов с понижением температуры. Охлаждение сплава в интервале температур 4–5 приводит к некоторому перераспределению компонентов A и B между α- и γ-фазами и изменению относительного количества этих фаз в связи с изменением растворимости.
Материаловедение. Учеб. пособие |
-134- |
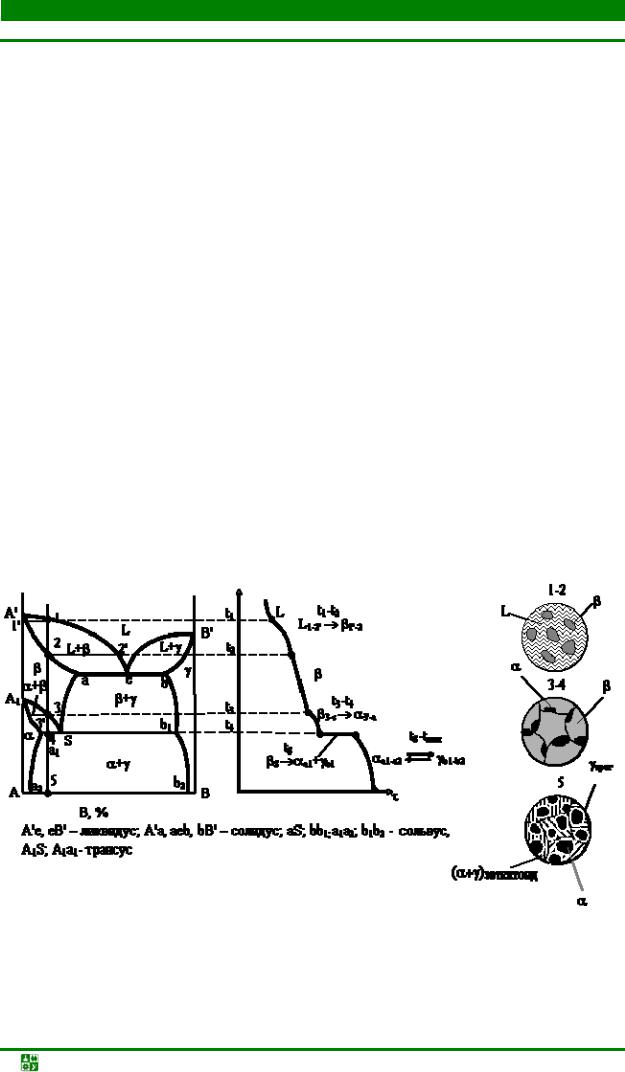
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Уменьшение растворимости приводит также к выделению из кристаллов α- твердого раствора третичных кристаллов γ-твердого раствора, а из эвтектоидных кристаллов γ-твердого раствора – вторичных кристаллов α-твердого раствора.
При температуре точки 5 происходит взаимодействие α- и γ-фаз с образованием нового твердого раствора δ. Механизм этого превращения подобен перитектическому. Такое превращение αN + γD → δO, заключающееся во взаимодействии двух твердых фаз с образованием новой твердой фазы, называется перитектоидным. После окончания перитектоидного превращения состав α- и δ-фаз и их относительное количество изменяется по кривым ограниченной растворимости NА и OJ.
Всплаве 2 кристаллизация в интервале температур 1–2 идет так же, как
ив сплаве 1, по механизму кристаллизации твердого раствора. При этом об-
разуются первичные кристаллы β-твердого раствора. Оставшаяся часть жидкости при эвтектической температуре (точка 2) кристаллизуется в виде эвтектики (β + γ)э. В интервале температур 2–3 идет изменение состава фаз в связи с ограниченной переменной растворимостью по линиям PE и QM. При температуре точки 3 кристаллы β-фазы, как первичные, так и входящие в состав эвтектики, претерпевают распад с образованием эвтектоида (α + γ)э. В интервале температур 3–4 идет изменение составов твердых фаз, а при температуре точки 4 в результате взаимодействия фаз α + γ образуется новая фаза δ по перитектоидной реакции. Дальнейшее охлаждение в двухфазной области приводит вновь к изменению составов и относительного количества α- и δ-фаз.
Рис. 3.41. Диаграмма состояния системы с нонвариантными эвтектоидным и эвтектическим равновесиями. Кривая охлаждения и формирование структуры доэвтектоидного сплава
Материаловедение. Учеб. пособие |
-135- |
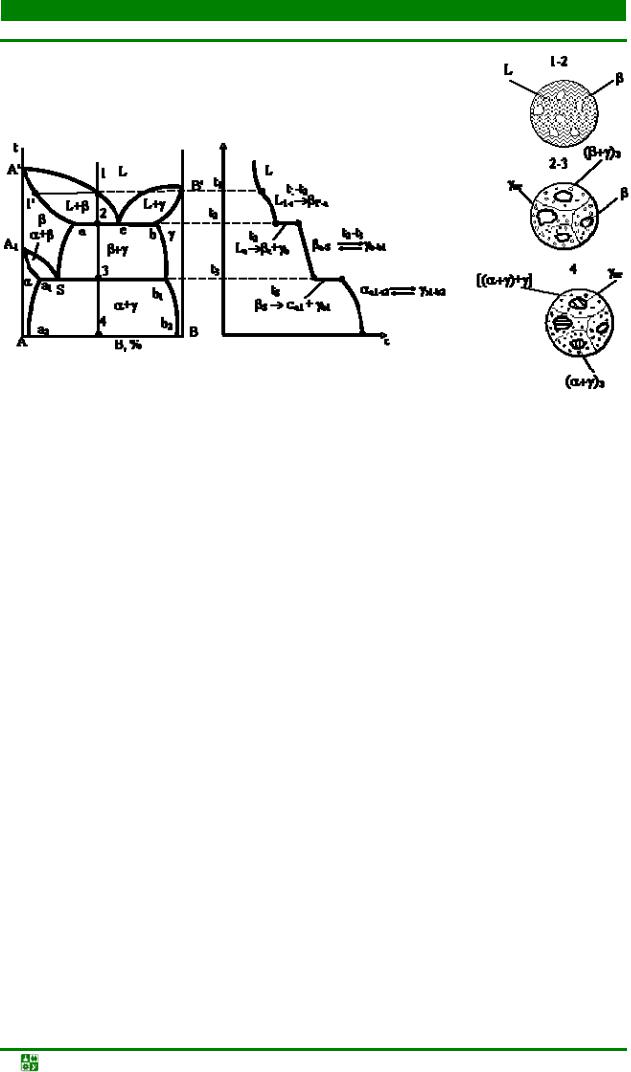
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Рис. 3.42. Диаграмма состояния системы с нонвариантными эвтектоидным и эвтектическим равновесиями. Кривая охлаждения и поэтапное формирование структуры доэвтектического сплава
Диаграмма состояния системы с нонвариантными эвтектоидным и эвтектическим равновесиями показана на рис. 3.41, рис. 3.42.
Фазы β и α представляют собой граничные твердые растворы на основе высоко- и низкотемпературной модификации полиморфного компонента А, а фаза γ – граничный твердый раствор на основе второго компонента В. Сплавы составом от точки а1 до точки S относятся к доэвтектоидным, сплав состава точки S – эвтектоидный, а от точки S до точки b1 относятся к заэвтектоидным. Эвтектоидное превращение для сплавов, пересекающих горизонталь а1S b1 реализуется по следующей реакции: βS → αа1 + γb1. На рис. 3.41, рис. 3.42 изображены схематичные кривые охлаждения, описаны фазовые превращения и представлены структуры доэвтектоидного и доэвтектического сплава.
Рассмотрим фазовые превращения, протекающие в доэвтектоидном сплаве (рис. 3.41). Сплав кристаллизуется с образованием β-фазы в интервале температур от точки 1 до точки 2. Ниже солидуса происходит физическое охлаждение β-кристаллов.
При температурах ниже точки 3 идут фазовые превращения: вначале полиморфное превращение β- в α-кристаллы (β3-s→ α3'-a1) в интервале температур от точки 3 до точки 4, затем эвтектоидная реакция βs→ αa1 + γb1 при постоянной температуре ts. Понижение температуры от ts до комнатной приводит к выделению из α-кристаллов, образовавшихся в результате полиморфного и эвтектоидного превращений, третичных γ-кристаллов и вторичных α-кристаллов из γ-кристаллов эвтектоидного происхождения. Причем такие выделения α-кристаллов в составе эвтектоидной смеси никак не отражаются
Материаловедение. Учеб. пособие |
-136- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
на видимой микроструктуре сплава. В структуре сплава присутствует главным образом три структурные составляющие: избыточные α-кристаллы, образовавшиеся в результате полиморфного превращения β → α, эвтектоид (α + γ)э и третичные γ-кристаллы по границам избыточных α-кристаллов.
Фазовые превращения, структура и кривая охлаждения доэвтектического сплава представлены на рис. 3.42. Первичная, эвтектическая кристаллизация сплава и выделение вторичных фаз описана выше. При охлаждении сплава ниже температуры точки 3 происходит эвтектоидное превращение βs→(αa1 + γb1)э как в первичных β-кристаллах, так и в β-фазе, входящей в состав эвтектики. Структура доэвтектического сплава при комнатной температуре состоит: из превращенных в эвтектоид (α + γ)э первичных кристаллов, выделяющихся по периметру бывших первичных кристаллов прожилок вторичных кристаллов γ-фазы, и превращенной эвтектики [(α + γ)э + γ]э.
3.10.Диаграммыфазовогоравновесия
втрехкомпонентныхсистемах
Геометрические основы изображения диаграмм состояния трой-
ных систем. Все реальные технические сплавы содержат по 3, 4 и более компонентов, поэтому наиболее полно описывают превращения в реальных сплавах тройные системы.
Если составы двойных сплавов изображают отдельными точками на отрезке АВ, то для изображения составов тройных сплавов, образованных компонентами А, В и С, необходима плоскость. Геометрической фигурой, на плоскости которой обычно изображают составы различных тройных сплавов, служит равносторонний концентрационный треугольник. В вершинах этого треугольника находятся компоненты А, В и С; три равные стороны служат для изображения составов двойных сплавов А–В, В–С, А–С, а плоскость, ограниченная сторонами треугольника, для изображения составов тройных сплавов А–В–С.
При построении диаграмм состояния тройных систем приходится решать две взаимосвязанные задачи:
а) по положению фигуративной точки (проекция фигуративной линии сплава на плоскость концентрационного треугольника) тройного сплава на плоскости концентрационного треугольника определять его химический состав;
б) по заданному составу тройного сплава отыскивать положение фигуративной точки на плоскости концентрационного треугольника.
Для решения этих задач можно воспользоваться одним из свойств равностороннего треугольника:
Сумма трех отрезков Са1, Вс1, Ab1, отсекаемых на сторонах треугольника АВС прямыми а1a2, b1b2, c1c2, которые проходят через любую фигуративную точку сплава М внутри треугольника параллельно его сторо-
Материаловедение. Учеб. пособие |
-137- |
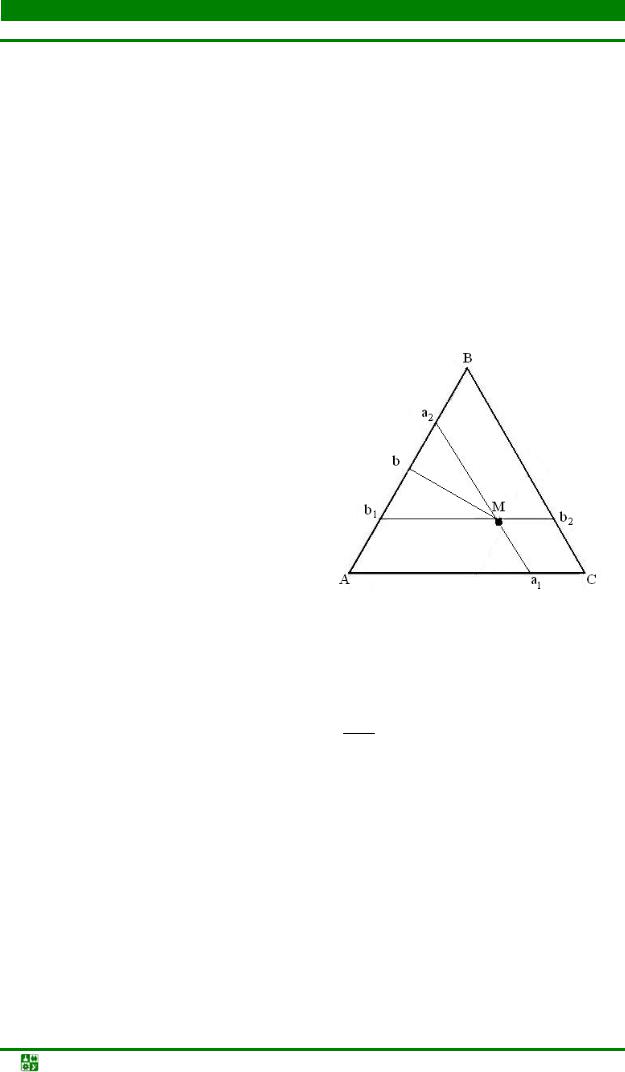
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
нам, есть величина постоянная и равна стороне треугольника, например АВ,
т.е. Са1 + Аb1 + Bc1 = const = АВ (рис. 3.43).
Если одну из сторон концентрационного треугольника АВС принять равной 1 или 100 %, то с помощью отрезков Са1, Аb1 и Вс1 можно определить концентрацию компонентов в тройном сплаве М. Поскольку фигуративная точка сплава лежит ближе к стороны ВС, то сплав содержит компонентов В и С больше, чем компонента А. Значит, концентрация компонента А пропорциональна отрезку Са1. Содержание компонента С в сплаве М превышает (рис. 3.43) содержание компонента В, т.к. фигуративная точка сплава находится ближе к вершине треугольника, изображающей компонент С. Отсюда следует, что концентрации компонента С в сплаве М соответствует пропорциональный ему отрезок Вс1, а концентрации компонента В – средний по величине перпендикуляр Мb и пропорциональный ему отрезок Аb1.
Рис. 3.43. Определение состава сплава М по сумме трех отрезков
Таким образом, концентрации компонентов А, В и С в сплаве определяют следующим образом:
À,% = àÀÂ2B100 % = àÀÑ1Ñ100 % ; Â,% = ÀbÀÂ1 100% = ÑbÑÂ2 100% ;
Ñ,% = ÀñÀÑ2 100% = ÂñÂÑ1 100% ; %А + %В + %С = 100 %.
При отыскании фигуративной точки тройного сплава на плоскости концентрационного треугольника по его заданному химическому составу поступают следующим образом. От одной из вершин треугольника, например вершины компонента А, принятого за основу сплава, по сторонам треугольника АВ и АС, откладывают отрезки Аb1 и Ас2, характеризующие в избранном масштабе концентрацию компонентов С и В. Затем через точки с2 и b1 проводят прямые b2b1, с2c1 параллельно сторонам треугольника АВ и АС. Искомая точка М оказывается на пересечении этих прямых (рис. 3.44).
Материаловедение. Учеб. пособие |
-138- |
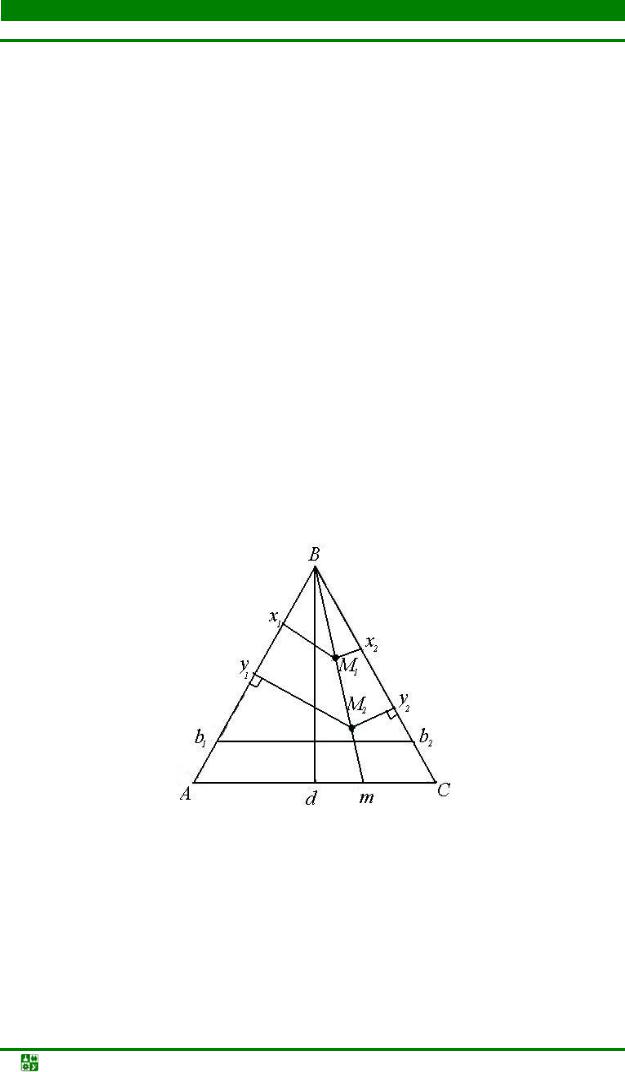
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Рассмотрим особенности химического состава различных групп тройных сплавов.
1.Все сплавы прямой, параллельной одной из сторон концентрационного треугольника, содержат постоянное количество того компонента, который находится в вершине треугольника, лежащей напротив этой прямой. Так,
сплавы прямой b1b2, параллельной стороне АС содержат постоянное количество компонента В, поскольку отрезки Аb1 и Сb2 имеют одну и ту же длину для всех сплавов на этой прямой (рис. 3.44).
2.Все сплавы прямой, проходящей через одну из вершин концентрационного треугольника, содержат в постоянном отношении те компоненты, которые изображаются вершинами треугольника, лежащими по обе стороны от этой прямой. Например, сплавы прямой Вm, проходящей через одну из вершин, характеризуются постоянным отношением концентраций компонентов
А/C. Если в сплаве М1 содержание компонентов А и С невелико, то в сплаве М2 оно значительно. Однако отношение концентрации компонентов C/А в обоих сплавах остается одинаковым: M1x1/M2y1 = M1x2/M2y2 (рис. 3.44).
3.Все сплавы, лежащие на высоте концентрационного треугольника, характеризуются одинаковым содержанием тех компонентов, которые находятся в вершинах концентрационного треугольника по обе стороны от этой высоты. Сплавы высоты Вd содержат в одинаковом количестве компоненты А и С, поскольку сторона АС делится на равные части точкой d: Ad = Cd (рис. 3.44).
Рис. 3.44. Изображение составов тройных сплавов
Диаграмма состояния системы с нонвариантным эвтектическим равновесием. Пространственные диаграммы состояния тройных систем строятся аналогично двойным системам путем изучения термических кривых охлаждения конкретных сплавов с последующим уточнением методами металлографического, дилатометрического, магнитного и других анализов. Графически диаграммы состояния тройных систем изображаются в виде призм на базе концентрационного треугольника.
Материаловедение. Учеб. пособие |
-139- |
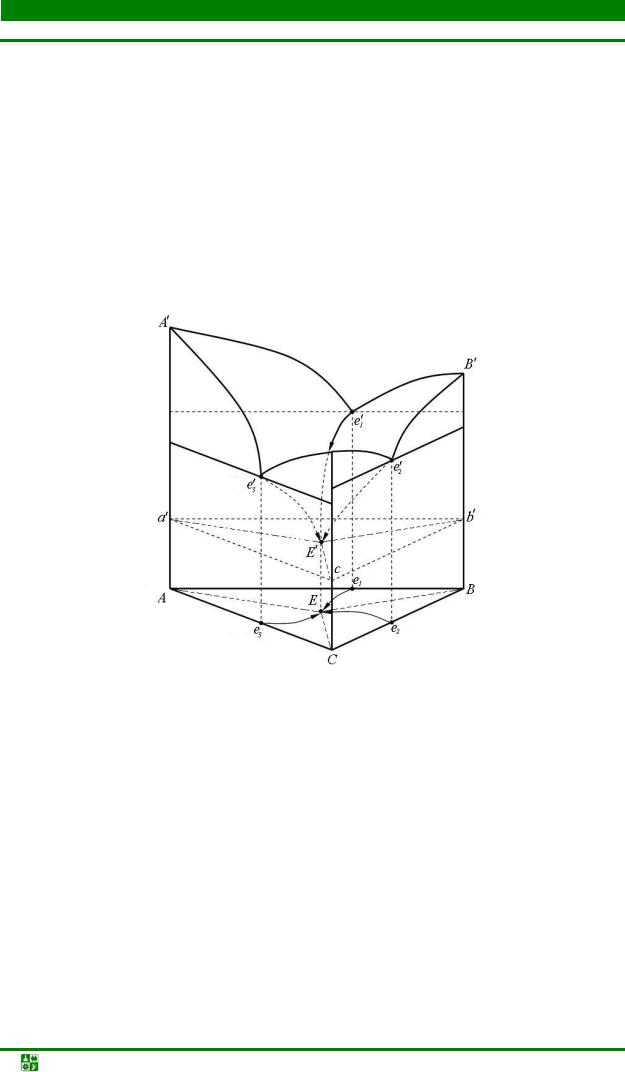
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Температуры фазового равновесия откладываются перпендикулярно к плоскости концентрационного треугольника. На каждой плоскости призмы изображаются двойные диаграммы состояния каждой пары компонентов. Соединяя плавными поверхностями линии двойных диаграмм, соответствующих областям, в которых выделяются одинаковые фазы, получим пространственные диаграммы состояния.
В связи с большими трудностями, встречающимися при построении и использовании пространственных диаграмм, часто пользуются горизонтальными проекциями диаграмм, т.е. концентрационными треугольниками. Причем на концентрационном треугольнике, кроме основных линий, соответствующих определенным критическим точкам, могут откладываться линии изотермы.
Рис. 3.45. Диаграмма состояния с нонвариантным эвтектическим превращением без растворимости в твердом состоянии
Рассмотрим одну из наиболее распространенных тройных диаграмм эвтектического типа без растворимости в твердом состоянии (рис. 3.45). Построение диаграммы заключается в следующем: к плоскости равностороннего треугольника из точек А, В и С восстанавливаются перпендикуляры. На перпендикулярах как ординатах, соответствующих чистым компонентам, откладываются температуры плавления каждого из металлов, входящих в тройной сплав. Получаем трехгранную призму с незаконченным построением верхней части. На каждой из граней строим двойные системы, кристаллизующиеся с образованием эвтектик, состоящих из чистых компонентов. Получим три пары двойных систем А–В, В–С и А–С. Для перехода к тройной системе необходимо прежде всего построение поверхностей ликвидуса. Каждая пара линий ликвидуса, относящаяся к началу кристаллизации одного и того же компонента, даст часть поверхности ликвидуса, соответствующую
Материаловедение. Учеб. пособие |
-140- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
насыщению жидкой фазы этим компонентом. Так, через линии ликвидуса А'е'1 и A'е'3 пройдет поверхность насыщения тройного жидкого раствора компонентом А. Эта поверхность соответствует началу выделения компонента А из тройного жидкого сплава, т.e. является частью поверхности ликвидуса.
То же относится к поверхности ликвидуса, проходящей через линии ликвидуса B'е'1 и B'е'2, являющейся поверхностью насыщения жидкого раствора компонентом В. Аналогично получается поверхность C'е'2E'е'3, соответствующая насыщению жидкого раствора компонентом С. Поверхность ликвидуса понижается по мере увеличения концентрации третьего компонента, добавляемого к первым двум.
Смежные поверхности ликвидуса пересекаются между собой по кривым линиям, являющимся линиями двойных эвтектик в тройном сплаве. Так, поверхности насыщения жидкого раствора компонентами А и В пересекаются между собой по линии двойной эвтектики е'1е' – это линия насыщения жидкого раствора одновременно компонентами А и В.
Поверхности насыщения жидкого раствора компонентами В и С пересекаются по линии двойной эвтектики е'2Е', поверхности насыщения компонентами А и С пересекаются по линии двойной эвтектики е'2E'.
Все три поверхности насыщения пересекаются в общей точке Е', представляющей точку тройной эвтектики. Проектируя линии двойных эвтектик на основание трехгранной призмы, получим плоские кривые е1E, е2Е и е3Е.
Кристаллизация сплавов. Рассмотрим превращения в сплаве определенного состава (точка а) при кристаллизации (рис. 3.47).
В точке а сплав представляет собой однородный тройной жидкий раствор. При понижении температуры несколько ниже точки 1 (т.е. при переохлаждении) начинается кристаллизация компонента А. Жидкий раствор при этом будет изменять свой состав в направлении увеличения в нем концентрации компонентов В и С. Изменение состава жидкого раствора будет происходить по поверхности ликвидуса от точки 1 к точке b' по линии 1b'. Проекция кривой изменения состава жидкого раствора будет представлять собой прямую линию аb, проходящую через вершину треугольника А (рис. 3.46).
При выделении кристаллов чистого компонента А концентрация компонентов В и С в жидкой фазе должна увеличиваться. Но абсолютные количества компонентов В и С, находящихся в жидком растворе, остаются неизменными, отношение их процентных содержаний должно сохраняться постоянным. Это возможно только тогда, когда состав жидкой фазы будет изменяться по прямой линии, проходящей через угол треугольника, образованный сторонами АВ и АС, ибо только в этом случае (рис. 3.47)
àdàñ = egef = keki .
По мере выделения кристаллов компонента А жидкая фаза, изменяя свой состав, достигнет точки b. В этот момент она становится насыщенной компонентами А и В одновременно При понижении температуры раствори-
Материаловедение. Учеб. пособие |
-141- |
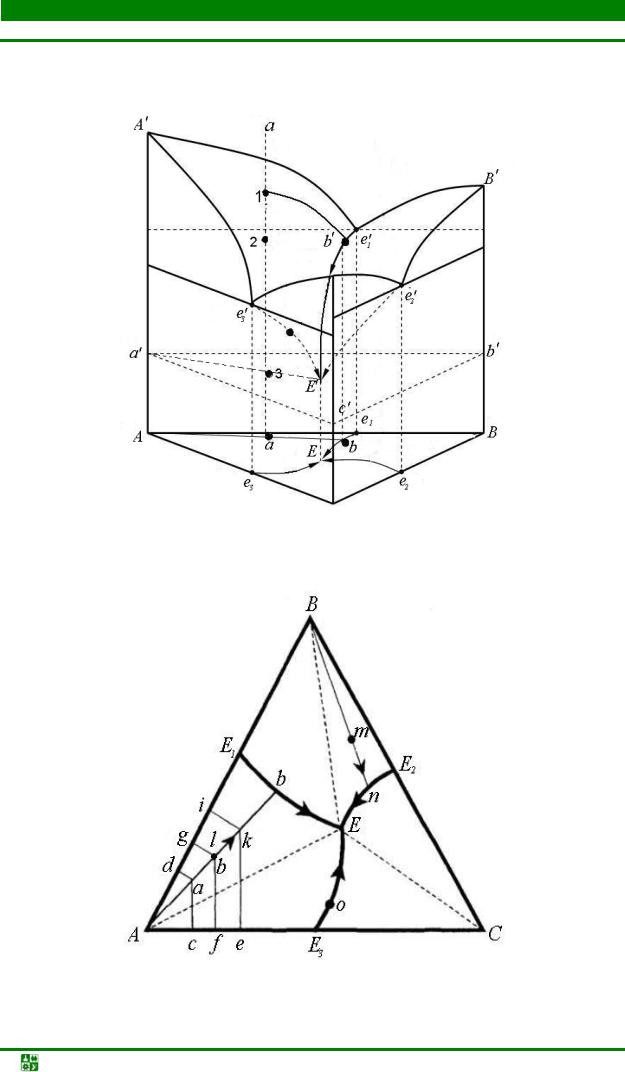
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
мость компонентов А и В в жидкой фазе уменьшается, поэтому из жидкого раствора начнут выделяться кристаллы А и В одновременно, т.е. образуется двойная эвтектика.
Рис. 3.46. Тройная диаграмма эвтектического типа без растворимости в твердом состоянии
Рис. 3.47. Изменение состава жидкой фазы при кристаллизации тройного сплава
Материаловедение. Учеб. пособие |
-142- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
В пространственной диаграмме состав жидкого раствора при выделении двойной эвтектики будет изменяться по линии E'1E' от точки b' к точке Е'. В проекции это изменение состава жидкой фазы будет происходить по плоской кривой E1E от точки b к точке Е.
Таким образом, на всем протяжении изменения состава жидкого раствора от точки b' до точки E' (рис. 3.47) будет происходить кристаллизация двойной эвтектики. Как только жидкая фаза будет иметь состав, соответствующий точке Е' (в проекции – точка Е), начнется образование тройной эвтектики. В это время температура сплава будет соответствовать точке 3. Тройная эвтектика, в отличие от двойной эвтектики и чистого компонента, будет выделяться при постоянной температуре.
Проверить условия кристаллизации чистого компонента, двойной и тройной эвтектики можно при помощи правила фаз.
При образовании тройной эвтектики число фаз становится равным 4: жидкая фаза эвтектического состава и три твердых фазы, представляющие собой кристаллы А, В и С. Тогда
С = К – Ф + 1 = 3 – 4 + 1= 0,
т.е. система становится нонвариантной, и процесс превращения будет происходить при постоянной температуре до полного исчезновения жидкой фазы. Термическая кривая рассмотренного сплава имеет вид, представленный на рис. 3.48.
Конечная структура рассмотренного сплава а будет состоять из кристаллов А, двойной эвтектики А + В и тройной эвтектики А + В + С. Любой тройной сплав рассматриваемой системы в условиях медленного охлаждения будет испытывать эвтектическое превращение при постоянной температуре, соответствующей положению точки тройной эвтектики пространственной диаграммы.
Совокупность точек, соответствующих постоянной температуре образования тройной эвтектики, дает температурную плоскость, называемую эвтектической плоскостью тройного сплава. Эта плоскость параллельна основанию трехгранной призмы и проходит через точку Е'. На рис. 3.46 она обозначена как плоскость a'b'c'.
Сплавы, расположенные на максимальных конодах: АЕ, BE и СЕ (рис. 3.47), проходящих через углы треугольника и точку тройной эвтектики, обладают той особенностью, что в их структуре должны отсутствовать двойные эвтектики.
Первичные кристаллы чистых компонентов будут отсутствовать в сплавах, составы которых расположены на линиях двойных эвтектик. В этом случае непосредственно из жидкого раствора будут выделяться кристаллы двойной эвтектики, а затем кристаллы тройной эвтектики. Сплавы, составы которых лежат на сторонах равностороннего треугольника, кристаллизуются как двойные.
Материаловедение. Учеб. пособие |
-143- |
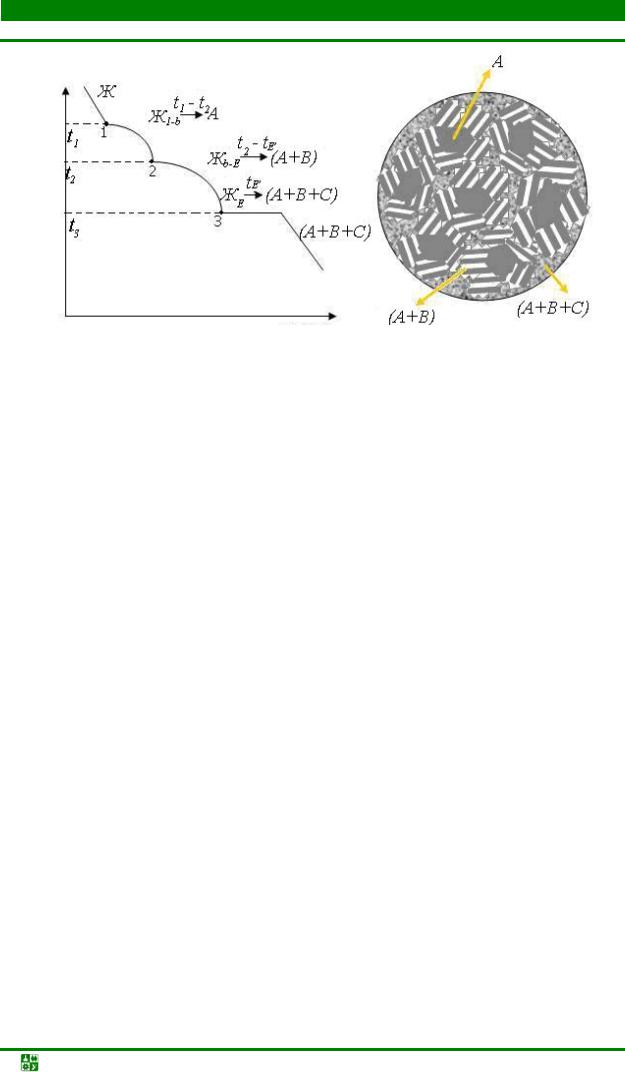
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Температура
Время
Рис. 3.48. Кривая охлаждения сплава а
Из анализа процессов превращения в тройных системах можно видеть, что для определения хода процесса кристаллизации и изменения состава жидкого раствора к пользованию пространственной диаграммой можно и не прибегать, а рассмотреть эти процессы на концентрационном треугольнике.
Так, сплав состава точки k (рис. 3.47) будет кристаллизоваться сначала путем выделения кристаллов компонента С, затем, с момента достижения жидкой фазой состава точки Р, будут выделяться кристаллы двойной эвтектики, и, наконец, когда жидкая фаза примет состав точки Е, произойдет образование тройной эвтектики. Конечная структура сплава будет состоять из кристалла компонента С, двойной эвтектики В + С и тройной эвтектики А + В + С.
Для полноты картины при изучении превращений в тройных сплавах на горизонтальной проекции поверхностей необходимо иметь указания температур, в области которых происходят переходы сплавов из одного состояния в другое.
Такие температуры наносятся в форме изотерм, полученных путем горизонтальных сечений поверхностей ликвидуса плоскостями, проведенными параллельно основанию трехгранной призмы и спроектированных на основание призмы, – концентрационный треугольник АВС (рис. 3.49).
На основании анализа процессов превращений в тройных сплавах при медленном охлаждении следует предполагать наличие структурных составляющих в отдельных областях диаграммы состояния (рис. 3.49, табл. 3.1).
Материаловедение. Учеб. пособие |
-144- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Рис. 3.49. Проекция тройной системы на плоскость концентрационного треугольника с нанесением изотерм кристаллизации
Таблица 3.1
Структурные составляющие тройных сплавов эвтектического типа
Область |
Структурные составляющие |
1Кристаллы А + двойная эвтектика (А + В) + тройная эвтектика
2Кристаллы В + двойная эвтектика (А + В) + тройная эвтектика
3Кристаллы В + двойная эвтектика (В + С) + тройная эвтектика
4Кристаллы С + двойная эвтектика (В + С) + тройная эвтектика
5Кристаллы С + двойная эвтектика (А + С) + тройная эвтектика
6Кристаллы А + двойная эвтектика (А + С) + тройная эвтектика
Изотермические (горизонтальные) разрезы. Знание пространствен-
ной диаграммы тройной системы позволяет построить изотермические разрезы, необходимые для определения фазовых составляющих системы, находящихся в состоянии равновесия при той или иной определенной температуре. На рис. 3.50 показан изотермический разрез рассматриваемой диаграммы при 950 ºС.
Материаловедение. Учеб. пособие |
-145- |
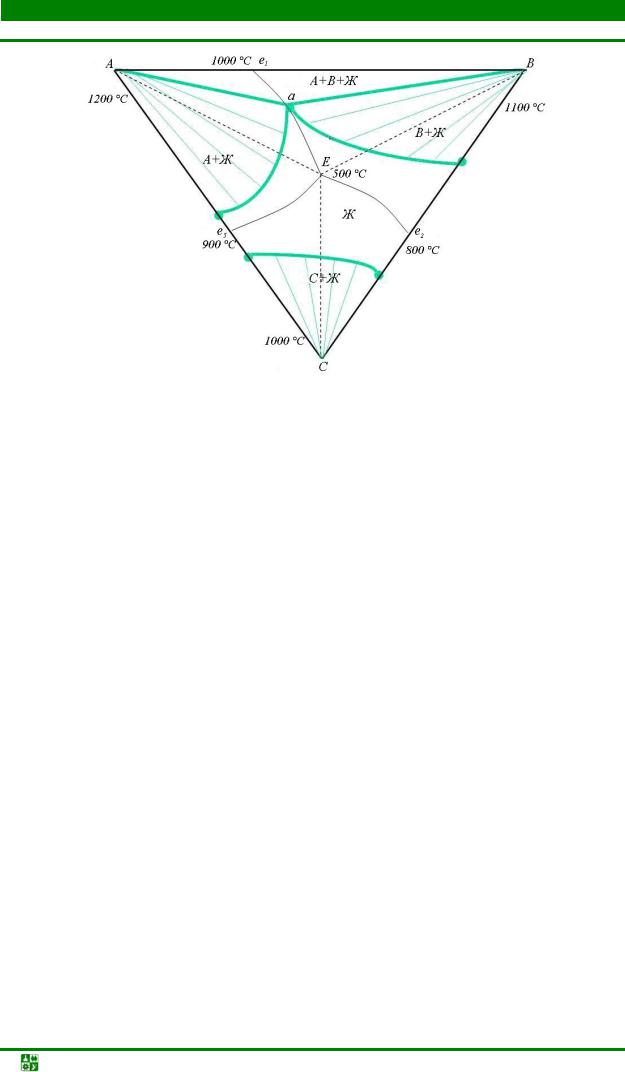
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Рис. 3.50. Изотермический разрез при температуре 950 °С
На изотермическом разрезе при 950 °С мы видим сечение плоскостью разреза трех поверхностей ликвидус компонентов А, В и С и одной линейчатой поверхности начала кристаллизации двойной эвтектики (А + В) в виде конодного треугольника АаВ. В двухфазных областях (А + Ж), (В + Ж), (С + Ж) показаны коноды. Особенность всех изотермических разрезов – трехфазные области всегда ограничены прямыми линиями – сторонами конодного треугольника.
Политермические (вертикальные) разрезы. При изучении превраще-
ний в тройных системах часто пользуются политермическими разрезами, которые позволяют определить превращения, происходящие при кристаллизации сплавов строго определенного состава.
Вбольшинстве случаев исследуют разрезы, проходящие через вершину концентрационного треугольника тройной системы, для которых характерно постоянство отношений двух из компонентов сплава или разрезы, проходящие параллельно одной из сторон треугольника.
На горизонтальной проекции тройной системы (рис. 3.51) проведена линия cd, представляющая след от вертикальной секущей плоскости, по которой мы и будем строить политермический разрез, параллельный стороне А–В (рис. 3.52).
Всплавах, составы которых лежат между точками с и k, будут первично выделяться кристаллы A, а сплава участка k–d – кристаллы В. После первичной кристаллизации в сплавах участка c–i будет кристаллизоваться двойная эвтектика (А + С); в сплавах участка i–l – двойная эвтектика (А + В), а в
сплавах участка l–d – двойная эвтектика (В+С). При температуре tE все сплавы политермического разреза заканчивают кристаллизацию с образованием тройной эвтектики (А + В + С).
Материаловедение. Учеб. пособие |
-146- |
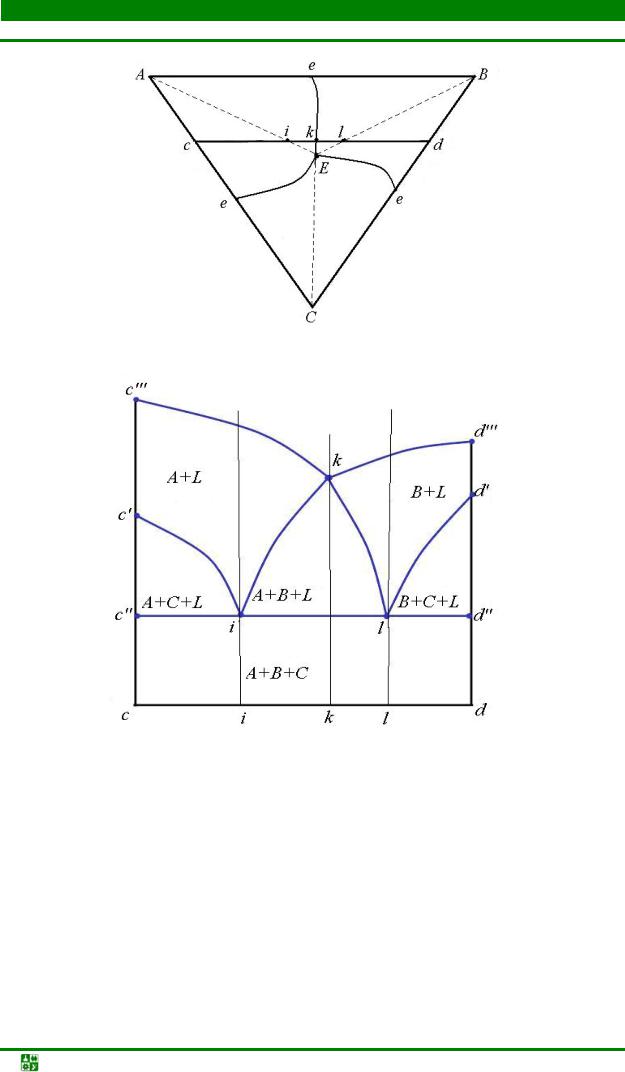
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Рис. 3.51. Проекция вертикального разреза c–d
Рис. 3.52. Политермический разрез c–d
Для проверки правильности построения разрезов служит закон о «соприкасающихся пространствах состояний».
Этот закон, основанный на термодинамических данных о фазовых превращениях, указывает на то, что два пространства состояний могут граничить между собой по некоторой поверхности только в том случае, если число фаз в этих пространствах отличается не больше, чем на единицу.
Это значит, что однофазное состояние, например, может граничить по поверхности раздела только с двухфазным (трехфазное – с двухфазным состоянием из первичных кристаллов и жидкой фазы) или двухфазное – с
Материаловедение. Учеб. пособие |
-147- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
трехфазным (первичные кристаллы вместе с жидким раствором и двойная эвтектика вместе с жидким раствором).
Политермические разрезы не изображают фазовых равновесий, а характеризуют только фазовые состояния тройных сплавов при каких-либо температурах. Значит, в плоскости разреза нельзя показать коноды.
3.11. Зависимостьсвойствсплавовотихсостава
Зависимость физических, механических и технологических свойств сплавов от их фазового состава определяется так называемыми правилами Курнакова, которые говорят, что изменение свойств сплавов находится в тесной связи с характером взаимоотношений компонентов сплава.
а б
Рис. 3.53. Зависимость физических и технологических свойств сплавов: а – типа твердых растворов; б – смесей твердых растворов
Физические свойства твердых растворов изменяются по кривым, час-
то имеющим максимум или минимум (рис. 3.53).
Твердость и прочность твердого раствора всегда больше средней арифметической этих свойств для чистых металлов. Повышение твердости и прочности в твердых растворах, в отличие от чистых металлов, сочетается с сохранением достаточно высоких значений пластичности.
Электросопротивление твердых растворов при комнатной температуре много больше, чем у чистых металлов. Температурный коэффициент электросопротивления изменяется по кривой с минимумом таким образом, что сплавы, обладающие максимальным удельным электросопротивлением, меньше всего изменяют его величину с изменением температуры.
Высокая пластичность твердых растворов определяет хорошую обрабатываемость давлением. Однако обрабатываемость резанием однородных твердых растворов очень низка, что объясняется также их повышенной вязкостью.
Материаловедение. Учеб. пособие |
-148- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
С увеличением расстояния (по горизонтали) между ликвидусом и солидусом усиливается дендритная ликвация сплавов и уменьшается жидкотекучесть сплавов.
Физические свойства смесей фаз при низких температурах изменяются по кривым, близким к прямым, и поэтому, как правило, являются средними между свойствами отдельных фаз смеси.
Дисперсные смеси могут резко отличаться по свойствам от грубых смесей и обычно обладают повышенной твердостью и пределом прочности. Свойства смесей, способных при температурах испытания взаимодействовать друг с другом, изменяются по кривым, резко отличающимися от прямых.
Графики изменения свойств смеси, например, эвтектики определяются прямыми линиями, соединяющими значения этих свойств для чистых компонентов или твердых растворов, образованных на их основе. В случае системы эвтектического типа с ограниченной растворимостью в твердом состоянии кривые для свойств сплавов будут комбинироваться из криволинейных участков в области твердых растворов, и участков, близких к прямолинейным – в области смеси двух фаз (рис. 3.53, б). Такой вид кривых характерен как для твердости, так и удельного электросопротивления, а также температурного коэффициента электросопротивления.
Если взаимная растворимость фаз с изменением температуры резко изменяется, испытания смеси при высоких температурах показывают несколько повышенные значения пластичности и пониженные по твердости. Это объясняется тем, что в процессе испытания происходят диффузионные процессы, связанные с изменением растворимости; эти процессы, кроме того, обеспечивают условия диффузионного перемещения вещества, необходимого для пластического течения металла и залечивания, возникающих микроочагов разрушения. Это приводит к дополнительному пластическому течению металла, определяющему повышение его пластичности и уменьшение твердости. Отклонения от прямолинейной зависимости свойств в связи с протеканием данного процесса может достигать значительных величин, причем пластичность смеси может оказаться выше пластичности чистых компонентов.
Технологические свойства смесей имеют ряд особенностей. Обрабаты-
ваемость давлением смесей гораздо хуже, чем у однофазных твердых растворов. При обработке давлением смесей часто возникает явление красноломкости – склонность к образованию трещин при горячей пластичной деформации в результате образования легкоплавких эвтектик, или «хладноломкость», т.е. большая склонность к растрескиванию при холодной пластической деформации в связи с возможностью наличия в составе смеси хрупкой фазы.
Обрабатываемость резанием смесей в основном выше, чем однородных твердых растворов. Однако если в состав смеси входит твердая составляющая, изнашивающая резец, то обрабатываемость резанием может сильно понизиться.
Материаловедение. Учеб. пособие |
-149- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Жидкотекучесть эвтектических смесей, кристаллизующихся при постоянной температуре, очень велика. Практически она равна жидкотекучести жидких металлов. Чем ближе состав сплава к эвтектическому, тем выше жидкотекучесть.
На кривых физических свойств химических соединений в точках, соот-
ветствующих составу химического соединения, получаются резкие переломы. Обычно химические соединения обладают, по сравнению с компонентами, повышенной твердостью и пониженной пластичностью (рис. 3.54).
а |
б |
Рис. 3.54. Изменение физических и механических свойств сплавов в системах с химическими соединениями переменного состава: а – дальтонидами; б – бертоллидами
Исследование кривых состав–свойство в системах, содержащих химическое соединение, показывает, что эти кривые оказываются составленными из двух отдельных ветвей, соответствующих двум относительно самостоятельным диаграммам, разделенным линиями химического соединения.
По сравнению с чистыми металлами, твердость и электрическое сопротивление химических соединений в десять и более раз выше. Пластичность химических соединений, наоборот, минимальная.
Если химические соединения могут образовывать твердые растворы, то свойства этих химических соединений (промежуточных фаз) будут изменяться в зависимости от количества растворенного компонента. При этом существуют два типа кривых. В первом случае (аналогично рассмотренному) фазы постоянного или переменного состава характеризуются наличием на кривых состав–свойство особых или «сингулярных» точек, в другом случае изменение свойств фаз переменного состава происходит по плавным кривым.
В первом случае такие фазы называются дальтонидами. Для дальтонидов характерно, что ветви кривых, образующих максимум на диаграммах состояния (ликвидус или солидус, или и те и другие) пересекаются в сингулярной точке С. Сингулярной точке на диаграмме состояния соответствует сингулярная точка на кривых состав–свойства.
Материаловедение. Учеб. пособие |
-150- |
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Если ветви кривых ликвидуса и солидуса, ограничивающие область промежуточной фазы переменного состава, не пересекаются и не образуют сингулярные точки, то на кривых состав–свойство сингулярные точки также отсутствуют. Такие фазы называются бертоллидами. В отличие от дальтонидов, бертоллиды имеют кристаллическую решетку с частично упорядоченным расположением растворенных атомов.
3.12.Неравновеснаякристаллизациясплавов
Вусловиях реальных скоростей охлаждения кристаллизующегося
сплава (в земляной либо металлической форме или в кристаллизаторе – при получении слитков) от 10-2 до 102 К/с всегда будут развиваться диффузионные процессы обмена на межфазной поверхности в течение всего периода кристаллизации (разделительная диффузия). При этом выравнивающая диффузия в жидкой фазе в основном проходит полностью, и практически, полностью подавляется гомогенизирующая диффузия внутри растущего твердого кристалла. В результате нарушаются равновесные условия кристаллизации, и формируется химическая неоднородность по сечению кристаллов в конечной структуре литого сплава, т.е. наблюдается явление дендритной ликвации.
Развитие кристаллизации в неравновесных условиях можно проследить по равновесной фазовой диаграмме состояния, учитывая указанные ограничения (рис. 3.55). Начальные этапы кристаллизации в неравновесных условиях после переохлаждения ниже температуры ликвидуса практически не отличаются от таких же этапов кристаллизации в равновесных условиях за исключением того, что для образования первого зародыша твердой фазы требуется несколько более высокая степень переохлаждения.
|
|
|
а |
б |
|
Рис. 3.55. Схема процессов неравновесной кристаллизации сплавов в системе с неограниченной растворимостью в твердом и жидком состоянии: а – диаграмма фазовогоравновесиясизменениемсоставафазпринеравновеснойкристаллизации;б – схема кристалла с дендритной ликвацией
Неравновесная кристаллизация будет проходить с образованием большего количества одновременно зарождающихся кристаллов, при более высо-
Материаловедение. Учеб. пособие |
-151- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
ких скоростях их роста в кинетическом режиме, но в условиях меньшей диффузионной подвижности атомов (вследствие более низких температур превращения).
Рассматривая кристаллизацию единичного кристалла твердого раствора в этих условиях (рис. 3.55, а), можно видеть, что при переохлаждении жидкого раствора ниже температуры 1 в расплаве появляется тонкий разветвленный зародыш твердого раствора. Состав кристалла определяется равновесной концентрацией твердой фазы при температуре превращения по коноде, в соответствии с линией солидус равновесной фазовой диаграммы. Для температуры точки 1 состав зародыша соответствует точке а на линии солидус (концентрация Са на рис. 3.55, б).
Понижение температуры до точки 2, как и в случае равновесной кристаллизации, вызовет осаждение на ранее образовавшемся дендритном зародыше нового слоя твердого раствора. Концентрация слоя твердой фазы будет соответствовать равновесной концентрации Сb (точка b на линии равновесного солидуса). Возникнув при переохлаждении, такой слой далее не растет в диффузионном режиме, поскольку диффузионные процессы в твердой фазе при неравновесной кристаллизации подавлены. В условиях непрерывного охлаждения по достижении температуры точки 2 можно определить мгновенное значение средней концентрации твердого раствора Се как
Ce = Ma Ca +Mb Cb , Ma + Mb
где Ма и Мb – масса закристаллизовавшихся первого зародыша с составом Са и второго слоя с концентрацией Сb.
Точка е, соответствующая такой средней концентрации твердого раствора, оказывается левее линии равновесного солидуса. Это означает, что закристаллизовавшийся твердый раствор оказывается не насыщенным по компоненту В.
Дальнейшее понижение температуры при кристаллизации до точки 3 приводит к появлению нового слоя твердого раствора, кристаллизующегося в кинетическом режиме. Состав такого слоя в связи с высокой скоростью обменных диффузионных процессов на границе раздела фаз соответствует точке равновесного солидуса с – (слой Сс на схеме кристалла – рис. 3.55, б). Роста слоя в диффузионном режиме, как и предыдущего, не наблюдается в связи с подавлением гомогенизации твердого раствора. Поэтому к температуре точки 3 растущий кристалл оказывается вновь неоднородным, а средний состав твердой фазы в первом приближении можно определить по выражению, аналогичному вышеприведенному:
Cf = Ma Ca + Mb Cb +Mc Cc , Ma +Mb +Mc
где М и С с соответствующими индексами a, b, c – масса и концентрация первого зародыша и двух последовательно нараставших на его поверхность слоев при кристаллизации.
Материаловедение. Учеб. пособие |
-152- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Точка f, соответствующая средней мгновенной концентрации твердой фазы при температуре точки 3 в условиях непрерывного охлаждения Сf, лежит также левее равновесного солидуса фазовой диаграммы, как и точка е, образуя с ней линию изменения среднего состава твердой фазы при неравновесной кристаллизации.
Продолжив рассмотрение кристаллизации при охлаждении до температуры точки 4, можно показать, что только концентрация следующего тонкого слоя кристалла будет иметь концентрацию Сd, численно равную составу сплава. Средний состав твердой фазы по достижении этой температуры вновь не будет соответствовать солидусу равновесной диаграммы. Точка g, определяющая средний состав твердой фазы, при температуре 4 оказывается левее точки d.
Это означает, что при температуре равновесного солидуса сплава (точка 4) в условиях неравновесного ускоренного охлаждения кристаллизация сплава не заканчивается. В сплаве содержится кроме закристаллизовавшегося неоднородного по химическому составу кристалла твердой фазы некоторое количество жидкости, которая является неравновесной, поскольку содержит повышенное количество легкоплавкого компонента В, не перераспределившегося в центральные слои кристалла в связи с рассмотренными выше неравновесными условиями кристаллизации. Кристаллизация неравновесной жидкости должна завершиться в тот момент, когда средняя концентрация твердой фазы при неравновесной кристаллизации станет равной составу сплава, т.е. когда линия изменения среднего состава твердой фазы aefg пересечется с фигуративной линией сплава. Это соответствует точке h на линии среднего состава твердой фазы и температуре точки 5. Эта точка является температурой неравновесного солидуса сплава для рассмотренных условий неравновесной кристаллизации. В этот момент образуется последний внешний слой кристалла, состав которого также определяется точкой на равновесном солидусе, соответствующем температуре окончания кристаллизации. Это концентрация Сm (рис. 3.55, а, б).
Таким образом, по сечению кристалла твердого раствора, формирующегося в условиях неравновесной кристаллизации, возникает химическая неоднородность, которая носит название: внутрикристаллитной, или дендрит-
ной, ликвации (рис. 3.56).
В реальных условиях неравновесной кристаллизации происходит существенное изменение равновесного состояния сплавов. Перераспределение компонентов А и B между твердыми растворами α и β и соответственное изменение количества этих фаз происходит в твердом состоянии диффузионным путем. Следовательно, для протекания этого процесса необходимы значительные затраты времени.
Для практики важным является особенность дендритной ликвации при неравновесной кристаллизации сплавов в системах эвтектического типа, образующих твердые растворы с ограниченной растворимостью. Дендритная ликвация доэвтектического сплава проявляется не только образованием химической неоднородности по сечению дендритов твердого раствора, но и
Материаловедение. Учеб. пособие |
-153- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
присутствием в структуре литого сплава неравновесной эвтектики. Причина появления неравновесной эвтектики в сплавах типа твердых растворов связана с изменением положения линий равновесной диаграммы состояния.
Подавление диффузии в твердой фазе в условиях ускоренного охлаждения при кристаллизации сдвигает влево концентрационную границу появления второй фазы при эвтектическом превращении, понижает температуру окончания кристаллизации и приводит к образованию неравновесного соли-
дуса (рис. 3.57).
В сплаве 4 при охлаждении до температуры точки 3 сохраняется некоторое количество MEM3 100% жидкой фазы, которая претерпевает эвтектиче-
скую реакцию.
Вследствие малого количества эвтектической жидкости эвтектика может структурно вырождаться в одну фазу. Такую структурную составляю-
щую называют вырожденной эвтектикой (рис. 3.58, б).
Рис. 3.56. Сплав Cu–30 % Zn, α-латунь в литом состоянии. Структурная составляющая: кристаллы неоднородного α- твердого
раствора Zn в Cu. ×100
Рис. 3.57. Неравновесный солидус ТАМa в эвтектической системе
Материаловедение. Учеб. пособие |
-154- |
РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Т С |
|
|
|
|
|
|
1200 |
|
ж1+ж2 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
ж2+ |
β |
1131 |
|
|
|
|
|
||
1100 |
1,55 |
1105 |
|
17,9 |
|
|
1,45 |
|
|
|
|
|
|
|
+ β |
|
1067 |
|
|
|
|
ж1 |
|
|
|
||
1000 |
|
Cu(α) +Cu2 S(β) |
|
|
|
|
|
|
|
|
|
||
900 |
2 |
4 |
16 |
18 |
|
20 |
Cu |
|
|||||
|
|
|
|
|
S |
|
|
|
|
%,вес |
|
|
|
|
|
|
а |
|
|
б |
Рис. 3.58. Диаграмма состояния системы Cu–S (а), структура меди с примесью серы в литом состоянии (б), структурные составляющие: кристаллы Сu(α) и включения Cu2S (вырожденная эвтектика). ×250
При этом одна из фаз эвтектики, например, частицы Cu2S, откладывается на поверхности первичных кристаллов α-твердого раствора. В результате структура сплава в литом состоянии представлена кристаллами α-твердого раствора и кристаллами второй фазы эвтектического происхождения (вырожденная эвтектика). Образующаяся неравновесная эвтектика, в том числе, вырожденная, усиливает влияние дендритной ликвации на свойства сплава, резко ухудшая пластичность.
Сплавы системы эвтектического типа имеют свои особенности превращений при охлаждении. Практически применяемые скорости охлаждения в интервале кристаллизации и развития иных фазовых превращений приводят к некоторым отступлениям от правил строения сплавов, предусмотренных фазовой диаграммой, с учетом того, что кристаллизация почти всегда происходит в условиях некоторого переохлаждения. Известно, что чем выше степень переохлаждения, тем меньше размер выделяющихся фаз и мельче эвтектика.
Отклонения от равновесных условий кристаллизации сплавов часто приводят к образованию эвтектической структуры без образования первичных составляющих для сплавов неэвтектического состава. Такая структура сплава называется «квазиэвтектической» (рис. 3.59). Это объясняется тем, что с увеличением степени переохлаждения изменение линейной скорости роста первичных кристаллов фаз и эвтектических колоний происходит не одинаково. При некоторых условиях переохлаждения линейная скорость роста колоний эвтектики может оказаться больше линейной скорости роста первичных кристаллов избыточных фаз. В этих условиях образование эвтектики во всем объеме металла завершается еще до того, как образуются первичные кристаллы избыточных фаз.
Материаловедение. Учеб. пособие |
-155- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
Рис. 3.59. Схема определения области образования квазиэвтектических структур в сплавах
Область образования квазиэвтектики ограничивается зоной, составленной продолжением линий ликвидуса системы, причем чем больше степень переохлаждения, тем в более широком интервале концентраций сплавов возможно образование квазиэвтектики.
Применение ускоренного охлаждения при затвердевании может привести, кроме того, к подавлению перераспределения компонентов и получению метастабильного состояния сплавов в виде пересыщенных твердых рас-
творов.
Поскольку такое состояние оказывается нестабильным, то при дальнейшей выдержке при комнатной или несколько повышенной температуре будет происходить выделение из пересыщенного твердого раствора избыточной фазы, что может привести к нежелательному изменению свойств сплавов (механических, коррозионных и др.).
Контрольныевопросыизадания
1.Чем отличается определение фазы от определения структурной составляющей?
2.Какопределяетсявариантностьодноидвухкомпонентнойсистемы?
3.Как образуются твердые растворы замещения и внедрения и вычи-
тания?
4.Какие условия должны выполняться при образовании неограниченных твердых растворов замещения?
5.Как располагаются атомы в неупорядочных и упорядоченных твердых растворах?
6.В чем отличие промежуточных фаз от образующих их компонентов
иот твердых растворов?
7.Опишите типы промежуточных фаз.
8.Рассмотрите фазовые и структурные превращения при кристаллизации сплавов диаграммы с неограниченным рядом твердых растворов замещения.
Материаловедение. Учеб. пособие |
-156- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
9.Какие диффузионные процессы должны реализовываться при равновесной кристаллизации твердых растворов?
10.Как изменяется солидус диаграммы состояния с непрерывным рядом твердых растворов в условиях быстрого охлаждения?
11.Поясните явление дендритной ликвации при кристаллизации твердых растворов?
12.Как изменяются диффузионные процессы в условиях реальных скоростей охлаждения, т.е. при неравновесной кристаллизации твердых растворов?
13.Охарактеризуйте фазовые и структурные превращения в сплавах диаграммы состояния с эвтектическим равновесием и граничными твердыми растворами при кристаллизации и последующем охлаждении.
14.Какие отличия имеются в структуре доэвтектического, эвтектического, заэвтектического сплава системы Pb–Sb?
15.Какую структурную составляющую называют эвтектикой? Приведите примеры регулярной и нерегулярной эвтектики на примере реальных сплавов.
16.Опишите образование и рост зародыша эвтектической колонии, а
также последующий совместный рост двух фаз.
17.Объясните на примере эвтектического ледебурита, как влияет на структуру эвтектики увеличение степени переохлаждения при кристаллизации.
18.Почему в системах эвтектического типа в условиях ускоренного охлаждения при кристаллизации точка максимальной растворимости компонента в твердом растворе сдвигается влево?
19.Что такое квазиэвтектика? В каких сплавах образуется такая
структура?
20.Какую эвтектику называют вырожденной эвтектикой и какие условия способствуют ее образованию?
21.Какие особенности кристаллизации сплавов наблюдаются в системах с ретроградным солидусом?
22.Охарактеризуйте фазовые и структурные превращения при кристаллизации и последующем охлаждении в сплавах диаграммы состояния с перитектическим равновесием и граничными твердыми растворами.
23.По каким вариантам может идти перитектическая кристаллизация? Изобразите два варианта структур на примере сплавов системы Sn–Sb и Cu–Zn.
24.Охарактеризуйте конгруэнтно и инконгруэнтно плавящиеся промежуточные фазы. В каких типах диаграмм они образуются?
25.По какой формуле можно пересчитать массовые весовые проценты
ватомные для определения химической формулы фазы постоянного состава?
26.Опишите фазовые и структурные превращения при кристаллизации и последующем охлаждении в сплавах диаграмм состояния с эвтектическим и перитектическим равновесиями, в которых образуются конгруэнтно
Материаловедение. Учеб. пособие |
-157- |

РАЗДЕЛ I. ОСНОВЫ ФИЗИЧЕСКОГО МЕТАЛЛОВЕДЕНИЯ
Глава 3. Фазовые равновесия в двойных и тройных системах
или инконгруэнтно плавящиеся промежуточные фазы постоянного или переменного состава.
27.Изобразите диаграмму состояния с двумя перитектическими равновесиями и инконгруэнтно плавящимися промежуточными фазами постоянного состава. Выберите сплав, в котором реализуется перитектическое превращение с избытком жидкости. Укажите фазовые области. Зарисуйте кривую охлаждения и структуру сплава при кристаллизации и последующем охлаждении.
28.Изобразите диаграмму состояния с полиморфным превращением компонента А, эвтектическим и эвтектоидным равновесиями. Укажите фазовые области. Охарактеризуйте фазовые и структурные превращения при кристаллизации и последующем охлаждении в сплавах разного состава.
29.Определите по концентрационному треугольнику количество компонентов, входящих в сплав.
30.Что определяет политермический и изотермический разрезы в трехкомпонентных системах?
Материаловедение. Учеб. пособие |
-158- |
