
- •2. Основные понятия химической термодинамики
- •2.1. Термодинамические системы .
- •2.2. Состояние тдс
- •2.2.1.Определение.
- •Лекция №2
- •Первый закон термодинамики
- •3.1.Содержание первого закона термодинамики
- •3.2. Применение 1-го закона к простейшим системам
- •4. Термохимия
- •4.1.Предмет термохимии
- •4.2. Понятие теплоты химической реакции
- •4.3.Закон Гесса (1836)
- •Лекция № 3
- •4.5.Приближенный расчет теплот химических реакций по знергиям связи
- •Лекция № 4
- •Лекция № 5
- •5. Второй закон термодинамики
- •5.1. Классификация процессов с точки зрения 2 закона термодинамики.
- •Лекция № 6
- •5.5. Статистический смысл энтропии
- •5.5.3. Термодинамическая вероятность.
- •N s Wmax
- •6. Третий закон термодинамики
- •6.1. Формулировки
- •Лекция № 7
- •7. Применение 2-го закона термодинамики к изотермическим процессам
- •7.1. Фундаментальное уравнение Гиббса
- •7.2. Критерии направления самопроизвольных процессах в изотермических условиях. Термодинамические потенциалы.
- •7.2.1. Энергия Гельмгольца.
- •7.3. Характеристические функции
- •Лекция № 8
- •8. Фундаментальное уравнение Гиббса для открытых систем
- •8.2. Понятие химического потенциала.
- •8.4.Уравнение Гиббса-Дюгема
- •8.5. Выражение химического потенциала компонента идеального газа
- •8.5.2.Смесь газов
- •8.6.4.2. Метод соответственных состояний
- •Лекция № 9
- •Химические реакции и химическое равновесие
- •9.1. Общее условие химического равновесия в закрытой системе
- •9.3. Закон действующих масс
- •9.3.1. Константа равновесия
- •9.3.2. Способы выражения константы равновесия и взаимосвязь между ними
- •Лекция № 10
- •9.5. Расчетные и экспериментальные методы определения rG0 и констант равновесия
- •9.5.3. По измерению полезной работы
- •9.5.4. Экспериментальное определение констант равновесия.
- •9.5.7. Статистические расчеты констант равновесия
Лекция № 3
4.3.5. Применение закона Гесса.Закон Гесса позволяет комбинировать стехиометрические уравнения, вкладывая в них термохимический смысл. Любые линейные комбинации с одинаковыми общими уравнениями имеют один и тот же тепловой эффект. Это позволяет легко определять теплоты реакций, которые трудно экспериментально провести до конца в соответствие с требованиями
H2 + O2 = H2O2 rH-?
+1H2 + 1/2 O2 = H2O rH1 = -285.8 кДж/моль
–1 H2O2 = H2O + 1/2O2 rH2 = -98,7 кДж/моль
H2 + O2 = H2O2
Подбираем коэффициенты линейной комбинации уравнений реакций, теп-лоты которых известны, чтобы в сумме получалось заданное уравнение. С такими же коэффициенты данные теплоты войдут в искомую теплоту.
rH = rH1 - rH2 = -285,8 – (-98,7) = -187,1Кж/моль
Энергетическая диаграмма – графическое изображение уровней реаги-рующих веществ–позволяет наглядно представить эти процессы и нахо-
________________ H2 + O2 дить любые неизвестные теплоты по
имеющимся данным путем составле-
-187.1 ния циклов, суммарная теплота кото-
рых равна 0.
-285.8 H2 O2
-98.7
H2O
+ 1/2 O2
Следствия из закона Гесса
Первое следствие.
4.4.1.1. Понятие стандартной теплоты образования вещества
Согласно 1-ому закону термодинамики невозможно измерить абсолютное значение энергии, а только ее изменение. Поэтому нужно выбрать для различных веществ условный нуль, относительно которого определяются изменения внутренней энергии. За такой уровень отсчета приняты состояния простых веществ при стандартных условиях. Простые вещества образованы из атомов одного элемента. Если элемент существует в нескольких простых формах, то выбирается наиболее устойчивая модификация H2(газ), O2 (газ), N2(газ), Ar(газ) , Cграфит,S(ромб), Br2(ж)
Стандартная теплота образования– это тепловой эффект реакции образования вещества из простых веществ в стандартных состояниях. ОбозначаетсяfH˚илиfU˚, для простых веществfH˚=fU˚= 0.
Пример,
Cграф. + 1/2 O2 + 3 H2 = C2 H5 OH(жидк.) ; rH˚= fH˚
4.4.1.2. Стандартное состояние– наиболее устойчивая форма чистого вещества, для газов – давление 1 атмосфера и газ должен обладать свойствами идеального газа, т.е. для него справедливо уравнение Менделеева-Клапейрона, конденсированные фазы находятся в равновесии со своим паром. Температура не входит в понятие стандартного состояния. Оно возможно при любой температуре. В справочниках теплоты образования приводятся при температуре 298,15 К, но это специально оговариваетсяfH˚298.
4.4.1.3. 1-ое следствие из закона Гесса используется для определения теплот химических реакций по справочным данным, т.е. по теплотам образования веществ
0 =
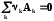 ;
;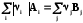 rH˚-?
rH˚-?
rH˚
Реагенты
Продукты



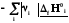 Простые вещества
Простые вещества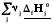
Простые вещества одинаковы для реагентов и продуктов, поэтому
 rH˚
=
rH˚
=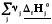
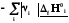 =
=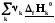 (3.1)
(3.1)
Теплота реакции равна сумме теплот образования конечных веществ минус сумма теплот образования исходных веществ с учетом модуля стехиометрических коэффициентов.
4.4.2. Экспериментальное определение теплот реакций.
4.4.2.1. Калориметрия– метод непосредственного экспериментального измерения теплот химических реакций в приборе, называемом калори-метром. Различают калориметрыизотермические, работающие при постоянной температуре, и с переменной температурой, которая и служит измеряемой величиной в этом случае. В последнем случае реакцию проводят вадиабатических (по возможности) условиях. В этом случае изменениеUилиHпроисходят за счет химической реакции и за счет изменения температуры
0 = rH + tH = rH + CpT
rH = - CpT/ = - CpTνk/ nk (3.2)
4.4.2.2 .Теплота сгорания.
Для экспериментального определения теплоты реакции необходимо, чтобы реакция протекала однозначно, т.е. не сопровождалась побочными процессами и степень превращения приближалась к единице. Далеко не все реакции отвечают таким критериям. Наиболее доступны для экспериментального исследования теплоты сгорания, которые проводят в калориметрической бомбе в атмосфере кислорода без катализатора. При этом получаются устойчивые оксленные состояния элементов СО2, Н2О, SO2, N2 или NО2, обязательно требуется анализ продуктов.
С2Н5ОН +7/2 О2 = 2 СО2 + 3 Н2О; rН=сН
2-ое следствие из закона Гесса – определение теплоты реакции по теплотам сгорания
С6Н6
+ 3Н2 = С6Н12
сН1= -3267,58 кДж/моль

сН1
сН
2 сН3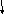
6 СО2 + 6 Н2О
сН3= -3919,91 кДж/моль
rН˚=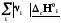 –
–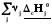 =
–
=
–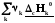
(3.3)
Теплота реакция равна сумме теплот сгорания реагентов минус сумма теплот сгорания продуктов с учетом модулей стехио-метрических коэффициентов.
3-ье следствие из закона Гесса – пересчет экспериментальных теплот сгорания на теплоты образования
3 Сграф. + 3 Н2 + 1/2О2 = Н3С-СО-СН3 fH˚ -?
-1 C3H6O
+ 4 O2
= 3 CO2
+ 3 H2O
сН˚
= -1785.3 кДж/моль
3 Н2 + 1/2О 2 = Н2 О сН˚= -285,8 кДж/моль
3 С + О2 = СО2 сН˚ = -393,51 кДж/моль
fH˚=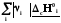 -сН˚
(3.4)
-сН˚
(3.4)
Теплота образования вешества равна сумме теплот сгорания простых веществ, образующих его, минус теплота сгорания самого вещества
