1. Тд аспекты поверхности
В основе опр-я движ. силы хим. р-ции лежит понятие хим. пот-ла – величина тд, введенной Гиббсом.

1
закон ТД:
 ,
изменение внутренней энергии равен
разности сообщенной теплоты и совершенной
работы.
,
изменение внутренней энергии равен
разности сообщенной теплоты и совершенной
работы.
В
сл-е хим. р-ии:
 ,
,
2
з-н ТД для
обр. пр-сов:
 характеризует
часть внутренней энергии, которая может
превратиться в работу при постоянном
давлении и температуре, она называется
свободная энергия Гиббса (G)-
характеризует
часть внутренней энергии, которая может
превратиться в работу при постоянном
давлении и температуре, она называется
свободная энергия Гиббса (G)-
 -энтальпия
системы, которая при постоянном объеме
совпадает с ее внутренней энергией.
-энтальпия
системы, которая при постоянном объеме
совпадает с ее внутренней энергией.
При
T=const
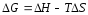 .
Критерием для самопроизвольного
протекания процесса является
.
Критерием для самопроизвольного
протекания процесса является <
0.
<
0.
При p=const используется энергия Гельмгольца F=U-TS
Если процессы идут в конденсированной фазе (т.е. при постоянном объеме системы), то энергия Гиббса и энергия Гельмгольца будут совпадать.
 Термодинамика
поверхности и поверхности раздела.
Термодинамика
поверхности и поверхности раздела.
Для
увеличения поверхности вдоль Х на
величину dx
необходимо
приложить силу F.
Совершенная работа будет равна: ,
гдеl-размер
поверхности раздела.
,
гдеl-размер
поверхности раздела.
 -
поверхностное натяжение
-
поверхностное натяжение
Для твердых тел работа по созданию новой поверхности путем добавления новых атомов. Эта работа необходима, чтобы деформировать поверхность твердого тела и представлять собой меру искажения поверхностей, которая может быть как за счет сжатия, так и растяжения твердого теля. Для жидкости поверхностное натяжение при сжатии и растяжении равны, а в твердом теле - отличны.
Комп-ты
с низ. поверх. натяжением стремятся в
поверх. слой, уменьшая общее поверх.
натяж. на межфаз. гр. А комп-ты с высоким
поверх. натяжением остаются в объеме и
слабо влияют на ГР.
 Смачиваемость
поверхности.
Если энергия поверхности раздела
твердого тела-жидкости
Смачиваемость
поверхности.
Если энергия поверхности раздела
твердого тела-жидкости
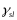 велика (а).Если энергия межфазной границы
твердое тело-пар
велика (а).Если энергия межфазной границы
твердое тело-пар велика (в).Промежуточный
случай на рис. б:
угол между твердой поверхностью и
касательной поверхностью в точке
пересечения называется контактный
угол. Условие минимума энергии:
велика (в).Промежуточный
случай на рис. б:
угол между твердой поверхностью и
касательной поверхностью в точке
пересечения называется контактный
угол. Условие минимума энергии:
 .
При
.
При - смачиваемость,
- смачиваемость, - несмачиваемость. Растекание соответствует
условию
- несмачиваемость. Растекание соответствует
условию .
.
 Коэффициент
растекания. Для растекаемой жидкости
на твердом поверхности величина S>0.
Коэффициент
растекания. Для растекаемой жидкости
на твердом поверхности величина S>0.
При равновесии


2. Структура поверхности и межфазных границ.
Поверхность фазы или межфазных границ имеет повышенную энергию по сравнению с внутренней частью твердого тела. Для образования системы с минимальной избыточной свободной энергией поверхность перестраивается. Растворенные вещества, которые понижают поверхностную энергию, имеют тенденцию концентрироваться на поверхности, точно так же ориентируются и диполи, чтобы соответствовать минимальной энергии.
Структура поверхности зависит от условий формирования и последующей обработки. Поверхность перестраивает свою структуру, чтобы понизить энергию либо за счет миграции атомов, либо за счет адсорбции добавочных компонентов.
Адсорбция
– это процесс концентрирования вещества
из объема фаз на границе их раздела. Под
адсорбцией понимают поглощение примеси
из газа или жидкости твердым веществом
(адсорбентом). Поглощенное вещество –
это адсорбат.
Вещество, находящееся в объеме фазы-
адсорбтив.
Подобно свободным поверхностям и границам между двумя зернами одного и того же материала, межфазные границы твердое тело-твердое тело, жидкость-жидкость, твердое тело-жидкость и жидкость-пар характеризуются энергией межфазных границ, необходимой для формирования новой единицы поверхности в интерфейсной системе. Энергия межфаз. гр. всегда меньше, чем сумма отдельных энергий двух фаз за счет существования энергии притяжения между фазами. Адсорбция происходит на межфазных границах подобно адсорбции на поверхности.
Нуклеация – это первая по времени наступления стадия фазового перехода. На ней образуется основное число устойчиво растущих капель новой, стабильной фазы.
 Кластер
–
сложное объединение нескольких атомов
или молекул, которое может рассматриваться
как самостоятельная единица, обладающая
определенными свойствами.
Кластер
–
сложное объединение нескольких атомов
или молекул, которое может рассматриваться
как самостоятельная единица, обладающая
определенными свойствами.
Схема образования, роста и спекания кластеров: а) образование зародышей, б) максимальный размер устойчивого кластера при слабом межкластерном взаимодействии, в) начало спекания, г) образование наносистемы сильно взаимодействующих кластеров. Стрелками показано соответствие стадий а-г кривой изменения свободной энергии Гиббса.
Адсорбция атомов и молекул определяет основные свойства поверхности.
2 типа адсорбции:
В процессе физической адсорбции молекулы связываются с поверхностью силами Ван-дер-Ваальса. Обратима.
При химической (хемосорбции) – силами химического взаимодействия. Может быть необратимой. Значение теплот хемосорбции, характеризующие силу связи молекулы с поверхностью, значительно выше по сравнению с физической адсорбцией.
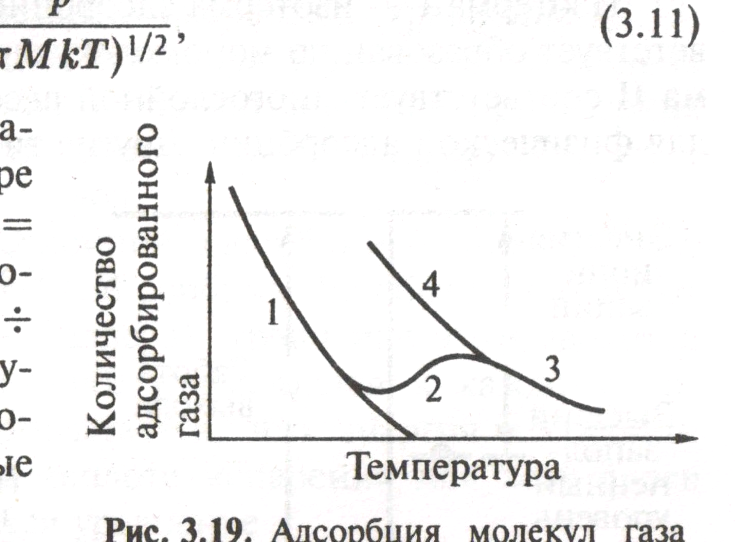
Адсорбция
молекул газа на поверхности твердого
тела. Переход от физической сорбции (1)
к хемосорбции (2) при повышении температуры;
(3,4) – новая изобара адсорбции.