
- •ЛЕКЦИЯ 8
- •O, S, Se, Te, Po – халькогены
- •Природные ресурсы
- •алюмосиликаты
- •Получение
- •Свойства
- •Оксиды делят на:
- •температуры плавления (0° С) и кипения (100° С). Толстый слой воды имеет голубой
- •Химические свойства
- •Н2О2 – пероксид
- •Н2О2 проявляет окислительные и восстановительные свойства.
- •Сера
- •Природные ресурсы:
- •мирабилит
- •пирит
- •галенит
- •сфалер
- •Получение
- •Свойства
- •Известны и другие формы серы (пурпурная),получается при быстрой конденсации паров серы на поверхности,
- •Химические свойства
- •H2S сероводород
- •Вода с запахом
- •а) на воздухе H2S горит:
- •Соли называются сульфидами. Многие сульфиды ярко окрашены. В воде растворимы только сульфиды щелочных
- •BaSO4 4C BaS 4CO
- •4) Соединения S с O(SO2 2 и SO3)
- •SO2 – бесцветный газ с удушливым запахом, легко превращаемый в жидкость, t пл
- •Тиосульфаты соли.
- •Известно несколько кристаллических форм SO3. При хранении образуется β-SO3 в виде длинных блестящих,
- •При t° выше 600°С SO3 разлагается
- •Получение H2SO4
- •Получение H2SO4 из SO3 является основным методом производства H2SO4 (контактный метод). В промышленности
- •Свойства H2SO4
- •на холоду пассивирует Fe, Al, Cr.
- •медицина

ЛЕКЦИЯ 8
VI A группа неметаллов
Кислород и его свойства. Сера. Оксиды серы.
Сероводород. Получение, свойства. Применение
O, S, Se, Te, Po – халькогены
(образующие руды)
Кислород
Характерные степени окисления и важнейшие соединения:
Рассматриваются О2, H2O и H2O2.
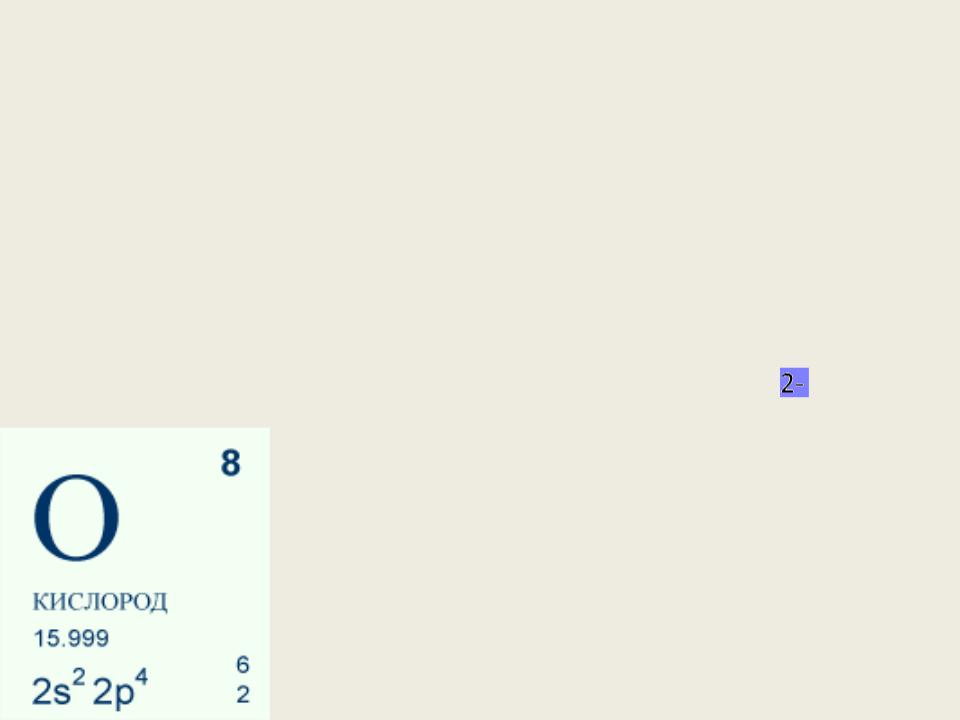
Н2О – степень окисления Н2О2 – степень окисления О‾ OF 2 – степень окисления О+2
Природные ресурсы
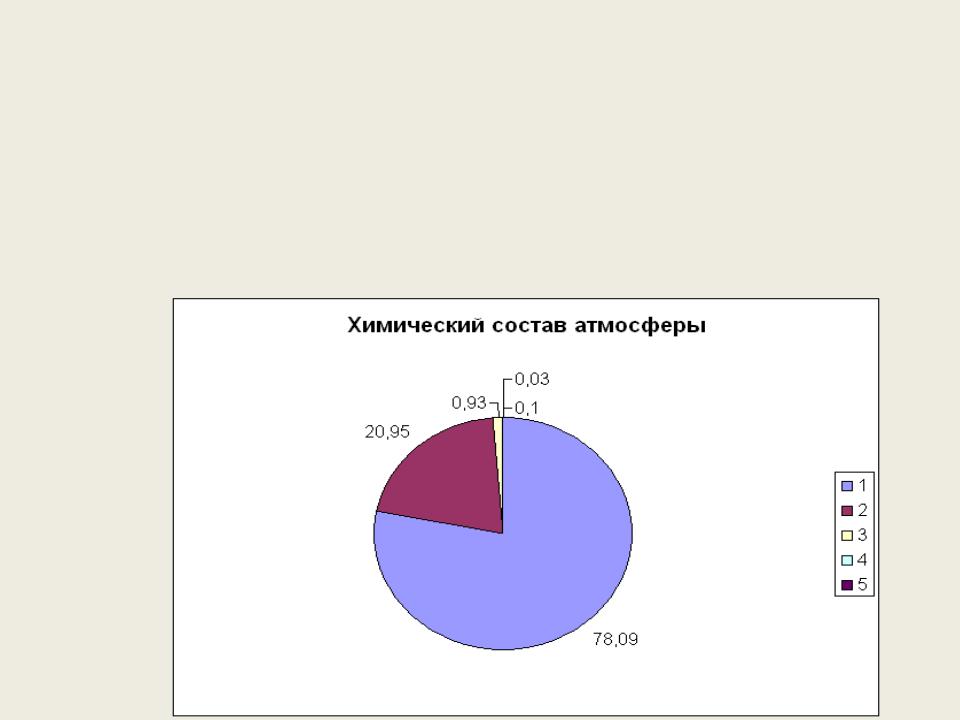
О2 – наиболее распространенный элемент, его соединения в земной коре составляет 47,0 % (масс). Находится в Н2О; SiO2; силикатах и алюмосиликатах. В свободном состоянии О2 находится в воздухе 20,95 % (об.) или 23 % (масс.). В верхних слоях О3 – озон ~ 25 км.


SiO2

алюмосиликаты
Алюмосиликат Ве


Получение
1) в промышленности О2 получают из жидкого воздуха. Иногда электролизом Н2О.
2H2O 2H2 O2
2)в лаборатории : разложением |
|
|
||||
а) KMnO4 2KMnO K |
MnO MnO O |
|||||
|
4 |
2 |
|
4 |
2 |
2 |
б) нитратов щелочных металлов |
|
|
||||
|
2KNO 2KNO O |
|
|
|||
в) бертолет. 3 |
|
2 |
2 |
|
|
|
соли: |
2KClO3 |
2KCl O2 |
(kat. MnO2 ) |
|||
|
||||||
г) 2HgO 2Hg O |
|
|
|
|
||
3) Стальные |
2 |
|
|
баллоны |
|

Свойства
О2 – бесцветный газ , без запаха и вкуса. Жидкий имеет голубую окраску.
t пл – 219˚С, t кип – 183˚С
О3 – озон – синий газ, твердый, черный, ядовит, получают в озонаторах или по реакциям:
3F2 3H2O 6HF O3
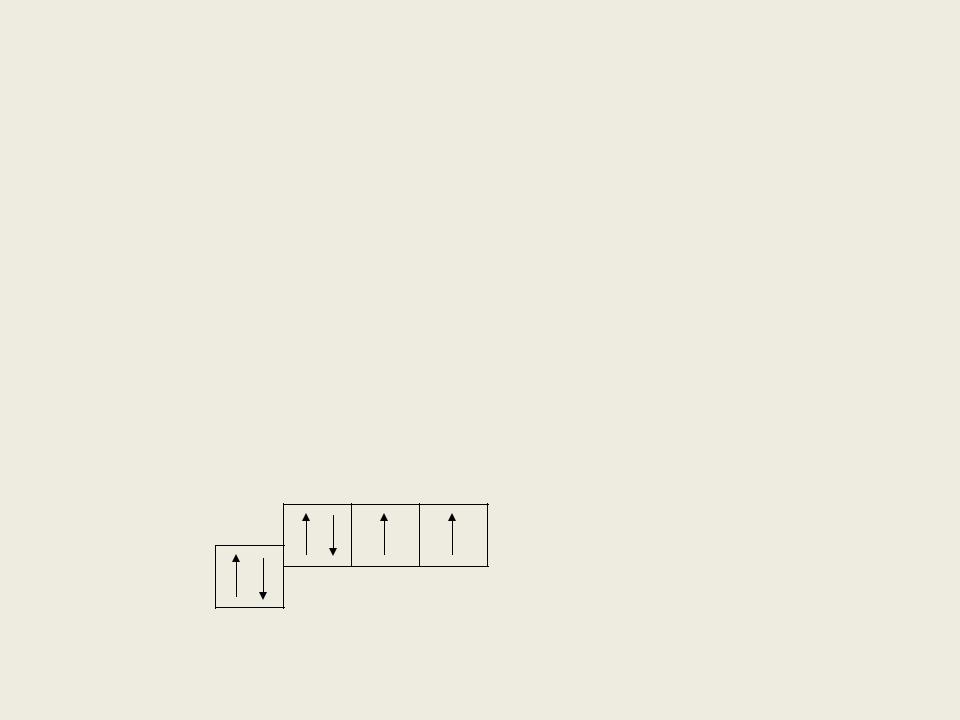
Электронное строение
2p4
2s2

|
О2 отличается от других элементов IVА |
||||||
группы, т.к. не имеет высшую степень |
|||||||
окисления. Это обусловлено тем, что в |
|||||||
валентном электронном слое атома кислорода |
|||||||
нет d-орбиталей. |
|
|
|
|
|||
|
2 – образует водородные связи в Н2О, |
||||||
спиртах и т.д. |
|
существует |
|||||
|
Н3О |
|
– ион гидроксония |
||||
благодаря донорно-акцепторному механизму. |
|||||||
|
О2 по реакционной способности уступает |
||||||
только |
галогенам. |
Образует |
химические |
||||
соединения |
со всеми элементами (кроме He, |
||||||
Ne |
и Ar). |
Кислород образует 4 типа |
|||||
соединений: оксиды, |
пероксиды – |
О – О |
– ; |
||||
надпероксиды, где О |
и озониды |
О |
. Ионы |
О |
|||
и |
О |
можно рассматривать как О2 и |
О3 |
||||
присоединившие электрон. |
|
|
|
||||
