
- •ЛЕКЦИЯ
- •К VII А группе неметаллов относятся
- •Природные ресурсы Соединения водорода в земной коре 1,0 % (масс.)
- •Получение
- •2) Водород высокой чистоты получают электролизом Н2О.
- •Свойства
- •VIIА группа
- •Химические свойства
- •Для водорода известны 3 изотопа:
- •Для водорода характерен особый вид
- •Соединения водорода делятся на 3 группы:
- •I – водородные соединения s и p элементов по их отношению к Н2О
- •д) Соединения подгруппы серы с водородом являются слабыми кислотами
- •6) тяжелая вода Д2О является замедлителем нейтронов в ядерных реакторах. Дейтериево-тритиевые смеси проводят
- •Генератор
- •Хлор. Бром. Йод.
- •Природные ресурсы:
- •Получение
- •Свойства
- •Строение внешнего электронного слоя
- •Химические свойства
- •но HBr и HI такие реакции не дают, т.к. доб-
- •Соляя́ная (хлороводороя́дна,
- •2) Галогены непосредственно с О2 не реагируют, т.к. связь Г – О обладает
- •ClO2 – бурый газ с резким запахом, ядовит, может взрываться. ClO2 – энер.
- •I2O5 – бесцветное кристаллическое соединение, при
- •HOCl – очень слабая кислота, разлагается на Cl2O4 H2O , на свету на
- •HClO3 HBrO3 HIO3
- •Соли этой кислоты наиболее сильные осушители, NaClO4, KClO4, RbClO4, CsClO4.
- •Применение
- •F – фтор
- •флуорит (плавиковый
- •Карбонат-фторапатит
- •Карбонат-
- •Свойства
- •В атмосфере фтора горят асбест и вода.
- •Плавиковая кислота
- •Существует в полимерах HF в газовой фазе. Жидкий HF – сильно ионизирующий растворитель.
- •Применение
- •травления

но HBr и HI такие реакции не дают, т.к. доб-
ся ОВР:
2KBr 3H2SO4 (к) 2KHSO4 Br2 SO2 2H2O 8KI 5H2SO4 (к) 4K2SO4 4I2 H2S 4H2O
Галогениды Cl, Br, I при обычных условиях газообразны , хорошо растворимы в воде (растворение сильно экзотермично). В водном растворе – это кислоты. Их соли хлориды, бромиды, иодиды. Все НГ – восстановители.
HCl HBr HI (сильный восстановитель)
Восстановительная способность увеличивается
4HI O2 2H2O 2I2 (раствор буреет)

Соляя́ная (хлороводороя́дна,
хлористоводороя́дная кислотая́)— HCl, раствор хлороводорода в воде; сильная одноосновная кислота. Бесцветная (техническая соляная кислота желтоватая из-за примесей Fe, Cl2 и др.), «дымящая» на
воздухе, едкая жидкость. Максимальная концентрация при 20 °C равна 38 % по массе, плотность такого раствора 1,19 г/см³.
йкислоты

2) Галогены непосредственно с О2 не реагируют, т.к. связь Г – О обладает небольшой энергией.
Известны: Cl2O; ClO2; Cl2O6; Cl2O7; I2O5. Cl2O – темно желтый газ с резким запахом, ядовит, при комн. t° разлагается на ClO2 и Cl2.
В воде растворяется и образует HClO.
Cl2O H2O 2HClO

ClO2 – бурый газ с резким запахом, ядовит, может взрываться. ClO2 – энер. окислитель реагирует с Н2О (на свету медленно) и со щелочью (быстро).
6ClO2 3H2O 5HClO3 HCl
2ClO2 2KOH KClO2 KClO3 H2O
Cl2O3 – вязкая жидкость темно-красного цвета.
Cl O |
|
2ClO |
(в газовой фазе распадается). |
|
реагирует с Н2О и |
3 |
|
||
2 3 |
|
|
|
|
щелочами: |
|
|
|
|
2KOH Cl2O6 |
KClO3 KClO4 H2O |
|||
|
|
|
|
хлорная |
|
|
|
|
кислота |

I2O5 – бесцветное кристаллическое соединение, при
растворении в воде образует HIO3, при t° > 300°C разлагается на I2 и O2.
Известны следующие кислородсодержащие кислоты галогенов:
Cl2O7 – маслянистая жидкость, более стабилен, чем другие оксиды.
Cl2O7 H2O 2HClO4

|
HClO |
хлорноватистая кислота, соли гипохлориты |
1 |
|
бромноватистая кислота, соли гипобромиды |
HBrO |
HIO иодноватистая кислота, соли гипоиодиды
3 HClO2 хлористая кислота, соли хлориты
5
7
HClO3
HBrO3
HIO3
HClO4
H5 IO6
хлорная кислота, соли хлораты
бромноватая кислота, соли броматы иодноватая кислота, соли иодаты
хлорная кислота, соли перхлораты
йодная кислота, соли периодаты
H |
Cl |
H |
|
Cl |
|
O |
|
O |
O |
|
|
|
||
|
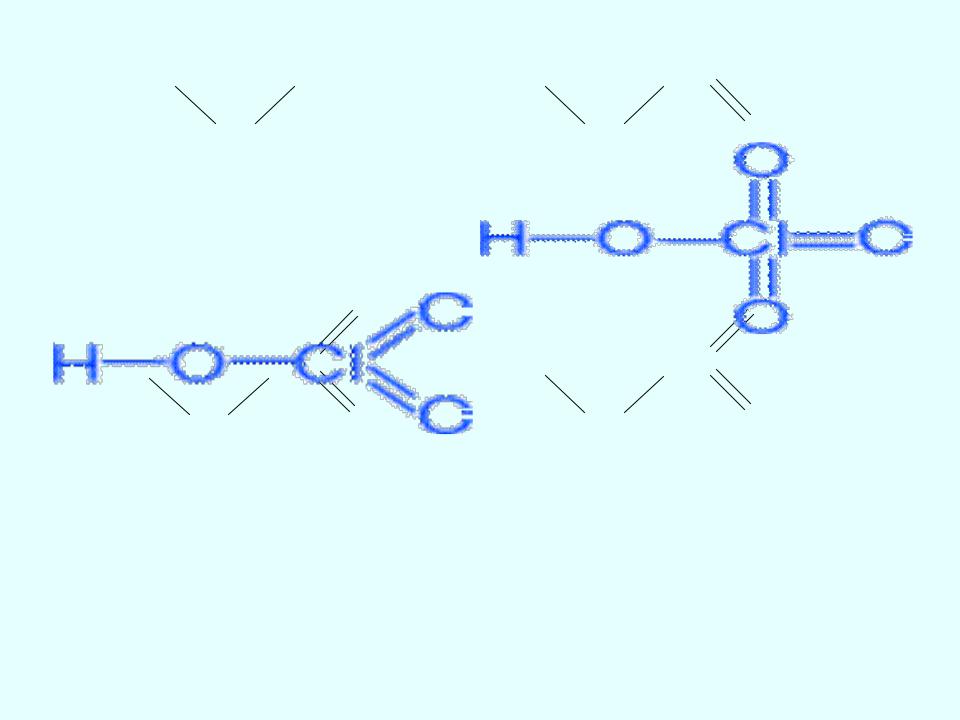
HClO |
|
HClO2 |
|
|
|
O |
|
|
O |
|
H |
|
Cl |
H |
Cl |
|
O |
|
|
|||||
|
|
|
|
|||
|
O |
O |
|
O |
O |
|
|
|
|
|
|
||
|
HClO |
|
|
HClO4 |
|
|
3
В промышленности проводят реакции хлора
с растворами KOH или NaOH для получения раствора «жавелевой воды», и с Ca(OH)2 для получения белильной извести – CaOCl2.

HOCl – очень слабая кислота, разлагается на Cl2O4 H2O , на свету на 2HCl и O2.
НОГ – сильные окислители:
5HOCl I H O 5HCl 2HIO
Соли2 2 гидролизуются2 3 HClO2 – хлористая кислота, кислота средней
силы.
4HClO2 HCl HClO3 2ClO2 H2O
HClO3, HBrO3 – хлорноватая, бромноватая кислоты нестабильны диспропорционируют:
2HClO3 ClO2 HClO4
2HBrO3 H2O Br2 O2
HIO3 – устойчивая кислота, кристаллизуется. Это сильные одноосновные кислоты, HClO3 диссоциирует нацело.

HClO3 HBrO3 HIO3
сила кислот снижается, окислительная активность снижается
НГО3 – сильные окислители
При t ° соли кислоты разлагаются на:
2KClO3 t 2KCl 3O2
MnOkat2.
HClO4 – хлорная кислота известна в
свободном виде – это подвижная, дымящая на |
|
воздухе жидкость. Одна из самых сильных |
|
|
кислот. |
Получение: KClO4 H2 SO4 HClO4 KHSO4 |
|
HClO4 |
– безводный очень сильный |
|
окислитель. |
4HClO4 = |
При t ° разлагается: |
4ClO2 3O2 2H2O |
|

Соли этой кислоты наиболее сильные осушители, NaClO4, KClO4, RbClO4, CsClO4.
Известен ряд соединений галогенов друг с другом BrCl, ICl, BrF5, IF7 и т.д. Получаются прямым синтезом, подвергаются гидролизу.
