
- •ЛЕКЦИЯ
- •К VII А группе неметаллов относятся
- •Природные ресурсы Соединения водорода в земной коре 1,0 % (масс.)
- •Получение
- •2) Водород высокой чистоты получают электролизом Н2О.
- •Свойства
- •VIIА группа
- •Химические свойства
- •Для водорода известны 3 изотопа:
- •Для водорода характерен особый вид
- •Соединения водорода делятся на 3 группы:
- •I – водородные соединения s и p элементов по их отношению к Н2О
- •д) Соединения подгруппы серы с водородом являются слабыми кислотами
- •6) тяжелая вода Д2О является замедлителем нейтронов в ядерных реакторах. Дейтериево-тритиевые смеси проводят
- •Генератор
- •Хлор. Бром. Йод.
- •Природные ресурсы:
- •Получение
- •Свойства
- •Строение внешнего электронного слоя
- •Химические свойства
- •но HBr и HI такие реакции не дают, т.к. доб-
- •Соляя́ная (хлороводороя́дна,
- •2) Галогены непосредственно с О2 не реагируют, т.к. связь Г – О обладает
- •ClO2 – бурый газ с резким запахом, ядовит, может взрываться. ClO2 – энер.
- •I2O5 – бесцветное кристаллическое соединение, при
- •HOCl – очень слабая кислота, разлагается на Cl2O4 H2O , на свету на
- •HClO3 HBrO3 HIO3
- •Соли этой кислоты наиболее сильные осушители, NaClO4, KClO4, RbClO4, CsClO4.
- •Применение
- •F – фтор
- •флуорит (плавиковый
- •Карбонат-фторапатит
- •Карбонат-
- •Свойства
- •В атмосфере фтора горят асбест и вода.
- •Плавиковая кислота
- •Существует в полимерах HF в газовой фазе. Жидкий HF – сильно ионизирующий растворитель.
- •Применение
- •травления

Хлор. Бром. Йод.
Характерные степени окисления:
Cl
– 1 (HCl, NaCl, KCl)
+1 (NaClO – гипохлорит Na)
+3 (КСIО2- хлорит К)
+5 (KClO3 – хлорат K)
+7 (KClO4, NaClO4, NH4ClO4 – перхлораты)
Br
– 1 (HBr и соли бромиды NaBr, KBr) + 5 (KBrO3 – бромат калия)

I
– 1 (HI и иодиды, KI, KI·I2)
+5 (KIO3 – иодат калия, I2O5 – иодноватый ангидрид)
+7 (H5IO6 – иодная кислота, Ba5(IO6)6 – ортопериодат Ba,
KIO4, NaIO4 – метапериодаты K и
Na)

Природные ресурсы:
Cl – 4,5·10–2 %, Br – 3·10–5 %, I – 1·10–4 % – в земной коре.
Основная масса сконцентрирована в воде морей и океанов. I2 в водорослях -ламинариях (морская капуста).
Ламинария
Галит

Получение
1) в промышленности – Cl получают электролизом водного раствора NaCl
2) в лаборатории – из баллонов или
MnO2 4HClк t Cl2 MnCl2 2H2O
2KMnO4 16HCl 5Cl2 2MnCl2 2KCl 8H2O
Особо чистый хлор получают t ° AuCl3
2AuCl3 2Au 3Cl2
Бром получают из природной воды. Йод – из природной воды, содержащей NaI действием Cl2.

Свойства
Хлор
Зелено-желтый газ с резким запахом. t пл = 101°С, t кип = 34°С. Ядовит. Жидкий хлор имеет желтую окраску.
Бром
Красно-бурая тяжелая жидкость, t пл = 7°С, t кип = 183°С. Пары брома имеют красную окраску.
Йод
Черные, металлические, блестящие кристаллы. t пл = 114°С, t кип = 183°С. Йод легко возгоняется, пар йода окрашен в красивый фиолетовый цвет.
Хлор легко реагирует со многими веществами. Из простых веществ, он не взаимодействует с C, N2, O2 и благородными газами.


Строение внешнего электронного слоя
всех галогенов: ns2np5. Для всех возможен переход атомов в возбужденные состояния (отличие от фтора). Прочность связи в молекулах галогенов уменьшается при переходе от Cl2 к I2.
Для галогенов характерны окислительно- восстановительные реакции, называемые «вытеснением» одного галогена другим из соединений.
Cl , Br , I (Br вытеснит Cl, I Br, I Cl)
Предыдущий вытесняет последующий из соединений
Последний элемент подгруппы VIIА – Астат в природе не встречается. Его изотопы получают ядерными реакциями. «Астат» – означает нестойкий

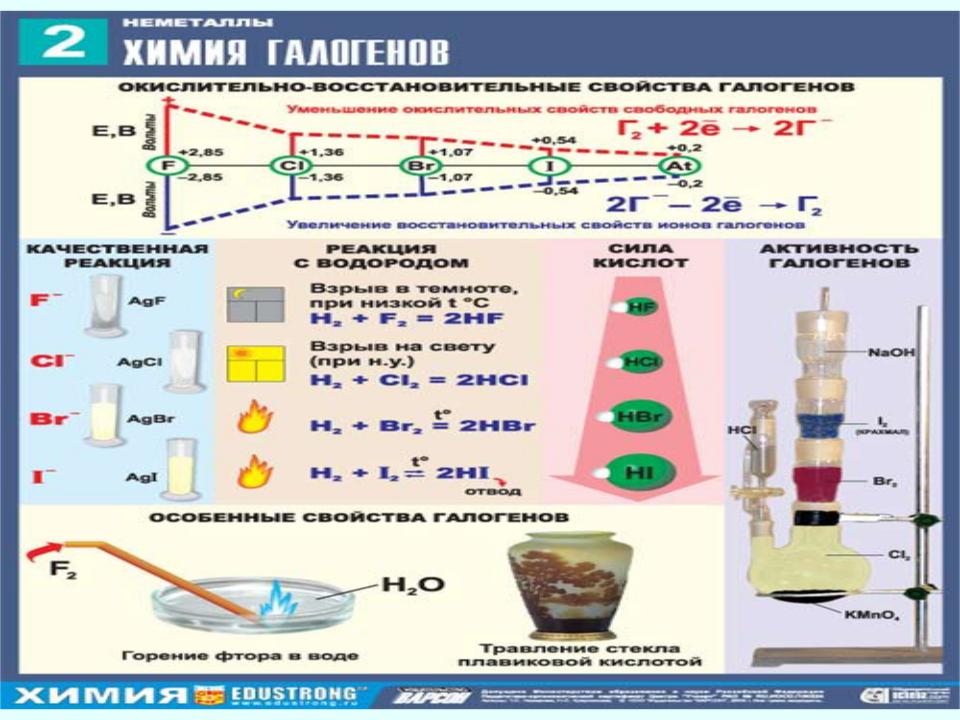

Химические свойства
1)Cl, Br, I непосредственно
взаимодействуютH Гс Н2.2HГ
2 2
хлор реагирует с Н2 бурно, со взрывом, но
для начала реакции необходимо освещение (это связано с цепным механизмом).
В ряду HCl HBr HI
в соответствии с увеличением ковалентной связи снижается дипольный момент.
HCl получают по реакции:
NaCl H2 SO4 (к) HCl NaHSO4
