
- •ЛЕКЦИЯ
- •К VII А группе неметаллов относятся
- •Природные ресурсы Соединения водорода в земной коре 1,0 % (масс.)
- •Получение
- •2) Водород высокой чистоты получают электролизом Н2О.
- •Свойства
- •VIIА группа
- •Химические свойства
- •Для водорода известны 3 изотопа:
- •Для водорода характерен особый вид
- •Соединения водорода делятся на 3 группы:
- •I – водородные соединения s и p элементов по их отношению к Н2О
- •д) Соединения подгруппы серы с водородом являются слабыми кислотами
- •6) тяжелая вода Д2О является замедлителем нейтронов в ядерных реакторах. Дейтериево-тритиевые смеси проводят
- •Генератор
- •Хлор. Бром. Йод.
- •Природные ресурсы:
- •Получение
- •Свойства
- •Строение внешнего электронного слоя
- •Химические свойства
- •но HBr и HI такие реакции не дают, т.к. доб-
- •Соляя́ная (хлороводороя́дна,
- •2) Галогены непосредственно с О2 не реагируют, т.к. связь Г – О обладает
- •ClO2 – бурый газ с резким запахом, ядовит, может взрываться. ClO2 – энер.
- •I2O5 – бесцветное кристаллическое соединение, при
- •HOCl – очень слабая кислота, разлагается на Cl2O4 H2O , на свету на
- •HClO3 HBrO3 HIO3
- •Соли этой кислоты наиболее сильные осушители, NaClO4, KClO4, RbClO4, CsClO4.
- •Применение
- •F – фтор
- •флуорит (плавиковый
- •Карбонат-фторапатит
- •Карбонат-
- •Свойства
- •В атмосфере фтора горят асбест и вода.
- •Плавиковая кислота
- •Существует в полимерах HF в газовой фазе. Жидкий HF – сильно ионизирующий растворитель.
- •Применение
- •травления

ЛЕКЦИЯ
9
VII А группа
Общая характеристика. Водород и его свойства.
Галогены. Физические и химические свойства галогенов. Получение и применение. Свойства водородных и кислородных соединений галогенов.

К VII А группе неметаллов относятся
(H), F, Cl, Br, I, At.
(Н) – Водород
Степень окисления: + 1 с элементами, имеющими большую электроотрицательность, в гидридах активных металлов
– 1 NaH, CaH2 и т.д.

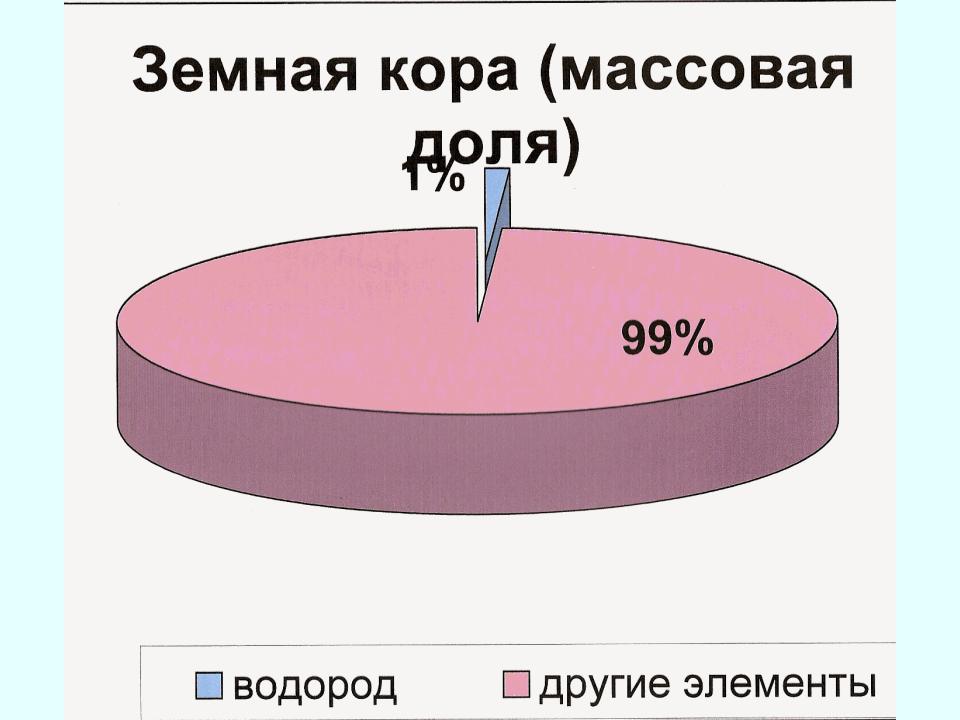
Природные ресурсы Соединения водорода в земной коре 1,0 % (масс.)
или 16 % (атм.). В основном в виде Н2О. В свободном состоянии, в виде атомов, он имеется в ничтожном количестве в верхних слоях атмосферы + вулканические и переходные газы. Он самый распространенный элемент во Вселенной, в атмосфере Солнца его содержание составляет 84 %. Он входит в состав живых существ + нефть и природный газ.



Получение
1)в промышленности:
Восновном из природного метана. При t ° (+ kat) смеси природного газа, воздуха,
водяного пара образуется:
CH4 H2O CO 3H2O
2СH O 2CO 4H
Эти процессы4называются2 пароводяной2 и кислородной конверсией метана.
Далее идет конверсия СО водяным
паром. t
CO H2O CO2 H2
kat |
Fe2O3 ( Cr2O3 , Al2O3 , K2O и др.) |
|
актив. добавки |

2) Водород высокой чистоты получают электролизом Н2О.
3) в лабораториях водород получают:
а) в баллонах
б) в аппарате Киппа (HCl, H2SO4 с Zn) в) электролизом KOH

Свойства
H2 – бесцветный газ, без вкуса и запаха, t пл – 259°С, tкип – 253°С, мало растворим в воде.
Смесь водорода с О2 – «гремучий газ».
Молекулы Н2 – наиболее легкие, поэтому газ наименее вязкий, наиболее теплопроводный и легко диффундирующий. 
Электронная конфигурация 1s.
1s1
Он может легко присоединять и легко отдавать 1 электрон, т.е. степень окисления =
±1. Он ведет себя аналогично элементам IА группы и VIIА группы. Водород обладает уникальностью, обуславливающей его особенность: H e H 1) положение Н2 в периодической таблице

VIIА группа
С галогенами водород связывает большее число признаков:
газообразное состояние (в обычных условиях), двухатомность ,
ковалентность связи ,
наличие во многих соединениях полярных ковалентных связей HCl и т.д.;
не электропроводность, т.е. он резко отличается от щелочных металлов.
IА группа
металлическая форма
одновалентность
