
- •Введение
- •1. Создание химико-технологической схемы (хтс) синтеза
- •Массообменные расчеты
- •2. Обоснование выбора типа идеального реактора
- •3. Расчет реактора
- •3.1 Выбор типа аппарата
- •3.2 Выбор материалов для изготовления деталей аппарата.
- •3.3 Расчет днища и крышки
- •3.4 Расчет элементов рубашки
- •3.5 Фланцевое соединение
- •3.6 Устройства для присоединения трубопроводов и осмотра аппаратов
- •4.2 Подбор стойки под редуктор
- •4.3 Подбор опоры под стойку
- •4.4 Выбор уплотнения
- •4.5 Выбор муфты
- •4.6 Проверочный расчет уплотнения
- •4.7 Проектный расчёт и конструирование вала и подшипникового узла
- •Заключение
- •Список использованной литературы
2. Обоснование выбора типа идеального реактора
РИВ-Н представляет собой трубчатый аппарат, в котором отношение длины трубы к ее диаметру достаточно велико L/d > 20.
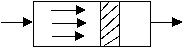
Рисунок 1 – Схема РИВ-Н
В реактор непрерывно подаются исходные реагенты, которые превращаются в продукты реакции по мере перемещения их по длине реактора. Любая частица потока движется прямолинейно и равномерно, не происходит ни продольного, ни поперечного перемешивания. Такой режим движения реагентов называется поршневым.
Концентрация исходного реагента А постепенно меняется по длине или высоте реактора от начального значения СА0 до конечного значения СА. Следствием такого режима движения реакционной смеси является то, что время пребывания каждой частицы в реакторе одно и то же.

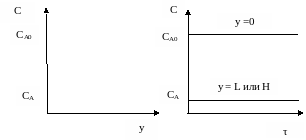
Рисунок 2 – Изменение концентрации реагента в реакторе
Исходным
уравнением для вывода характеристического
уравнения является материальный баланс
в дифференциальной форме. Модель РИВ-Н
предполагает движение реакционной
смеси только в одном направлении – по
х – координате, поэтому

где W – линейная скорость движения реакционной смеси, L – длина реактора.
В
РИВ-Н отсутствует продольное и радиальное
перемешивание, нет продольной и радиальной
конвективной диффузии, а молекулярной
диффузией можно пренебречь, поэтому
 .
.
После упрощения получаем характеристическое уравнение РИВ-Н в нестационарном режиме.

При
стационарном режиме
 (нет накопления вещества).
(нет накопления вещества).

Линейная скорость движения реакционной смеси в реакторе с постоянной площадью сечения в любой момент времени равна
 ,
следовательно,
,
следовательно,
 .
.
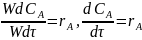
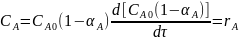
Разделим переменные и возьмем интегралы

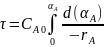 - характеристическое
уравнение РИВ-Н в стационарном режиме.
- характеристическое
уравнение РИВ-Н в стационарном режиме.
РИС-П представляет собой аппарат с мешалкой, в который непрерывно подают реагенты и также непрерывно выводят из него продукты.

Рисунок 3 – РИС-П с мешалкой
В таком реакторе создается интенсивное перемешивание, поэтому по всему реактора мгновенно устанавливается одинаковая концентрация реагента, равная концентрации на выходе. Резкое (скачкообразное) изменение концентрации происходит за счет мгновенного смешения поступающих реагентов с реакционной массой, уже находящейся в реакторе.

Рисунок 4 – Изменение концентрации реагента в реакторе
Величина перепада между начальной и конечной концентрацией зависит при прочих равных условиях от величины скорости химической реакции и от времени пребывания реакционной смеси в реакторе. Чем выше скорость и больше время, тем больше скачок концентрации.
Для РИС-Н характерно отсутствие градиентов параметров как во времени, так и по объему реактора, поэтому для вывода характеристического уравнения используют уравнение материального баланса в общей форме.
NА накопл. = NА конвек. - NА хим.р.
При стационарном режиме NА накопл. = 0.
NA конвек. = NА приход – NА сток
NА приход = NА0 = CА0 vоб., где vоб. – объемная скорость подачи реагента.
NА сток = NА0 (1-αА) = CА0 vоб. (1-αА)
NA конвек. = CА0 vоб. - CА0 vоб. (1-αА) = CА0 vоб.αА.
NA хим. =(-rA) Vp, где Vp – объем реактора.
CА0 vоб.αА = =(-rA) Vp, Vp = vоб τ
CА0 vоб.αА =(-rA) vоб τ
CА0αА = (-rA) τ

характеристическое уравнение для РИС-Н.
Для простой необратимой реакции «n»-го порядка

При
n = 0
 ,
при n = 1
,
при n = 1
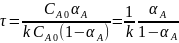 .
.
Характеристические уравнения для РИС-П и РИВ-Н одинаковы, и время достижения заданной степени превращения реагента в этих реакторах одно и то же. Но в РИС-П полное время процесса складывается из рабочего времени, рассчитываемого по характеристическому уравнению, и вспомогательного времени на загрузку и выгрузку. В РИВ-Н вспомогательных операций нет, поэтому интенсивность РИВ-Н выше, чем в РИС-П.
В РИС-Н вспомогательных операций тоже нет, но гидродинамическая обстановка в нем отличается от обстановки в РИВ-Н, поэтому для достижения одной и той же степени превращения реагента при прочих равных условиях требуется большее время, чем в случае РИВ-Н.
Сравним концентрационные режимы в РИС-Н и РИВ-Н. В РИВ-Н наблюдается постепенное уменьшение концентрации реагента по длине реактора, а в РИС-Н – резкое падение концентрации до конечного значения.



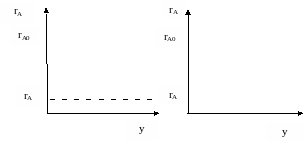
Рисунок 5 – Сравнение реакторов
Такой же характер для этих реакторов имеет изменение скорости реакции. Следовательно, средняя скорость реакции в РИС-Н всегда ниже, чем в РИВ.
Сравним характеристические уравнения реакторов в случае реакций разного порядка.
При n = 0 характеристическое уравнение РИС-Н и РИВ-Н имеет вид . Следовательно, время, необходимое для достижения заданной конверсии реагента одинаково; тип реактора в этом случае не оказывает влияния на интенсивность процесса. Это связано с тем, что при n = 0 скорость реакции не зависит от концентрации реагента.
При n > 0 тип реактора будет оказывать сильное влияние на интенсивность процесса.


 >
> ,
т.е.
,
т.е.
 .
.
Неравенство тем значительнее, чем больше конверсия реагента.

Рисунок 6 – Степень превращения
Для сложных процессов об эффективности судят не только по размерам реактора, но и по величине селективности. Для процессов, селективность которых зависит от концентрации реагента ( порядок целевой реакции ≠ порядку побочной реакции), на селективность можно повлиять, правильно выбрав тип реактора. Например, для сложно-параллельного процесса, в котором порядок целевой реакции выше порядка побочной реакции, для обеспечения высокой селективности необходимо поддерживать высокую концентрацию реагента. В этом случае лучше выбрать РИВ-Н. Если порядок целевой реакции меньше порядка побочной, нужно поддерживать низкую концентрацию реагента, поэтому более предпочтителен РИС-Н.
От типа реактора зависит и выход целевого продукта. Для сложно-параллельного необратимого процесса выход можно связать с селективностью следующими соотношениями:
РИС-Н
β = S αA;
РИВ-Н
 .
.
При увеличении αA
S уменьшается, если nцел.р. > nпобоч.р.; S увеличивается, если nцел.р. < nпобоч.р..

βРИВ-Н > βРИС-Н βРИС-Н > βРИВ-Н
Рисунок 7 – Сравнение реакторов
Во время лабораторного синтеза борат 1-гидрокси-2,4-бисфениламиноантрахинона были получены следующие результаты, представленные в таблице 4. Начальная концентрация реагента равна 69 моль/л.
Таблица 4 – Зависимость концентрации реагента А от времени
№ |
Тип реакции |
Тип реактора |
Начальная концентрация, моль/л |
Время реакции, мин |
||||||||||
1 |
2 |
3 |
4 |
5 |
15 |
30 |
45 |
60 |
90 |
115 |
||||
10 |
A→ D A→C |
РИС-П |
69 |
68 |
67 |
67 |
66 |
66 |
62 |
52 |
45 |
35 |
24 |
9 |
Определяем порядок реакции графическим способом. В таблице 5 рассчитаны данные, необходимые для построения графиков для определения порядка реакции.
Таблица 5 – Данные для графического определения порядка реакции
t, мин |
C, моль/л |
lnC |
1/C, л/моль |
1/C2, л2/моль2 |
1 |
68 |
4,21950771 |
0,01470588 |
0,00021626 |
2 |
67 |
4,20469262 |
0,01492537 |
0,00022277 |
3 |
67 |
4,20469262 |
0,01492537 |
0,00022277 |
4 |
66 |
4,18965474 |
0,01515152 |
0,00022957 |
5 |
66 |
4,18965474 |
0,01515152 |
0,00022957 |
15 |
62 |
4,12713439 |
0,01612903 |
0,00026015 |
30 |
52 |
3,95124372 |
0,01923077 |
0,00036982 |
45 |
45 |
3,80666249 |
0,02222222 |
0,00049383 |
60 |
35 |
3,55534806 |
0,02857143 |
0,00081633 |
90 |
24 |
3,17805383 |
0,04166667 |
0,00173611 |
115 |
9 |
2,19722458 |
0,11111111 |
0,01234568 |
По данным таблицы 5 строим четыре графика, дающие возможность графически определить порядок реакции. Графики строим в координатах «t – C», «t – lnC», «t – 1/C», «t – 1/C2» так, чтобы на графике были видны расчетные точки, и соединяющая их линия была линейной линией тренда (рис. 8), выводим на график величину достоверной аппроксимации R2.



Рисунок 8 – Графический метод определения порядка реакции (а) - нулевой порядок, б) -первый порядок, в) -второй порядок, г) – третий порядок)
По представленной на каждом из графиков величине достоверности аппроксимации R2 и характеру кривой, делаем вывод, что реакция 1-го порядка, так как в этом случае величина достоверности аппроксимации принимает наиболее близкое к единице значение, равное 0,9969.
Затем определяем порядок реакции аналитически. Для этого рассчитываем константы скорости k0, k1, k2, k3 для реакций 0-го, 1-го, 2-го и 3-го порядков в каждый момент времени по формулам соответственно:
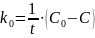 ,
,
 ,
,
 ,
,
 ,
,
где t – время контакта, мин;
С – концентрация исходного реагента в момент времени t, моль/л;
C0 – начальная концентрация исходного реагента A, моль/л.
Результаты расчета заносим в таблицу 7.
Таблица 7 – Зависимость концентрации исходного реагента и константы скорости реакций различных порядков от времени
t, мин |
C, моль/л |
k0, моль/(л∙мин) |
k1, (мин)-1 |
k2, л/(моль∙мин) |
k3, л2/(моль2∙мин) |
|||||
1 |
68 |
1 |
0,0145988 |
0,000213129 |
3,11153E-06 |
|||||
2 |
67 |
1 |
0,01470694 |
0,00021631 |
3,18171E-06 |
|||||
3 |
67 |
0,666666667 |
0,00980463 |
0,000144207 |
2,12114E-06 |
|||||
4 |
66 |
0,75 |
0,01111294 |
0,00016469 |
2,44106E-06 |
|||||
5 |
66 |
0,6 |
0,00889035 |
0,000131752 |
1,95285E-06 |
|||||
15 |
62 |
0,466666667 |
0,00713147 |
0,000109085 |
1,67019E-06 |
|||||
30 |
52 |
0,566666667 |
0,00942876 |
0,000157934 |
2,66304E-06 |
|||||
45 |
45 |
0,533333333 |
0,00949876 |
0,000171766 |
3,15319E-06 |
|||||
60 |
35 |
0,566666667 |
0,01131264 |
0,000234645 |
5,05239E-06 |
|||||
90 |
24 |
0,5 |
0,01173392 |
0,000301932 |
8,47817E-06 |
|||||
115 |
9 |
0,52173913 |
0,01771202 |
0,00084016 |
5,27636E-05 |
|||||
Показатель |
k₀ |
k₁ |
k₂ |
k₃ |
||||||
Среднее арифметическое |
0,65198 |
0,011448 |
0,00024415 |
0,000007872 |
||||||
Дисперсия |
0,032527 |
0.0000087046 |
0.000000038204 |
0.00000000020488 |
||||||
СКО |
0,18035 |
0,002950 |
0,00019546 |
0,000014314 |
||||||
Коэффициент вариации, % |
21,66 % |
25,77 % |
80,06 % |
181,84 % |
||||||
Дисперсия случайной величины – это один из основных показателей в статистике. Он отражает меру разброса данных вокруг средней арифметической, дисперсия дает характеристику разброса данных вокруг центра. То есть дисперсия — это математическое ожидание отклонений от математического ожидания. На практике при анализе выборок математическое ожидание, как правило, не известно. Поэтому вместо него используют оценку – среднее арифметическое. Расчет дисперсии производят по формуле:
 ,
,
где s2– выборочная дисперсия, рассчитанная по данным наблюдений,
X– отдельные значения,
X̅– среднее арифметическое по выборке,
n– количество значений в выборке.
Для расчета стандартного среднеквадратичного отклонения(СКО) необходимо из дисперсии извлечь квадратный корень. Среднеквадратичное отклонение имеет те же единицы измерения, что и анализируемый показатель, поэтому является сопоставимым с исходными данными.
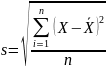 ,
,
Значение стандартного отклонения зависит от масштаба самих данных, что не позволяет сравнивать вариабельность в разных выборках. Коэффициент вариации ‑ величина относительная, на его размер не оказывают влияние абсолютные значения изучаемого показателя. С помощью коэффициента вариации можно сравнивать даже колеблемость признаков, выраженных в разных единицах измерения. Коэффициент вариации изменяется в пределах от 0 до 100%, при этом значение коэффициента прямо пропорционально силе колеблемости. Коэффициент вариации рассчитывается по формуле:
 ,
,
Проведя анализ таблицы 7 можно сделать вывод, что, используя графический и аналитический метод, порядок реакции определен как первый и константа скорости реакции для дальнейших расчетов определена равной k3=0,651 л2/(моль2∙мин).

Рисунок 9 – Зависимость концентрации реагентов от времени реакции.
