
4. Компоненты буровых растворов. ТВердая фаза буровых рстворов. Химия глин.
4.1. Структурные особенности водных алюмосиликатов
Если для промывки скважины применяют суспензии, то их основные коллоидно-химические и технологические свойства определяются в значительной степени составом дисперсной (твердой) фазы. В качестве твердой фазы таких промывочных жидкостей могут быть как минеральные, так и синтетические органические, неорганические, а также органо-минеральные соединения. Из минеральных веществ для приготовления промывочных жидкостей используются такие, которые можно легко получить в высокодисперсном виде. Это прежде всего различные глинистые породы, реже мел, асбест и др.
В качестве синтетических соединений для приготовления промывочных жидкостей могут применяться слаборастворимые вводных растворах неорганические и органические соли и комплексы, получаемые, как правило, непосредственно в дисперсионной среде путем создания в ней соответствующих условий. Такими соединениями, например, могут быть некоторые гидроксиды, сульфаты, силикаты, органические комплексы поливалентных металлов и др.
Кроме перечисленных веществ, являющихся активной частью твердой фазы, дисперсной фазой могут быть выбуренные частицы (шлам) и различные технологические компоненты, например утяжеляющие (барит, гематит, мел и т. д.).
В качестве промывочных жидкостей наибольшее применение имеют суспензии, в которых активной твердой фазой являются высокодисперсные разности глин.
Глины представляют собой тонкообломочные смеси минералов (в основном кристаллического строения), образовавшиеся в результате физико-химического выветривания горных пород.
Основную их часть составляют глинистые минералы, представляющие высокодисперсные и относительно стабильные минеральные соединения группы водных алюмосиликатов слоистого или слоисто-ленточного строения, преимущественно образовавшихся в процессе физико-химического выветривания горных пород. Их высокая дисперсность, характеризующаяся коллоидными и близкими к ним размерами частиц, обусловлена спецификой свойств базальных поверхностей микрокристаллов этих частиц.
Основу слоистого строения глинистых минералов составляют кремнекислородные тетраэдрические и алюмогидроксидные октаэдрические сетки, неограниченно развитые в плоскости. Тетраэдрические сетки состоят из тетраэдров, связанных между собой через вершины своих оснований. Четыре вершины тетраэдра [SiO4]4- заняты анионами О2-, а в центре его находится более мелкий катион. Расстояния Si-О в тетраэдрах меняются в зависимости от структурного типа силиката в пределах (1,55-1,72) • 10-8 см. В слоистых силикатах средние расстояния Si-О в пределах одного тетраэдра равны 1,62 • 10-8 см. Центральная позиция в тетраэдрах иногда частично изоморфно замещается на А13+. При этом в слоистом силикате расстояние А1-О уже составляет в среднем 1,77 • 10-8 см. Сопоставление этих расстояний с суммой ковалентных радиусов Si и О, а также А1 и О свидетельствует о преимущественно ковалентном характере связей в тетраэдрах.
В такой непрерывной трехмерной структуре выделить отдельную молекулу не удается - валентные связи каждого иона разделяются между окружающими ионами. Число окружающих ионов является координационным числом данного иона, и оно тем больше, чем меньше различие в размерах ионов (табл. 3.1).
Таблица 3.1 Различные типы координации ионов
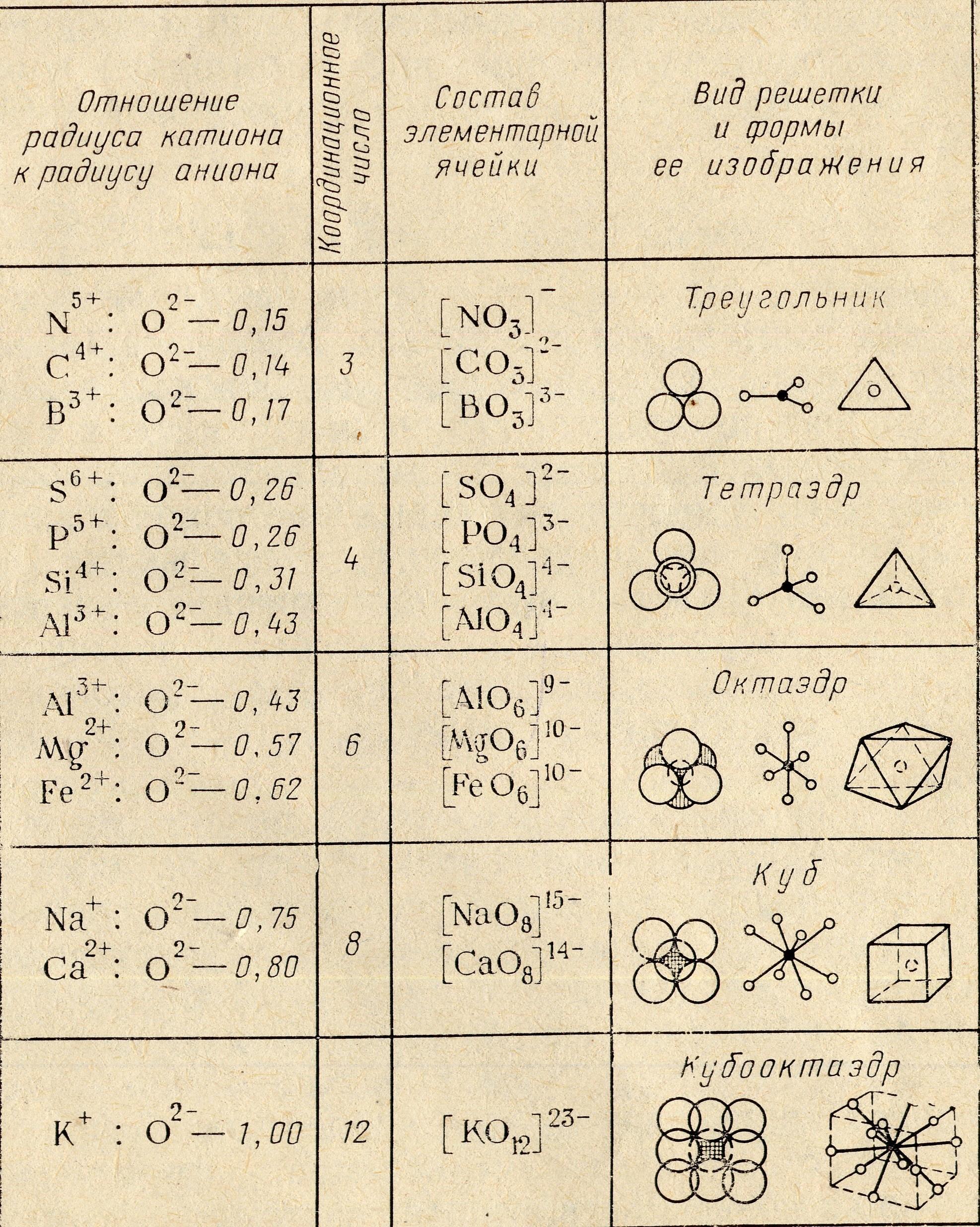
Избыток отрицательных зарядов в тетраэдрическом оксианионе [SiO4]4- или октаэдрической ячейке [АlO4]5- может быть нейтрализован присоединением каких-либо катионов или соединением нескольких тетраэдров. Соединение тетраэдров осуществляется через мостиковые ионы кислорода Oм. В слоистых силикатах в каждом тетраэдре три иона кислорода, через которые образуется кремнекислородный слой, - мостиковые и только один ион кислорода, через который этот слой соединяется с октаэдрическими катионами - немостиковый (Онм). Такой слой соответствует формуле [Si2O3мО6нм].
Амфибольные ленты - двойные цепочки - имеют также один немостиковый и три мостиковых иона кислорода. В случае 6-членного (из 6 тетраэдров) звена они соответствуют формуле [Si4O5мО6нм].
Октаэдрические сетки образуют октаэдры, сочлененные боковыми ребрами. В центре октаэдра [А1(О, ОН)6] располагается катион А13+, очень часто изоморфно замещаемый Fe3+, Cr3+, Mg2+, Zn2+, Li+ и др. Вершины октаэдра заняты кислородом или гидроксид-ионами.
Если в октаэдрическом слое ионами А13+ или Fe3+ заняты не все центры октаэдров, а лишь 2/3 всех возможных замещений, то этот слой имеет диоктаэдрическое строение. Соединение октаэдров в нем происходит через два гидроксид-иона, причем каждый из них оказывается связанным с двумя ионами алюминия. Если же вместо ионов А13+ в октаэдрических слоях будут находиться ионы Mg2+ (или Fe2+), то они благодаря меньшему заряду способны занять все возможные центры в октаэдрах и слой будет иметь триоктаэдрическое строение.
Центры многогранников, как в тетраэдрических, так и в октаэдрических слоях располагаются гексагонально, причем гексагональные ячейки обеих слоев соизмеримы между собой.
Слои, соединяясь между собой в различных сочетаниях, образуют кристаллические решетки глинистых минералов. Иными словами, кристаллическая решетка глинистых минералов образуется сочетанием кремнекислородных и кислород-гидроксид-алюминиевых слоев (см. табл. 3.2).
В глинистых минералах соотношение между этими слоями, образующими пакеты, обозначают цифрами 1:1, 2:1, 2:2. При соединении тетраэдрического и октаэдрического слоев ионы О2- тетраэдрического слоя, расположенные на вершинах тетраэдров, становятся общими для обоих слоев, т. е. служат «мостиками» между ионами Si4+ одного слоя и ионами А13+ другого слоя. Такая структура наиболее устойчива, так как число положительных зарядов Si4+ и А13+ в этой структуре равно числу отрицательных зарядов О2- и ОН-
