
- •Сборник заданий
- •Задание №1 по теме "строение вещества"
- •Варианты домашнего задания по теме «Строение вещества»
- •1.Задание по теме «строение атома»
- •ЗаданиЯ по теме «ковалентная химическая связь и строение молекулярных частиц»
- •2.1.Опишите строение предложенных в варианте задания молекул и молекулярных ионов по методу валентных связей (мвс):
- •Задания по теме «межмолекулярные взаимодействия и свойства веществ»
- •3.1. Проанализируйте влияние сил межмолекулярного взаимодействия на свойства веществ (решите задачу с указанным номером).
- •Типы межмолекулярного взаимодействия
- •Список рекомендуемой литературы
- •Задание №2 по теме: «термохимия. Направление химических реакций»
- •Примеры решения задач
- •2. Рекомендации для самостоятельной работы студентов и варианты заданий
- •3. Задачи для самостоятельного решения
- •4. Варианты заданий
- •Задание №3 по теме «химическая кинетика и равновесие»
- •Примеры решения задач
- •1.3. Вычисление константы химического равновесия
- •1.4. Вычисление равновесных концентраций
- •1.5. Направление смещения равновесия
- •Задачи для самостоятельного решения
- •Варианты заданий
- •Список рекомендуемой литературы
- •Задание № 4 по теме «Растворы»
- •Примеры решения задач
- •1.1. Процентная концентрация
- •1.3. Моляльная концентрация (моляльность) , мольная доля, титр
- •1.4. Осмотическое давление. Закон вант- гоффа
- •1.5. Давление насыщенного пара растворов. Тонометрический закон рауля
- •1.6. Температуры кипения и замерзания растворов.
- •2. Задачи для самостоятельного решения
- •3. Варианты заданий
- •Список рекомендуемой литературы
- •Задание №5 по теме: "растворы электролитов"
- •Примеры решения задач
- •1.1. Вычисление степени диссоциации слабых электролитов
- •1.3. Произведение растворимости
- •1.5. Обменные реакции в растворах электролитов
- •Варианты заданий
- •Список рекомендуемой литературы
- •Задание №6 по теме «гидролиз солей»
- •Примеры решения задач
- •Варианты заданий
- •Список рекомендуемой литературы
- •Задание № 7 по теме «Окислительно–восстановительные реакции. Электрохимия»
- •Примеры решения задач
- •2. Задания для самостоятельного решения
- •Список рекомендуемой литературы
- •Задание № 8 по теме «Классификация и свойства неорганических веществ»
- •Примеры решения задач
- •Пример 5. С какими из перечисленных веществ вступит в реакцию серная кислота: koh, CuO, Ba(oh)2, Fe2o3, Al2o3, co2, SiO2, h3po4, o2, h2o? Составьте уравнения возможных реакций.
- •Задания для самостоятельного решения
- •Варианты заданий
- •Список рекомендуемой литературы
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •3.Варианты заданий
- •Задание № 10 по теме «Дисперсные системы»
- •Пример решения задачи
- •Варианты заданий
- •Список РекомендуемОй литературЫ
- •Сборник заданий для самостоятельной работы студентов по дисциплине «химия
- •450062, Республика Башкортостан, г.Уфа, ул. Космонавтов,1
Список рекомендуемой литературы
1. Глинка Н.Л., Ермаков А.И. Общая химия: учеб. пособие для вузов
/ под ред. А.И. Ермакова.–2-е изд., испр.–М.: Интеграл–Пресс,2001.–728 с.
2. Глинка Н.И., Рабинович В.А., Рубина Х.М. Задачи и упражнения по общей химии: учеб. пособие для студентов нехим. спец. вузов/под ред. В.А. Рабиновича, Х.М. Рубиной.–М.: Интеграл–Пресс, 2004.–240 с.
3. Молявко М.А., Шевляков Ф.Б. Окислительно-восстановительные реакции: учеб. пособие.- Уфа: УГНТУ, 2008.
Задание № 8 по теме «Классификация и свойства неорганических веществ»
Примеры решения задач
Пример 1. Назовите и напишите графические формулы молекул следующих оксидов: CaO, SeO2,Sb2O3.
Решение:
CaO – оксид кальция;
Графическая формула CaO Ca=О;
SeO2 – оксид селена (IV);
Графическая формула SeO2 О= Se=O;
Sb2O3 – оксид сурьмы (III);
Графическая формула Sb2O3 О= Sb-O- Sb=О.
Пример 2. Назовите кислоты H4GeO4, HPO3, H2S2O7 и напишите их графические формулы
Решение:
H4GeO4 содержит центральный атом Ge в высшей степени окисления, в ней число атомов водорода равно числу атомов кислорода (т.е. H4GeO4 отвечает общей формуле ортокислот состава H4 Э О4). Следовательно, H4GeO4 называют ортогерманиевой кислотой

HPO3 имеет в своем составе атом фосфора в высшей степени окисления (+5), её молекула содержит на одну молекулу воды меньше, чем в ортокислоте (H3PO4).
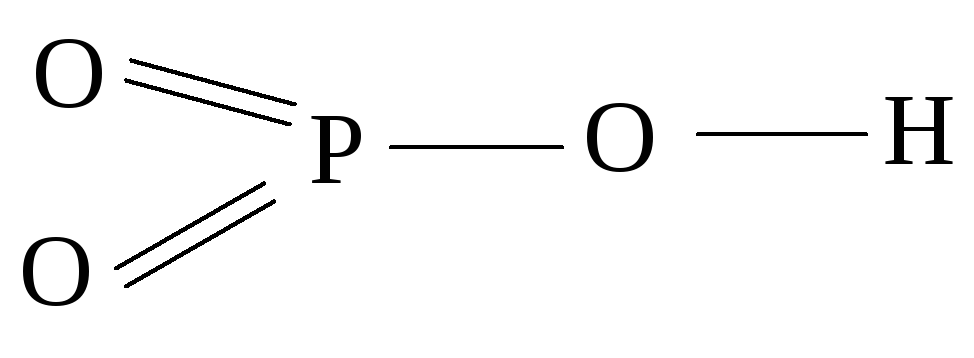
Поэтому HPO3 называют метафосфорной кислотой.
H2S2O7 содержит два центральных атома серы, поэтому в названии должна присутствовать приставка ди-.
Степень окисления атомов серы в молекуле максимальна (+6), поэтому H2S2O7 называют дисерной кислотой.
Пример 3. Назвать соли: AlN, (CuOH)2CO3 , Al2(SO4)3, MgHCO3. Написать их графические формулы
Решение:
AlN – нитрид алюминия
Al ≡ N
(CuOH)2SO4 – сульфат гидроксомеди (II) Al2(SO4)3 – сульфат алюминия
H − O − Cu − O O O − S = O
\ // / / \\
S Al − O O
/ \\ \
H − O − Cu − O O O − S = O
/ \\
O O
/
Al − O O
\ \ //
O − S = O
Mg(HCO3)2 – гидрокарбонат магния
H − O
|
O − C = O
/
 Mg
O − C = O
Mg
O − C = O

 О
Н
О
Н
Пример 4. Напишите уравнения реакций получения солей из оксидов хрома.
Решение:
Хром в соединениях имеет степень окисления +6, +3, +2. Его оксиды CrO3, Cr2O3 и CrO соответственно кислотный, амфотерный и основной. Уравнения реакций, характеризующие их способность образовывать соли, следующие:
CrO3 + 2NaOH = Na2CrO4 + H2O
Cr2O3 + 6 HCl = 2CrCl3 + 3H2O
Cr2O3 + 2NaOH = 2NaCrO2 + H2O
CrO + 2HCl = CrCl2 + H2O
