
Kospekt_lektsy_po_fiz_khimii
.pdf
Видим, что в отличие от чистых веществ, которые кристаллизуются при постоянной температуре (С = 1 + 1 – 2 = 0), бинарные жидкие растворы затвердевают в интервале температур, в котором меняются составы и жидкой, и твердой фаз. Эвтектика кристаллизуется, подобно чистому веществу, при постоянной температуре (С = 2 + 1 – 3 = 0).
Сплавы, составы которых находятся на концентрационной оси левее эвтектической концентрации, принято называть доэвтектическими, а те, что правее – заэвтектическими. Ясно, что при охлаждении расплавов заэвтектических составов кристаллизация начинается с образования кристаллов β-твердого раствора.
3.Диаграмма состояния с эвтектикой и полной взаимной нерастворимостью компонентов в твердом состоянии
Это тот случай, о котором мы уже говорили, рассматривая кристаллизацию чистого растворителя при охлаждении раствора. Диаграмма состояния такой системы А-В выглядит так, как если бы линии солидус и линии предельной растворимости со стороны каждого из компонентов проходили настолько близко к вертикальным осям, что практически совпадали бы с ними (рисунок 35).
T |
|
|
|
|
|
|
|
|
|
||
TплA |
|
|
L |
|
TплB |
|
|
|
Aтв + L |
Bтв + L |
|
|
|
|
|
||
Tэ |
|
|
|
|
|
|
|
Aтв + Bтв |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
xB |
1 |
|||
Рисунок 35 – Диаграмма состояния бинарной системы А-В с эвтектикой и полной взаимной нерастворимостью компонентов в твердом состоянии
Очевидно, что здесь при охлаждении расплава ниже ликвидуса образуются кристаллы не α- или β-твердого раствора, а чистого вещества А в доэвтектических сплавах или чистого вещества В – в заэвтектических. Эвтектика при Tэ также состоит из кристаллов чистых веществ А и В и образуется по реакции
L → A + B .
4.Системы, компоненты которых образуют между собой в твердом состоянии интерметаллические соединения
Металлы могут образовывать друг с другом не только растворы, но и химические соединения, называемые интерметаллическими соединениями, или интерметаллидами. Они имеют собственную кристаллическую структуру, отличную от кристаллических структур образующих их металлов. Состав интерметаллидов может, как отвечать стехиометрическим соотношениям, так и отличаться от них. Если такое соединение устойчиво до температуры плавления и при плавлении не разлагается, т.е. получается расплав того же состава, то говорят, что имеет место конгруэнтное плавление. Чем более прочные химические связи
91
имеет интерметаллическое соединение, тем более острый максимум отвечает ему на линии ликвидус (рисунок 36).
T
L
Aтв + AmBn
Bтв + AmBn
0 |
AmBn |
xB |
1 |
Рисунок 36 – Диаграмма состояния бинарной системы А-В с конгруэнтно плавящимся интерметаллическим соединением Am Bn стехиометрического состава
На рисунке 36 присутствие интерметаллида в системе представлено вертикальной линией, в соответствии со строго определенным составом этой фазы. В некоторых системах возможны небольшие отклонения состава интерметаллической фазы от стехиометрического, тогда ей на диаграмме состояния отвечает область гомогенности (рисунок 37).
T
L
Aтв + AmBn
Bтв + AmBn
0 |
AmBn |
1 |
Рисунок 37 – Диаграмма состояния бинарной системы А-В с конгруэнтно плавящимся интерметаллическим соединением Am Bn , имеющим область гомогенности
Видим, что в обоих представленных вариантах диаграмма состояния состоит из двух частей – квазибинарных систем с эвтектикой – с общей осью ординат. К каждой из этих
92
частей в отдельности применимо все, что мы рассмотрели выше в отношении систем с эвтектикой. Соединений в системе может быть несколько, тогда и диаграмма состояния разбивается на несколько частных диаграмм эвтектического типа.
Диаграмма состояния системы с интерметаллическими соединениями может выглядеть и по-другому (рисунок 38). Если интерметаллид термически неустойчив и при плавлении разлагается на компоненты, то имеет место инконгруэнтное плавление.
|
1 |
2 |
3 |
|
T |
|
|
|
|
|
a |
c |
|
L |
|
|
|
|
|
|
|
|
f |
|
Tп |
b |
d |
g |
p |
|
|
|
|
k
e
0 |
AmBn |
xB |
1 |
Рисунок 38 – Диаграмма состояния бинарной системы А-В с инконгруэнтно плавящимся интерметаллическим соединением Am Bn
Интерметаллид Am Bn на рисунке 38 при нагревании до температуры Тп –
перитектической температуры – распадается при постоянной температуре с образованием жидкого раствора состава точки p – перитектической точки по реакции
Am Bn → Lp + Aтв ,
так же называемой перитектической. Т.е. при температуре Тп имеет место трехфазное равновесие, и С = 0. Перитектическая точка отличается от эвтектической точки тем, что оба вида кристаллов, находящихся в равновесии с жидкостью при перитектической температуре, обогащены одним и тем же компонентом, по сравнению с жидким раствором. Рассмотрим кристаллизацию сплавов трех разных составов, приводящую к различным результатам.
Сплав 1. В температурном интервале между точками a и b из жидкого раствора выделяются кристаллы чистого вещества А. При достижении перитектической температуры в равновесии с жидким раствором, изменившим свой состав до состава точки p, и кристаллами вещества А оказывается твердый интерметаллид Am Bn , который и начинает образовываться по реакции
Lp + Aтв → Am Bn .
Превращение протекает, согласно правилу фаз, при постоянной температуре, которая не может изменяться, пока в равновесии имеются все три фазы. По окончании реакции в сплаве
93
данного состава жидкая фаза полностью исчезает, что дает возможность, отнимая теплоту у системы, продолжить охлаждение. Далее оно протекает в твердом состоянии без каких-либо изменений состава образовавшихся кристаллических фаз. В итоге в полностью затвердевшем сплаве 1 присутствуют кристаллы вещества А, выпавшие при температурах выше перитектической, а также кристаллы интерметаллида Am Bn , образовавшиеся в ходе
перитектического превращения.
Сплав 2. Состав этого сплава выбран так, что отвечает интерметаллическому соединению. Кристаллизация при перитектической температуре, в условиях нонвариантного равновесия, приводит к полному израсходованию жидкого раствора и ранее образовавшихся кристаллов вещества А. Далее охлаждается полностью затвердевший сплав, имеющий в своей структуре только кристаллы интерметаллида Am Bn .
Сплав 3. В этом сплаве после окончания перитектического превращения, которое заканчивается вследствие исчезновения кристаллов вещества А, образовавшихся при охлаждении в интервале температур между точками f и g, остаются две фазы: жидкий раствор состава точки p и кристаллы интерметаллида Am Bn . Дальнейшее охлаждение до
эвтектической температуры приведет к дополнительному образованию кристаллов Am Bn ,
при этом жидкая фаза обогатится веществом B до состава точки е. При температуре эвтектики вновь наблюдается трехфазное равновесие, и после окончания эвтектической реакции
Le → Am Bn + Bтв
сплав охлаждается в твердом состоянии без изменения числа и составов фаз. В структуре полностью затвердевшего сплава 3 присутствуют кристаллы Am Bn , образовавшиеся в результате перитектического превращения, кристаллы Am Bn , выпавшие из жидкого раствора в интервале температур gk, а также эвтектическая смесь кристаллов Am Bn и вещества В.
Видим, что кристаллы одного и того же интерметаллида представлены в сплаве 3 в трех различных морфологических формах.
Диаграмма состояния бинарной системы с перитектическим превращением может выглядеть и несколько иначе (рисунок 39).
T |
T |
b
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
a |
c |
|
|
0 |
AmBn |
xB |
1 |
0 |
AmBn |
xB |
1 |
|||
Рисунок 39 – Варианты диаграмм состояния бинарных систем А-В с перитектическим превращением
94
5. Диаграмма состояния бинарной системы с монотектическим превращением (с расслоением в жидком состоянии)
Типичная диаграмма с расслоением в жидком состоянии представлена на рисунке 40.
|
|
|
|
k |
|
|
||
T |
L |
b |
|
|
a |
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
L1 + L2 |
|
|
|
||
Tм |
|
|
|
|
c |
|
|
|
|
|
|
|
|
|
|
|
|
|
m |
|
f |
|
|
|||
|
|
|
|
|
||||
|
|
|
Aтв |
+ L |
d |
|
|
|
|
|
|
|
|
|
Tэ |
||
|
|
|
|
|
|
e |
|
|
|
|
|
Aтв + Bтв |
|
|
|
||
|
|
|
|
|
|
|||
0 |
|
xB |
|
|
|
1 |
||
Рисунок 40 – Диаграмма состояния |
бинарной |
системы А-В с расслоением в жидком |
||||||
состоянии |
|
|
|
|
|
|
|
|
Линия ликвидус на ней имеет форму купола, внутри которого заключена область существования в равновесии двух жидких растворов L1 и L2, которые не смешиваются друг с другом. Выше линий ликвидус система находится в жидком состоянии L и однофазна. Точка k в вершине купола несмешиваемости – это критическая точка расслоения.
Рассмотрим превращения при охлаждении из жидкого состояния до полного затвердевания сплава, линия охлаждения которого отмечена вертикальной прямой на рисунке 40. При понижении температуры до точки a однородный жидкий раствор оказывается в равновесии с другим жидким раствором, имеющим состав точки b. Чуть ниже линии купола в расплаве начинается зарождение капель жидкости другого состава, и в интервале температур между точками a и c происходит выделение второй жидкости в объеме первой. Имея различную плотность, две жидкие фазы формируют два слоя. По мере охлаждения системы в пределах купола несмешиваемости составы жидкостей L1 и L2 изменяются в соответствии ходом ветвей купола, а именно на участках bm и af. Чем ниже температура, тем ниже взаимная растворимость жидкостей, тем они сильнее различаются по составу. При температуре Tm – монотектической температуре – в равновесии могут находиться три фазы: жидкости L1 и L2 и кристаллы вещества А. Поэтому система нонвариантна (С = 0). Точка m – монотектическая точка. Суть монотектического превращения, происходящего при постоянной, монотектической, температуре, состоит в следующем. Жидкость состава точки m распадается на две фазы: кристаллы вещества А и жидкий раствор состава точки f. Отличие этого превращения, описываемого соотношением
Lm → Aтв + Lf
95
от эвтектического состоит в том, что в результате него появляются жидкая и твердая фазы, а не две твердые фазы. Монотектическая реакция заканчивается, когда жидкая фаза Lm будет полностью израсходована, и в системе останется две фазы. Становится возможным дальнейшее понижение температуры. В ходе него в интервале между точками c и d из жидкого раствора, изменяющего свой состав по линии fe, выделяются кристаллы чистого вещества А. Далее следует уже знакомый нам участок диаграммы с эвтектическим превращением при Тэ, в результате которого кристаллизуется эвтектика из кристаллов чистого вещества А и кристаллов чистого вещества В. Окончательно сформировавшаяся структура сплава содержит кристаллы вещества А, образовавшиеся в результате монотектического превращения, кристаллы вещества А, выделившиеся из расплава при охлаждении в интервале между температурами монотектики и эвтектики, а также эвтектическую смесь кристаллов чистых веществ А и В.
Имеется довольно много пар металлов, сплавы которых расслаиваются в жидком состоянии: Fe-Pb, Fe-Ag, Fe-Sn, Bi-Zn, Ga-Pb и др. Если очень быстро охладить расплав из области над куполом или из верхней его части, то можно подавить выделение кристаллов вещества А из двухфазного расплава и получить замороженную эмульсию. Ее микроструктура представляет собой равномерно распределенные сферические вкрапления одной фазы в другой. Поскольку обе эти замороженные твердые фазы не отвечают равновесным составам, то в них со временем, а, возможно, уже в процессе охлаждения, начнется выделение кристаллов вещества А (в фазе, обогащенной этим компонентом).
Жидкофазное расслоение встречается не только в металлических системах. Существует ряд органических систем, в которых наблюдается несмешиваемость в жидком состоянии (рисунок 41).
T |
|
L |
T |
|
|
|
|
|
|
|
|
|
|
|
|
|
Hсм > 0 |
|
|
Hсм > 0 |
|
|
|
|
|
|
|
|
Hсм < 0 |
|
|
|
|
L |
|
|
|
|
|
|
|
|
H2O |
C6H5NH2 |
H2O |
C10H14N2 |
|
|
|
(анилин) |
|
|
(никотин) |
Рисунок 41 – Диаграммы состояния бинарных органических систем с одной (верхней) и двумя (верхней и нижней) критическими точками расслоения
Существование верхней критической точки расслоения имеет место, если при нагревании двухфазной жидкой системы взаимное растворение фаз сопровождается поглощением теплоты. При этом с ростом температуры взаимная растворимость тоже растет. Если, напротив, растворение связано с выделением теплоты, то это приводит к появлению нижней критической точки расслоения. Наличие верхней и нижней критических точек расслоения, как в системе вода-никотин (рисунок 41), обусловлено тем, что теплота растворения жидкостей при изменении температуры меняет знак. Приведенные утверждения находятся в соответствии с принципом Ле-Шателье.
К любой двухфазной области на диаграмме состояния бинарной системы, независимо от ее типа, может быть применено правило «рычага», о котором говорилось выше (см.
96
лекцию 10). Оно позволяет определить количественное соотношения двух фаз при заданной температуре.
Лекция 12
Теоретические методы построения диаграмм состояния двухкомпонентных систем по термодинамическим данным
Поскольку любая линия диаграммы состояния графически представляет зависимость температуры равновесного фазового перехода от состава, то при постоянном давлении построение диаграммы состояния сводится к отысканию зависимости
T = ϕ (xi ) .
В бинарной системе при P = const
G = f (T , x2 ) ,
и при равновесии
|
|
∂G |
∂G |
|
|
||
|
|
|
|
|
|
2 |
|
dG = |
|
∂T x2 |
dT + |
|
|
dx |
= 0 , |
|
|
|
∂x2 T |
|
|
||
откуда
|
|
|
|
|
∂G |
|
||
|
|
|
|
|
|
|
|
|
|
∂T |
|
∂x |
|
||||
|
|
|
|
|||||
|
|
|
= − |
|
2 |
T |
. |
(82) |
∂x |
|
|
|
|||||
|
|
|
∂G |
|
||||
|
2 |
P |
|
|
|
|
|
|
|
|
|
|
|
∂T x2 |
|
||
Для нахождения зависимости Т от состава (x2) в левой части уравнения (82) надо знать зависимости молярной энергии Гиббса от состава (числитель правой части) и температуры (знаменатель). Т.е. вид зависимости Т от x2 однозначно определяется характером функций G =f(x2) при постоянной температуре и G = f(T) при постоянном составе. Вид второй из них нам известен (см. лекцию 3):
|
∂G |
= −S . |
|
|
|
|
∂T P, x2 |
|
Из этого уравнения следует, что энергия Гиббса убывает с ростом температуры, причем у жидкой фазы интенсивнее, чем у твердой фазы, так как Sж > Sтв.
Вид второй зависимости зависит от природы фаз в системе. Рассмотрим некоторые важные случаи.
1.Компоненты А и В взаимно нерастворимы и образуют смесь
Для такой системы мольный термодинамический потенциал G складывается из мольных потенциалов чистых веществ в соответствующем агрегатном состоянии (жидком или твердом):
Gсм = x1G1o + x2G2o = G1o + (G2o − G1o )x2 .
97
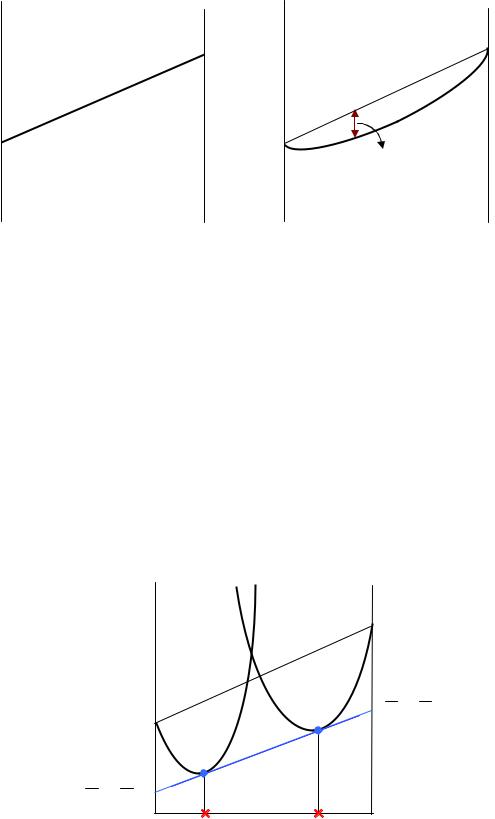
Очевидно, что это уравнение прямой линии (рисунок 42, а).
Gсмеси |
а |
Gраствора |
|
б |
|
|
G2° |
G2° |
G1° |
|
|
|
G1° |
G образования |
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
раствора из |
|
|
|
|
|
|
|
|
|
чистых веществ |
|
|
|
|
|
|
|
|
|
|
|
|
|
0 |
x2 |
1 |
|
0 |
x2 |
1 |
||
Рисунок 42 – Зависимости мольной энергии Гиббса бинарной системы от состава: а – компоненты полностью нерастворимы друг в друге;
б – компоненты образуют непрерывный ряд растворов во всей области концентраций
2. Компоненты А и В полностью взаимно растворимы Как мы уже отмечали ранее, при самопроизвольном образовании раствора из чистых
веществ происходит уменьшение энергии Гиббса системы:
Gр− р = x1G1o + x2G2o + G ,
где G < 0. График зависимости энергии Гиббса от концентрации для растворов проходит ниже прямой, характерной для смеси веществ (рисунок 42, б).
3.Компоненты А и В ограниченно растворимы друг в друге В этом случае в системе возможно образование двух растворов, например, α- и β-
твердых растворов (рисунок 43).
|
G |
|
|
|
|
G1° |
|
|
|
|
|
α + β |
|
β |
|
|
|
|
|
G ′ = G ′′ |
α x2α |
x |
β |
|
1 |
1 |
|
|
2 |
|
0 |
x2 |
|
1 |
G2°
G2′ = G2′′
Рисунок 43 – Равновесие двух ограниченных твердых растворов в бинарной системе
Условием равновесия в такой системе является равенство химических потенциалов каждого из компонентов в обеих фазах:
98

G1′ = G1′′ , G2′ = G2′′ .
Для того чтобы определить графическим методом химические потенциалы компонентов растворов (их парциальные молярные энергии Гиббса), удовлетворяющие указанному условию, надо провести общую касательную к кривым рисунка 43. Она при пересечении с осями ординат отсечет на них отрезки, отвечающие искомым величинам. Поэтому проекции точек касания на концентрационную ось x2α и x2β покажут составы
равновесных друг с другом соответственно α- и β-твердых растворов. В промежутке между отмеченными величинами концентрации устойчива смесь двух твердых растворов, а за их пределами – только какой-либо один из них. Действительно, в области составов между концентрациями x2α и x2β прямая линия, характерная для концентрационной зависимости энергии Гиббса смеси фаз, проходит ниже кривых, отвечающих растворам. Как нам известно, из всех возможных состояний системы реализуется то, которое при данных P,T=const обладает наименьшим значением энергии Гиббса.
4. Равновесие жидкого раствора и чистого твердого вещества Если такое равновесие возможно в бинарной системе, то должно выполняться условие
G2oтв = G2ж .
Поскольку возможно устойчивое состояние чистого твердого вещества 2, то очевидно, что
G2oж > G2oтв .
Это соотношение выдержано на рисунке 44.
G |
|
G2°ж |
|
|
|
G1°ж |
|
G2°тв |
|
|
|
|
x2ж |
|
0 |
x2 |
1 |
Рисунок 44 – К определению состава жидкого раствора, находящегося в равновесии с чистым твердым веществом 2
Условие равновесия выполняется при проведении касательной к кривой зависимости энергии Гиббса жидкого раствора от состава из точки на оси ординат, отвечающей значению энергии Гиббса твердого вещества 2 (применение графического метода определения парциальных молярных величин). Абсцисса точки касания (x2ж) указывает состав жидкого раствора, равновесного с твердым веществом 2.
99
Используя рассмотренные частные случаи равновесий фаз, выясним возможности построения простейших диаграмм состояния бинарных систем средствами геометрической термодинамики. Мы знаем, что для нахождения линий равновесий фаз на диаграмме необходимо иметь зависимости энергии Гиббса фаз, присутствующих в системе, от температуры и состава. Допустим, что эти зависимости известны не только качественно, но определены количественно тем или иным методом. Тогда сопоставление графиков концентрационных зависимостей энергии Гиббса сосуществующих фаз при различных температурах позволит построить линии диаграммы состояния.
Построение диаграммы состояния бинарной системы А-В с простой эвтектикой и отсутствием растворимости компонентов в твердом состоянии
Рассмотрим серию графиков на рисунке 45. Они построены при значениях температуры Т1 – Т5, отмеченных на рисунке 46 горизонтальными прямыми линиями.
GA°тв |
T = T1 |
|
||
GA°ж |
|
|
GB°тв |
|
|
|
|
|
GB°ж |
|
|
|
|
|
0 |
xB |
1 |
|
T = T2 |
|
|
|
c |
0 |
xB |
1 |
T = T3 |
|
|
a |
b |
|
0 |
xB |
1 |
T = T4 |
GA°ж |
T = T5 |
ж |
|
|
|
GB° |
GA°тв
GB°тв
0 |
xB |
1 |
0 |
xB |
1 |
Рисунок 45 – Зависимости энергии Гиббса жидких растворов и смеси твердых чистых веществ А и В от концентрации при различных температурах
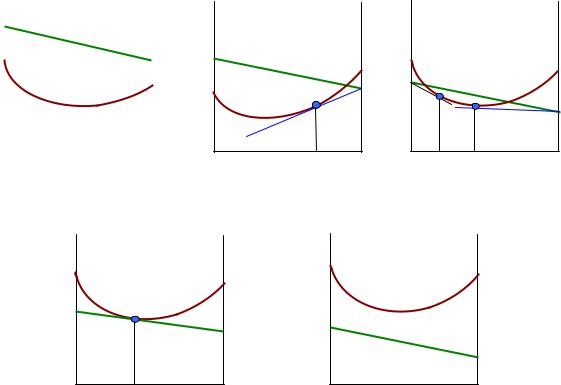
При температуре Т1 зависимость энергии Гиббса от состава для смеси твердых веществ А и В при всех составах проходит выше, чем для жидких растворов. Значит, при этой температуре жидкие растворы устойчивы во всей области изменения концентрации, а смесь твердых веществ существовать не может.
Будем понижать температуру. При этом энергия Гиббса обеих фаз должна возрасти, но в большей мере у жидкой фазы, поскольку ее энтропия больше. Поэтому можно ожидать того, что при движении вверх по энергетической оси кривая жидких растворов приблизится к прямой линии смеси твердых веществ А и В.
При температуре Т2 кривая жидких растворов со стороны вещества В поднялась так, что оказалась выше прямой линии смеси твердых фаз. Проводя касательную к зависимости
100
