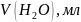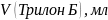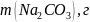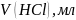- •Уп.02ведение технологических процессов производства неорганических веществ (2 н.)
- •Содержание
- •1. Безопасность труда и пожарная безопасность в химической лаборатории. Первичные средства пожаротушения. Оказание первой помощи
- •2.Классификация химической посуды по назначению. Освоение простейших приемов работы с химической посудой
- •3. Определение плотности растворов ареометром и пикнометром
- •Определение плотности растворов ареометром
- •Определение плотности растворов пикнометром
- •4. Сборка установки для титрования. Определение объема 1 капли раствора
- •5. Определение карбонатной жесткости питьевой воды
- •6. Установление молярной концентрации серной кислоты по тетраборату натрия
- •7. Определение общей жесткости питьевой воды
- •8. Определение массовой концентрации карбоната натрия в кальцинированной соде
- •9. Определение массовой концентрации NaOHи при совместном присутствии
- •10. Исследование процесса адсорбции
7. Определение общей жесткости питьевой воды
Цель работы: определить общую жесткость питьевой воды.
Оборудование и материалы: штатив, бюретка, колбы вместимостью 250 мл, пипетка вместимостью 100 мл, аммоний хлористый, аммиак, 25% водный раствор, трилон Б 0,05 Н, индикатор эриохром черный.
Технические средства обучения:калькулятор.
Ход работы:
Буферный раствор приготовили следующим образом:
5,4 г аммония хлористого растворить в 20 мл воды, добавить 35 мл 25% раствора аммиака и довести объем раствора до 100 мл.
Пипеткой на 100 мл отбирают анализируемую воду в три колбы для титрования на 250 мл, прибавить 5 мл буферного раствора, 2-3 капли раствора или смеси на кончике лопатки индикатора эриохрома черного. Оттитровать раствор при энергичном взбалтывании 0,05 Н раствором трилона Б до перехода окраски от розового до синего.
№ анализа |
|
|
Индикатор |
1 |
100 |
68,4 |
2-3 капли раствора или смеси на кончике лопатки эриохрома черного |
2 |
100 |
7,8 |
|
3 |
100 |
7,8 |
|
Среднее значение |
100 |
28 |
Содержание общей жесткости (Ж) в миллиграммах эквивалент на литр рассчитали по формуле:
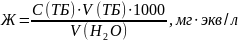

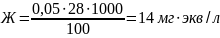 у
у
Вывод: в данной работе мы определили общую жесткость питьевой воды.
8. Определение массовой концентрации карбоната натрия в кальцинированной соде
Цель работы: определить массовую концентрацию карбоната натрия в кальцинированной соде.
Оборудование и материалы: штатив, бюретка, колбы вместимостью 250 мл, кислота соляная, натрий углекислый, метиловый оранжевый.
Технические средства обучения: калькулятор.
Ход работы:
Взвесили от 2,3 до 2,5 г кальцинированной соды, поместили в коническую колбу вместимостью 250 см3, растворили в 20см3воды и оттитровали раствором соляной кислоты в присутствии метилового оранжевого до изменения окраски раствора из желтой в розовую.
№ анализа |
|
|
Индикатор |
1 |
0,5 |
3,9 |
5-7 капель метилового оранжевого |
2 |
0,5 |
4,5 |
|
3 |
0,5 |
5 |
|
Среднее значение |
0,5 |
4,46 |
Массовую долю углекислого натрия (Х) в процентах вычислили по формуле: в данной работе
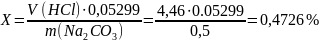
0,05299 – масса углекислого натрия в граммах, соответствующая 1см3раствора соляной кислоты 1 Н.
Вывод: в данной работе мы определили массовую концентрацию карбоната натрия в кальцинированной соде.
9. Определение массовой концентрации NaOHи при совместном присутствии
Цель работы: определить массовую концентрацию NaOH и при совместном присутствии.
Оборудование и реактивы: штатив, бюретка, пипетка, колбы вместимостью 250 мл, кислота соляная, гидроксид натрия твердый, метиловый оранжевый, фенолфталеин.
Технические средства обучения: калькулятор.
Ход работы:
Твердая щелочь и ее раствор всегда содержат примесь карбоната, если не производилась специальная очистка. При титровании раствора щелочи, содержащего карбонат, кислота реагирует как с щелочью, так и с карбонатом. Протекают следующие реакции:
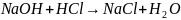
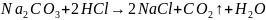
25
мл исследуемого раствора перенесли в
коническую колбу. К титруемому раствору
прибавили 3-5 капель фенолфталеина и
оттитровали 0.1 Н раствором HCl
до обесцвечивания. По достижении первой
точки эквивалентности отсчитали
количество 0,1 Н раствора кислоты,
израсходованной на нейтрализацию NaOH
и «половины»
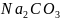 -
-
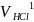 .
.
Затем
к титруемому раствору прибавили 1-2
метилового оранжевого и титруют до
конца. По окончании титрования отсчитывают
израсходованное количество кислоты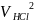 .
.
 Объем
соляной кислоты на титрование карбоната
натрия:
Объем
соляной кислоты на титрование карбоната
натрия:
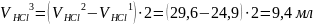
Объем соляной кислоты на титрование гидроксида натрия:
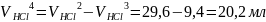
Масса гидроксида натрия и карбоната натрия:
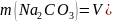
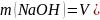
0,0053
и 0,0040 – титр раствора HCl
в пересчете на
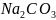 и
и
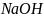 .
.
Массовая доля гидроксида натрия и карбоната натрия в растворе:
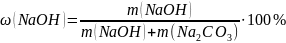
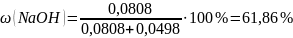
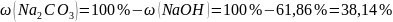
Вывод: в данной работе мы определили массовую концентрациюNaOH и при совместном присутствии.