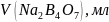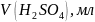- •Уп.02ведение технологических процессов производства неорганических веществ (2 н.)
- •Содержание
- •1. Безопасность труда и пожарная безопасность в химической лаборатории. Первичные средства пожаротушения. Оказание первой помощи
- •2.Классификация химической посуды по назначению. Освоение простейших приемов работы с химической посудой
- •3. Определение плотности растворов ареометром и пикнометром
- •Определение плотности растворов ареометром
- •Определение плотности растворов пикнометром
- •4. Сборка установки для титрования. Определение объема 1 капли раствора
- •5. Определение карбонатной жесткости питьевой воды
- •6. Установление молярной концентрации серной кислоты по тетраборату натрия
- •7. Определение общей жесткости питьевой воды
- •8. Определение массовой концентрации карбоната натрия в кальцинированной соде
- •9. Определение массовой концентрации NaOHи при совместном присутствии
- •10. Исследование процесса адсорбции
4. Сборка установки для титрования. Определение объема 1 капли раствора
Цель работы: собрать установку для титрования, определить объем 1 капли раствора.
Оборудование и реактивы: бюретка, стакан.
Технические средства обучения: калькулятор.
Ход работы:
Т итриметрический
анализ (титрование)
– метод количественного анализа, который
часто используется в аналитической
химии, основанный на измерении объема
раствора точно известной концентрации,
расходуемого для реакции с определяемым
веществом. Титрование – процесс
определения титра исследуемого вещества.
Титрование проводят с помощью бюретки,
заполненный титрантом до нулевой
отметки.
итриметрический
анализ (титрование)
– метод количественного анализа, который
часто используется в аналитической
химии, основанный на измерении объема
раствора точно известной концентрации,
расходуемого для реакции с определяемым
веществом. Титрование – процесс
определения титра исследуемого вещества.
Титрование проводят с помощью бюретки,
заполненный титрантом до нулевой
отметки.
Рис.4 – Установка для титрования
 1.
Бюретку заполнили дистиллированной
водой до нулевого деления.
1.
Бюретку заполнили дистиллированной
водой до нулевого деления.
2. Подставили под бюретку стакан и очень медленно (одна – раз в 2 секунды), ведя счет каплям, слили жидкость из бюретки.
3. Отсчитав 100 капель, и подождав 30 секунд, измерили объем вытекаемой воды.
4. Операцию повторили 3 раза в различных пределах шкалы бюретки.
5. Записали полученные данные.
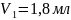
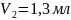
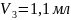
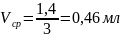
6. Объем капли данной бюретки нашли делением среднего объема вытекаемой воды на 100:
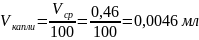
Вывод: в данной работе мы определили объем одной капли.
5. Определение карбонатной жесткости питьевой воды
Цель работы: определить карбонатную жесткость питьевой воды.
Оборудование и реактивы: штатив, бюретка; колбы вместимостью 250 мл; пипетка вместимостью 100 мл, раствор НСl с известной концентрацией, проточная вода, индикатор метиловый оранжевый.
Технические средства обучения: калькулятор.
Ход работы:
Карбонатную жесткость определяют титрованием определенного объема воды раствором НСl в присутствии метилового оранжевого.
По величине общей жёсткости различают воду мягкую (до 2 °Ж), средней жёсткости (2-10 °Ж) и жёсткую (более 10 °Ж). Жесткость питьевой воды должна быть не выше 6,4 мг-экв/л эквивалентов кальция (II) и магния (II).
Химизмпроцессавыражаетсяуравнениями:
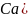
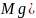
Пипеткой на 100 мл отбирают анализируемую воду в три колбы для титрования. Прибавляют 5-7 капель метилоранжа и титруют 0,1 Н раствором НСl до перехода желтой окраски в бледно-розовую.
№ анализа |
V(H2O), мл |
V(HCl),мл |
Индикатор |
1 |
100 |
0,4 |
5-7 капель метилового оранжевого |
2 |
100 |
0,2 |
|
3 |
100 |
0,3 |
|
Среднеезначение |
100 |
0,3 |
Карбонатную жесткость воды рассчитывают по формуле:
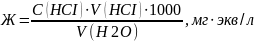

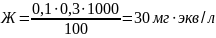
Вывод: в данной работе мы определили карбонатную жесткость водопроводной воды.
6. Установление молярной концентрации серной кислоты по тетраборату натрия
Цель работы: установить молярную концентрации серной кислоты по тетраборатунатрия.
Оборудование и реактивы: штатив, бюретка; колбы вместимостью 250 мл; пипеткавместимостью 10 мл, раствор серной кислоты, проточная вода, индикатор метиловыйоранжевый.
Технические средства обучения: калькулятор.
Ход работы:
Установление титра и нормальной концентрации кислоты при помощи тетраборатанатрия основана на реакции:
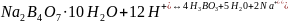
Водный раствор тетрабората натрия имеет щелочную среду. В результате титрования раствором кислоты среда становится кислой. Соответственно окраска индикатораметилоранжа изменяется от желтой до розовой.
Пипеткой отобрали 10 мл буры 0,05 Н в три колбы для титрования. Прибавили 5-7 капель метилоранжа и титровали раствором серной кислоты до перехода желтой окраски в бледно-розовую.
№ анализа |
|
|
Индикатор |
1 |
10 |
20,2 |
5-7 капель метилового оранжевого |
2 |
10 |
20,3 |
|
3 |
10 |
24,4 |
|
Среднее значение |
10 |
21,63 |
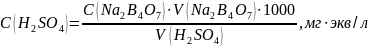
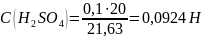
 Вывод:
в данной работе мы определили карбонатную
жесткость питьевой воды.
Вывод:
в данной работе мы определили карбонатную
жесткость питьевой воды.