
- •Уп.02 ведение технологических процессов производства неорганических веществ (2 н.)
- •Содержание
- •1. Безопасность труда и пожарная безопасность в химической лаборатории. Первичные средства пожаротушения. Оказание первой помощи
- •1. Общие требования безопасности
- •2. Требования безопасности перед началом работы
- •3. Требования безопасности во время работы
- •4. Требование безопасности в аварийных ситуациях
- •2. Классификация химической посуды по назначению. Освоение простейших приемов работы с химической посудой
- •Определение плотности растворов пикнометром
- •4.Сборка установки для титрования. Определение объема 1 капли раствора
- •5.Определение карбонатной жесткости питьевой воды
- •6.Установление молярной концентрации серной кислоты по тетраборату натрия
- •7.Определение общей жесткости питьевой воды.
- •8.Определение массовой концентрации карбоната натрия в кальцинированной соде
- •9.Определение массовой концентрации NaOh и Na2co3 при совместном присутствии
- •10.Исследование процесса адсорбции
Определение плотности растворов пикнометром
 Определение
плотности пикнометром является давним
способом определения плотности, как
жидкостей, так и твердых тел. Пикнометр
представляет собой стеклянный сосуд
определённой формы и известным
Определение
плотности пикнометром является давним
способом определения плотности, как
жидкостей, так и твердых тел. Пикнометр
представляет собой стеклянный сосуд
определённой формы и известным
Принцип действия пикнометра основан на взвешивании находящегося в нём вещества. Зная массу и объём пикнометра можно рассчитать плотность вещества по формулерm/V, где р объём пикнометра. плотность, т масса вещества (без массы пикнометра),
1. Замерили массу высушенного пикнометра:
 =20.96
=20.96
 =24.82
=24.82
2. Замерили объёмы анализируемых растворов
 =28.82
=28.82
 =30.72
=30.72
3.Определили массу пикнометров с анализируемым раствором
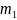 =49.76
=49.76
 =49.05
=49.05
4. Вычислили массу анализируемого раствора:
 =49.76-20.96=28.2
=49.76-20.96=28.2
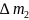 =49.05-24.82=24.55
=49.05-24.82=24.55
5. Вычислили плотность анализируемого раствора
=28.26:28.82=0.98
=24.55:30.72=0.8
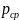 =(0.98+0.8):2=0.89
=(0.98+0.8):2=0.89
6. Определили абсолютную ошибку метода
-абсолютная погрешность , г/м (дельта)
=29.77-25=1.19
7. Определили относительную ошибку метода:

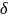 -
относительная ошибка метода, %
-
относительная ошибка метода, %
= 100%=4
100%=4
Вывод: В данной работе мы определили плотность различных веществ
4.Сборка установки для титрования. Определение объема 1 капли раствора
Цель работы: собрать установку для титрования, определить объем 1 капли раствора
Оборудование и реактивы: бюретка, стакан
Технические средства обучения: калькулятор
Ход работы:
Титриметрический анализ (титрование) — метод количественного анализа, который часто используется в аналитической химии, основанный на измерении объёма раствора реактива точно известной концентрации, расходуемого для реакции с определяемым веществом. Титрование процесс определения титра исследуемого вещества. Титрование производят с помощью бюретки, заполненной титрантом до нулевой отметки.

Рисунок.1
1. Штатив2. Бюретка 3. Резиновая трубка4. Шарик 5. Стеклянный носик 6. Колба для титрования7. Пипетка Мора
Прямое титрование — это метод, при котором титрант (реагент с известной концентрацией) добавляют непосредственно к определяемому веществу.
Обратное титрование — это метод, при котором к определяемому веществу добавляется избыток титранта-1, а затем этот избыток оттитровывается титрантом-2
1. Подготовка к титрованию:
 -
Выбор титранта: Титрант — это раствор,
который добавляется в реакционную смесь
для определения концентрации вещества.
При выборе титранта учитывается его
точность, стоимость и соответствие
методике.
-
Выбор титранта: Титрант — это раствор,
который добавляется в реакционную смесь
для определения концентрации вещества.
При выборе титранта учитывается его
точность, стоимость и соответствие
методике.
- Подготовка раствора титранта: Раствор титранта должен быть хорошо растворим в воде и не вызывать побочных реакций с анализируемым веществом.
2. Использование индикаторов:
- Индикаторы — это вещества, которые меняют свой цвет или свойства при достижении точки эквивалентности в титровой реакции. Они облегчают определение момента, когда все исследуемое вещество полностью реагировало с титрантом.
Ход работы:
=0.049
=0.054
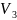 =0.055
=0.055
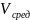 =0.527
=0.527
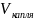 =0.527:100=0.00527
=0.527:100=0.00527
Вывод: В данной работе мы определили объём одной капли
