
- •1. Первый закон термодинамики
- •2. Тепловые эффекты химических процессов
- •3. Закон гесса и следствия из него
- •1.Тепловой эффект обратного процесса равен по величине тепловому эффекту прямого процесса, но с противоположным знаком.
- •2. Тепловой эффект кругового процесса равен нулю.
- •4. Энтропия. Второй и третий законы термодинамики
- •5. Энергия гиббса
- •Энтальпийный и энтропийный факторы и направление процесса
- •Влияние температуры на направление реакции
- •Стандартная энергия Гиббса образования.
- •6. Константа равновесия и изобарно–изотермический потенциал реакции
- •7. Термохимические измерения и вычисления
- •8. Лабораторные работы
- •8.1. Определение энтальпии реакции нейтрализации
- •8.2. Определение энтальпии реакции присоединения кристаллизационной воды к безводной соли (энтальпия гидратации)
- •8.4. Определение энтальпии образования соли
- •9. Вычисления энергии связи по тепловому эффекту
- •10. Контрольные вопросы
- •11.Тестовые задания для самопроверки по теме:
- •12. Примеры решения задач
- •13. Рекомендации для самостоятельной работы студентов
- •14.Требования к знаниям и умению
- •Сыркин Алик Михайлович
- •Редактор л.А.Маркешина
- •Тираж 600 экз. Заказ
Стандартная энергия Гиббса образования.
Под стандартной энергией Гиббса образования ΔGообр понимают изменение энергии Гиббса при реакции образования 1 моль сложного вещества, находящегося в стандартном состоянии из простых веществ. Это определение подразумевает, что стандартная энергия Гиббса образования простого вещества, устойчивого в стандартных условиях, равна нулю.
Изменение энергии Гиббса, как и изменение энтальпии и энтропии системы, не зависит от пути процесса. Поэтому для реакции вида
а А + b В + ... → с С + d D + …
изменение стандартной энергии Гиббса ΔGо равно разности между суммой стандартных энергий Гиббса образования продуктов реакции и суммой стандартных энергий Гиббса образования исходных веществ:
ΔGо=[c ∆Gо(C) + d ∆Gо(D) + …] – [a ∆Gо(A) + b ∆Gо(B) + …],
или
ΔGо = Σ∆Gообр, прод. – Σ∆Gообр, исх.
Есть случаи, когда реакция термодинамически разрешена, а самопроизвольно не идёт. Например:
2H2(г) + O2 (г) = 2H2O(ж), ΔG = – 474,38 кДж
В обычных условиях эта реакция практически не идёт. Но стоит внести в смесь подходящий катализатор (мелкодисперсную платину) или просто поднести горящую спичку, реакция произойдёт со взрывом: это гремучий газ.
Если реакция термодинамически не разрешена, условия подобрать невозможно.
6. Константа равновесия и изобарно–изотермический потенциал реакции
Константа химического равновесия зависит от природы реагентов и температуры. Она связана с изменением стандартной энергии Гиббса химической реакции ΔGо уравнением
ΔGо = –RT ln K, ΔGо298 (кДж) = –5,71 lg K298 (7)
Приведённое уравнение позволяет по величине ΔGо вычислить К, а затем и равновесные концентрации (парциальные давления) реагентов. Большим отрицательным значениям ΔGо (ΔG<<0) отвечают большие значения К (К>>1), т.е. в равновесной смеси преобладают продукты взаимодействия. При больших положительных значениях ΔGо (ΔGо>>0) в равновесной смеси преобладают исходные вещества (К<<1). Если учесть, что ΔG = ΔН – TΔS = –RT lnK, то после некоторого преобразования получим
![]()
(8)
Из этого уравнения видно, что константа равновесия очень чувствительна к изменению температуры. Для эндотермических процессов повышение температуры отвечает увеличению константы равновесия, для экзотермических – её уменьшению. От давления (если оно не очень велико) константа равновесия не зависит.
Зависимость константы равновесия от энтальпийного и энтропийного факторов свидетельствует о влиянии на нее природы реагентов.
В литературе применяются термины–синонимы: свободная энергия, свободная энергия при постоянном давлении, потенциал Гиббса, функция Гиббса, энергия Гиббса, изобарный потенциал, изобарно–изотермический потенциал.
7. Термохимические измерения и вычисления
Измерение тепловых эффектов называется калориметрией. Методика и оборудование, применяемые в калориметрии, зависят от характера изучаемого процесса. Реакции горения обычно изучают при помощи так называемой калориметрической бомбы. Реакции в калориметрической бомбе протекают при постоянном объеме.
Большинство реакций осуществляется при постоянном давлении. Измерение изменения энтальпии этих реакций осуществляется в калориметрах различных конструкций, которые представляют собой по возможности лучше изолированный от теплообмена с внешней средой сосуд с мешалкой и термометром.
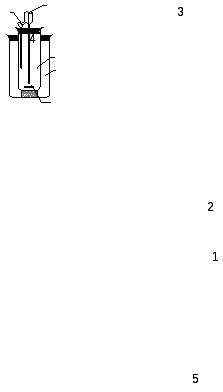
Упрощенный калориметр (рис.3) состоит из двух стаканов: наружного (1) и внутреннего, реакционного (2).
Реакционный стакан с магнитной мешалкой (5) закрывается крышкой с отверстиями: для термометра (3); для воронки (4).
Рис. 3. Устройство калориметра
Количество теплоты, выделяющейся или поглощающейся в калориметре, определяется по формуле
![]() ,
(9)
,
(9)
где tк – конечная температура;
tн– начальная температура;
сi – удельные теплоемкости калориметрического сосуда, калориметрической жидкости и исследуемого вещества;
mi – массы реакционного сосуда, жидкости и исследуемого вещества.
При использовании стеклянного реакционного сосуда теплоемкостью калориметрического сосуда можно пренебречь из-за его малой теплопроводности. Удельную теплоемкость растворов можно принять равной теплоемкости для воды: 4,2 кДж/кг град или 1 ккал/кг·град.
Тогда уравнение (10) примет следующий вид для стеклянного сосуда:
Q = (tк – tн)∙4,2·m (кДж) или
(10)
Q = (tк – tн)∙1·m (ккал),
где m –масса воды растворенного вещества.
(Масса воды или растворов находится как произведение объема жидкocти на ее плотность, т.е. m=ρ·V. Плотность воды ρ равна 1 г/мл, плотность разбавленных растворов считать равной также 1 г/мл).
Пересчет теплового эффекта на 1 моль вещества, т.е. нахождение величины ∆H, производится по формуле
![]()
, (11)
где n – число молей вещества.
Все работы по определению изменения энтальпии химических процессов необходимо проводить в следующей последовательности.
1. Поместить в реакционный сосуд измеренный мензуркой объем воды или раствора и дождаться выравнивания температуры калориметра и окружающей среды. Для этого, выждав 3–5 мин, записывать показания термометра в течение трех минут с интервалом в 1 мин. Если температура практически не меняется, принять ее за величину tн.
2. Быстро внести через сухую воронку взвешенное на весах или измеренное цилиндром количество реагирующего вещества и, непрерывно перемешивая раствор мешалкой, производить замеры температуры через 0,5–
1 мин.
Результаты наблюдений записывать в виде таблицы:
|
Время от начала опыта, мин |
0 |
0,5 |
1,0 |
1,5 |
2,0 |
2,5 |
3,0 |
3,5 |
4,0 |
5,0 |
6,0 |
|
Температура, °С |
|
|
|
|
|
|
|
|
|
|
|
3. Построить график изменения температуры во времени на миллиметровой бумаге, отложив на оси ординат температуру, а на оси абсцисс – время в минутах. На рис.4 приведен примерный вид этого графика.
4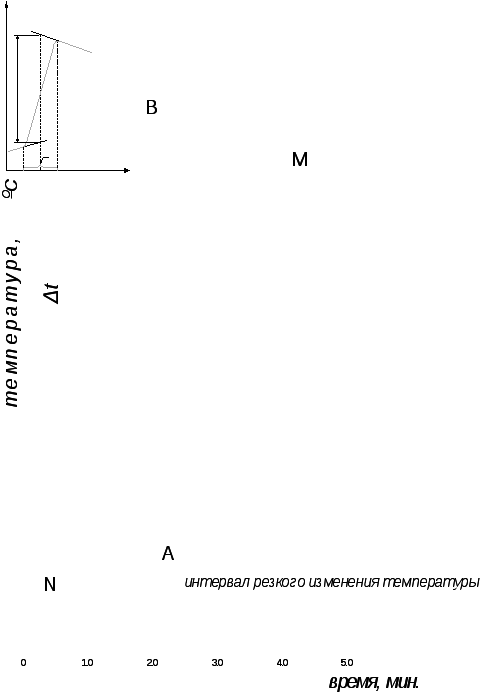 .
С помощью полученного графика найти
изменение температуры в ходе опыта, ∆t
= tк
– tн.
Для этого произвести экстраполяцию
плавного линейного хода температуры
конечного и исходного периодов времени
(если температура в начале опыта не
менялась, то прямая этого участка
зависимости будет параллельна оси
абсцисс).
.
С помощью полученного графика найти
изменение температуры в ходе опыта, ∆t
= tк
– tн.
Для этого произвести экстраполяцию
плавного линейного хода температуры
конечного и исходного периодов времени
(если температура в начале опыта не
менялась, то прямая этого участка
зависимости будет параллельна оси
абсцисс).
Отрезок времени, за который наблюдалось резкое изменение температуры, разделить пополам, из полученной точки восстановить перпендикуляр до пересечения с экстраполированными прямыми BM и NA.
Величина отрезка перпендикуляра АВ, отсекаемого этими прямыми, соответствует изменению температуры
∆t = tк – tн.
Рис. 4. Зависимость температуры
от времени
Используя описанные выше рекомендации, произведите измерение изменения температуры и вычислите значение энтальпии для некоторых процессов.
