
- •Сборник заданий
- •Задание №1 по теме "строение вещества"
- •Варианты домашнего задания по теме «Строение вещества»
- •1.Задание по теме «строение атома»
- •ЗаданиЯ по теме «ковалентная химическая связь и строение молекулярных частиц»
- •2.1.Опишите строение предложенных в варианте задания молекул и молекулярных ионов по методу валентных связей (мвс):
- •Задания по теме «межмолекулярные взаимодействия и свойства веществ»
- •3.1. Проанализируйте влияние сил межмолекулярного взаимодействия на свойства веществ (решите задачу с указанным номером).
- •Типы межмолекулярного взаимодействия
- •Список рекомендуемой литературы
- •Задание №2 по теме: «термохимия. Направление химических реакций»
- •Примеры решения задач
- •2. Рекомендации для самостоятельной работы студентов и варианты заданий
- •3. Задачи для самостоятельного решения
- •4. Варианты заданий
- •Задание №3 по теме «химическая кинетика и равновесие»
- •Примеры решения задач
- •1.3. Вычисление константы химического равновесия
- •1.4. Вычисление равновесных концентраций
- •1.5. Направление смещения равновесия
- •Задачи для самостоятельного решения
- •Варианты заданий
- •Список рекомендуемой литературы
- •Задание № 4 по теме «Растворы»
- •Примеры решения задач
- •1.1. Процентная концентрация
- •1.3. Моляльная концентрация (моляльность) , мольная доля, титр
- •1.4. Осмотическое давление. Закон вант- гоффа
- •1.5. Давление насыщенного пара растворов. Тонометрический закон рауля
- •1.6. Температуры кипения и замерзания растворов.
- •2. Задачи для самостоятельного решения
- •3. Варианты заданий
- •Список рекомендуемой литературы
- •Задание №5 по теме: "растворы электролитов"
- •Примеры решения задач
- •1.1. Вычисление степени диссоциации слабых электролитов
- •1.3. Произведение растворимости
- •1.5. Обменные реакции в растворах электролитов
- •Варианты заданий
- •Список рекомендуемой литературы
- •Задание №6 по теме «гидролиз солей»
- •Примеры решения задач
- •Варианты заданий
- •Список рекомендуемой литературы
- •Задание № 7 по теме «Окислительно–восстановительные реакции. Электрохимия»
- •Примеры решения задач
- •2. Задания для самостоятельного решения
- •Список рекомендуемой литературы
- •Задание № 8 по теме «Классификация и свойства неорганических веществ»
- •Примеры решения задач
- •Пример 5. С какими из перечисленных веществ вступит в реакцию серная кислота: koh, CuO, Ba(oh)2, Fe2o3, Al2o3, co2, SiO2, h3po4, o2, h2o? Составьте уравнения возможных реакций.
- •Задания для самостоятельного решения
- •Варианты заданий
- •Список рекомендуемой литературы
- •Примеры решения задач
- •Задачи для самостоятельного решения
- •3.Варианты заданий
- •Задание № 10 по теме «Дисперсные системы»
- •Пример решения задачи
- •Варианты заданий
- •Список РекомендуемОй литературЫ
- •Сборник заданий для самостоятельной работы студентов по дисциплине «химия
- •450062, Республика Башкортостан, г.Уфа, ул. Космонавтов,1
1.5. Давление насыщенного пара растворов. Тонометрический закон рауля
Пример 1. а) Вычислите давление пара над раствором, содержащим 34,23 г сахара C12H22O11 в 45,05 г воды при 65 ºС, если давление паров воды при этой температуре равно 2,5·104 Па.
Решение:
Давление пара над раствором нелетучего вещества в растворителе всегда ниже давления пара над чистым растворителем при той же температуре. Относительное понижение давления пара растворителя над раствором согласно закону Рауля выражается соотношением
![]()
где p0 – давление пара над чистым растворителем;
p – давление пара растворителя над раствором;
n – количество растворенного вещества, моль;
N – количество растворителя, моль;
M (C12H22O11) = 342,30 г/моль;
M (H2O) = 18,02 г/моль.
Количество растворенного вещества и растворителя: n=34,23/342,30=0,1 моль; N = 45,05/18,02= 2,5моль.
Давление пара над раствором:
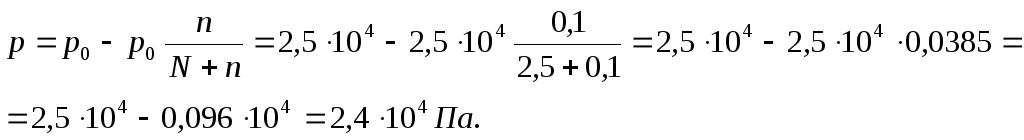
Пример 2. Рассчитайте молекулярную массу неэлектролита, если 28,5 г этого вещества, растворенного в 785 г воды, вызывают понижение давления пара воды над раствором на 52,37 Па при 40°С. Давление водяного пара при этой температуре равно 7375,9 Па.
Решение:
Относительное понижение давления пара растворителя над раствором равно
![]()
Находим:
![]()
![]() здесьmx
–
масса неэлектролита, молярная масса
которого Mx
г/моль.
здесьmx
–
масса неэлектролита, молярная масса
которого Mx
г/моль.
![]() 0,309Mx
+
0,202=28,5;
0,309Mx
+
0,202=28,5;
0,309Mx =28,298;
Mx=91,58 г/моль.
Молекулярная масса неэлектролита равна ~ 92.
1.6. Температуры кипения и замерзания растворов.
ЭБУЛЛИОСКОПИЧЕСКИЙ И КРИОСКОПИЧЕСКИЙ ЗАКОНЫ РАУЛЯ
Пример 1. Определите температуру кипения и замерзания раствора, содержащего 1 г нитробензола C6H5NO2 в 10 г бензола. Эбулиоскопическая и криоскопическая константы равны 2,57 и 5,1 °С. Температура кипения чистого бензола 80,2 °С, температура замерзания –5,4°С.
Решение:
По закону Рауля:
![]()
![]()
где ∆tзам и ∆tкип – соответственно понижение температуры замерзания и повышение температуры кипения раствора; Кк и Кэ – соответственно криоскопическая и эбуллиоскопическая константы растворителя; g- масса растворенного вещества, г; G- масса растворителя, г; Мr- молекулярная масса растворенного вещества; Mr(С6H5NO2)= 123,11.
Повышение температуры кипения раствора нитробензола в бензоле:
![]()
Температура кипения раствора: tкип=80,2+2,09=82,29 °C.
Понижение температуры замерзания раствора нитробензола в бензоле:
![]()
Температура замерзания раствора tзам= 5,4 – 4,14 =1,26 °C.
Пример 2. Раствор камфоры массой 0,522 г в 17 г эфира кипит при температуре на 0,461ºС выше, чем чистый эфир. Эбуллиоскопическая константа эфира 2,16 ºС. Определите молекулярную массу камфоры.
Решение:
Молекулярную массу камфоры определяем, пользуясь соотношением
Mr=![]()
Молекулярная масса камфоры равна 155,14.
2. Задачи для самостоятельного решения
Выразить в граммах на 100 г воды концентрацию 26,5%-ного раствора хлористого натрия.
Ответ: 36,05 г.
Смешали 800 кг 30%-ного раствора Н2S04 с 200 кг 20%-ного раствора НNO3. Вычислите процентную концентрацию серной и азотной кислот в смеси.
Ответ: 4% HNO3; 24% Н2S04.
Сколько миллилитров воды необходимо добавить к 100 мл 60%-ного раствора H3PO4 (плотность 1,43 г/мл), чтобы получить 40%-ный раствор?
Ответ: 75,1 г.
Сколько воды необходимо прибавить к 200 мл 10%-ного раствора NaOH (плотность 1,1 г/мл), чтобы получить 5%-ный раствор?
Ответ: 220 г.
Сколько литров HF ( при н.у.) нужно растворить в 1 л воды для получения 2,44%-ного раствора фтористоводородной кислоты?
Ответ: 28 л.
Какой объем 15%-ного раствора NаОН (плотность 1,16 г/мл) можно приготовить из 2 л его 33%-ного раствора (плотность 1,36)?
Ответ: 5,16 л.
Какой объем воды и 20%-ного раствора NH3 (плотность 0,92 г/мл) нужно взять для приготовления 500 мл 5%-ного раствора NH3 (плотность 0,98 г/мл)?
Ответ: 133,1 мл NH3; 367,5 мл Н2О.
В каком массовом соотношении нужно смешать воду и 30%-ный раствор НСl, чтобы получить 10%-ный раствор?
Ответ: 2:1.
Какие объемы 40%-ного раствора HNO3 (плотность 1,25 г/мл) и 10%-ного раствора этой же кислоты (плотность 1,06 г/мл) необходимо взять для приготовления 2 л 15%-ного раствора (плотность 1,08 г/мл)?
Ответ: 0,228 л 40%-ного и 1,698 л 10%-ного раствора.
В каком количестве воды нужно растворить 6,02∙1024 молекул SO3, чтобы получить 10%-ный раствор Н2S04?
Ответ: 9000 г или 9 л.
Какой объем 10%-ного раствора Н2S04 (плотность 1,07г/мл) нужно добавить к 300 мл 50%-ного раствора этой кислоты (плотность 1,4 г/мл), чтобы получить 30%-ный раствор? Ответ: 392,5 л.
В каком количестве 5%-ного раствора глюкозы следует растворить 120 г чистой глюкозы, чтобы получить 8%-ный раствор?
Ответ: 3680 г.
Определите массовую долю (в %) нитрата кальция в растворе, полученном при смешивании 300 г 10%-ного раствора и 500 г 20%-ного раствора нитрата кальция. Ответ:16,25%.
К 300 л 40%-ного раствора азотной кислоты (плотность 1,25 г/мл) прилили 125 мл воды. Определите процентную концентрацию азотной кислоты в полученном растворе. Ответ:30 %.
Массовая доля НCl в растворе 36,5% (плотность1,185 г/мл). Сколько литров газообразного НСl (н.у.) поглощает 1 л воды при образовании раствора указанной концентрации?
300 г раствора НСl нейтрализованы раствором NаОН. Масса образовавшегося NаСl оказалась равной 117 г. Определите процентную концентрацию исходного раствора НС1.
Какой объем 20%-ного раствора Н2504 (плотность 1,14 г/мл) требуется для полного растворения 12 г магния?
Сколько воды нужно прибавить к 25 мл 40%-ного раствора КОН (плотность 1,41 г/мл), чтобы получить 2%-ный раствор?
Ответ: 670мл.
К 1 л 20%-ного раствора NaОН (плотность 1,225 г/мл) прибавили 10 л воды. Вычислить процентную концентрацию полученного раствора.
Ответ: 2,18 %.
К 500 мл раствора НСl (плотность 1,1 г/мл) прибавили 2,5 л воды, после чего раствор стал 4%-ным. Вычислить процентную концентрацию исходного раствора.
Ответ: 22,2%.
Из 2 л 40%-ного раствора КОН (плотность 1,411 г/мл) нужно приготовить 10%-ный раствор КОН (плотность 1,082 г/мл). Сколько воды надо прибавить к имеющемуся раствору?
Ответ: 8 л.
Сколько граммов чистого КСl и воды надо взять для приготовления 1 кг раствора, содержащего 5% калия?
Смешаны 300 г 40%-ного раствора Н2S04 и 700 г 10%-ного раствора той же кислоты. Вычислить процентное содержание Н2S04 в полученном растворе.
Ответ: 19%.
Сколько граммов 32%-ного раствора HNO3 следует добавить к 600 г 80%-ного раствора той же кислоты для получения 64%-ного раствора?
Ответ: 300 г.
Сколько граммов КОН требуется для нейтрализации 280 г 7%-ного раствора Н2SО4?
Ответ: 22,4 л.
Сколько миллилитров 8%-ного раствора NaОН (плотность 1,09 г/мл) требуется для нейтрализации 75 мл раствора Н2S04, если известно, что из 10 мл раствора Н2S04 можно получить 0,2334 г ВаS04?
Ответ: 6,88 мл.
Сколько граммов 4%-ного раствора ВаС12 следует прибавить к раствору Н2S04. для получения 11,65 г ВаS04?
Ответ: 260 г.
К 250 г 12%-ного раствора АgNO3 прибавили 300 г 4%-ного раствора NаС1. Вычислить массу образовавшегося АgС1. Какое вещество и в каком количестве не войдет в реакцию?
Ответ: 25,3 г; 1,68 г.
Сколько граммов 6%-ного раствора NaОН потребуется для разложения 60 г технического хлорида аммония, содержащего 5% примесей?
Ответ: 710 г.
Определить количества 10%-ного и 50%-ного растворов КОН, необходимых для приготовления 800 г 25%-ного раствора.
Ответ: 500 г 10%-ного и 300г 50%-ного растворов.
Определить молярную и эквивалентную концентрацию 40%-ного раствора HNO3 (плотность 1,25 г/мл).
Какой объем 37%-ного раствора НС1 (плотность 1,19 г/мл) потребуется для приготовления 1,5 л 0,2М раствора?
Сколько граммов НС1 содержится в 250 мл 1М раствора этого вещества? Ответ: 9,1 г.
В каком объеме 1М раствора серной кислоты содержится 4,9 г Н2SО4? Ответ: 50 мл.
200 мл раствора гидроксида калия содержат 5,6 г КОН. Чему равна молярность этого раствора?
Образец технического гидроксида натрия содержит 92% NаОН. Сколько граммов этого образца необходимо взять для приготовления 10 л 2М раствора NаОН?
Ответ: 870 г.
Имеется 80%-ный раствор серной кислоты. Как из этого раствора приготовить 2 л 6М раствора Н2SО4?
Ответ: 850 мл Н2S04 и 1150 мл Н2О.
Чему равна молярность концентрированной соляной кислоты (плотность 1,19 г/мл), содержащей 35% по массе НCl?
Ответ: 12,4М.
3,5 г технического гидроксида калия растворили в воде и получили 500 мл 0,1М раствора КОН. Каково процентное содержание КОН в образце? Ответ: 80%.
Концентрация метана в смеси 3,2 г/л. Чему равна концентрация СН4 в моль/л? Ответ: 0,2 моль/л.
Сколько миллилитров 40%-ного раствора Н3РО4 (плотность 1,25 г/мл) требуется для приготовления 400 мл 0,25М раствора Н3РO4?
Ответ: 19,6 мл.
Вычислите молярную концентрацию раствора К2SO4, в 0,02 л которого содержится 2,74 г растворенного вещества.
Ответ: 0,73М.
Смешали 2 л 0,6М раствора вещества А с 3 л 1,0М раствора В. Определите концентрацию каждого из этих веществ в полученном растворе.
Ответ: СА=0,24 и СB=0,60 моль/л.
Растворы одного и того же вещества 1М, 2М и 0,2М смешаны в объемных соотношениях 1:2:7. Определите молярную концентрацию полученного раствора. Ответ: 0,64 моль/л.
Определите эквивалентную концентрацию раствора азотной кислоты, если 500 мл его полностью нейтрализуют раствор, содержащий 4 г КОН.
Ответ: 0,14 мольэкв./л.
Какой объем 20%-ного раствора Н2SO4 (плотность 1,14 г/мл) требуется для полного растворения 12 г магния?
Ответ: 215 мл.
200 мл раствора серной кислоты нейтрализуют 250 мл 1н. раствора щелочи. Выразите концентрацию серной кислоты в граммах на литр раствора.
Ответ: 61,25 г.
Сколько миллилитров 0,5н раствора НСl потребуется для осаждения серебра, содержащегося в 500 мл 0,2н раствора АgNO3?
Ответ: 200 мл.
Технический продукт содержит 90% гидроксида натрия. Сколько граммов технической щелочи потребуется для приготовления 5 л 0,1М раствора гидроксида натрия?
Ответ: 22,2.
Определите массовую долю (в %) Н2SO4 в 5М растворе (плотность 1,29 г/мл) и массовую долю NаОН в Зн растворе (плотность 1,12 г/мл).
Какой объем сероводорода при н.у. потребуется для осаждения меди в виде сульфида из 2 л 0,25н раствора сульфата меди?
Ответ: 11,2 л.
Для полной нейтрализации 1 г некоторой двухосновной кислоты потребовалось 111,1 мл 0,2н. NаОН. Найти молекулярную массу кислоты. Ответ: 90.
Какой объем 35%-ного раствора Н3РО4 (плотность 1,216 г/мл) требуется для приготовления 13 л 0,15н Н3РO4?
Ответ: 0,142 л.
Сколько литров 5н. NаОН можно приготовить из 4 л 50%-ного раствора NаОН (плотность 1,525 г/мл)?
Ответ: 15,25 л.
Какой объем 96%-ной Н2SO4 (плотность 1,825 г/мл) необходимо взять для приготовления 5 л 0,5М Н2SO4?
Ответ: 0,14л.
Смешаны 0,8 л 1,5н. NаОН и 0,4 л 0,6н NаОН. Какова нормальность полученного раствора?
Ответ: 1,2н.
Сколько литров 30%-ного раствора НС1 (плотность 1,149 г/мл) следует добавить к 5 л 0,5н. НС1 для получения 1н раствора? Ответ: 0,3 л.
Какой объем 0,25н. Н2SО4 можно нейтрализовать прибавлением 0,6 л 0,15н. Са(ОН)2?
Ответ: 0,36 л.
Какой объем 4%-ного раствора НС1 (плотность 1,018 г/мл) необходимо прибавить к 0,5 л 0,02н. АgNO3 для полного осаждения ионов серебра в виде АgС1? Ответ: 0,009 л.
Сколько 0,2н КОН требуется, чтобы, осадить в виде Fе(ОН)3 все железо, содержащееся в 0,028 л 1,4н FеС13? Ответ: 0, 196л.
Каким объемом 4н. Н2SO4 можно полностью разложить 0,65 л 20%-ного раствора К2СO3 (плотность 1,189 г/мл)? Какой объем займет выделившийся при этом газ при н.у.?
Ответ: 0,559 л; 25,05 л.
Какова была масса А1(OН)3, если для его растворения потребовалось 0,2 л 30%-ного раствора HNO3 (плотность 1,180 г/мл)? Какой объем 2,5н КОН необходимо взять для полного растворения этого количества А1(ОН)3? Ответ: 29,21 г; 0,15 л.
Рассчитайте объем SO2 (приведенный к н.у.), который можно получить при действии на раствор К2SO3 0,05 л 0,85н. Н2S04.
Ответ: 0,475 л.
Какую долю моля NаСN следут растворить в 100 г воды для получения 5%-ного раствора?
Ответ: 0,1074.
В каком количестве молей воды следует растворить 50 г Н2SO4 для получения 10%-ного раствора?
Ответ: 25.
Сколько граммов Nа2SO4 ∙ 10H2O следует растворить в 250 г воды для получения раствора, содержащего 5% безводной соли?
Ответ: 32 г.
Какую часть моля Nа2НРO4 · 2Н2O следует растворить в 1 кг воды для получения раствора, содержащего 4% безводной соли? Ответ: 0,2965.
Сколько молей МnSO4 ∙ 5Н2O следует прибавить к 100 молям воды для получения раствора, содержащего 20% безводной соли?
Ответ: 3,504 моля.
Вычислить процентное содержание безводной соли в растворе, полученном растворением 0,01 моль А12(SO4)3∙18Н20 в 1 моле воды.
Ответ: 13,86%.
Сколько молей воды следует добавить к 1,6 кг 25%-ного раствора NаОН для получения 16%-ного раствора?
Ответ: 50 молей.
Из 750 кг 48%-ного раствора Н2SO4 выпарили 300 кг воды. Определить процентное содержание Н2SO4 в полученном растворе.
Ответ: 80%.
Каково соотношение между числом молей растворенного вещества и растворителя в 5%-ном растворе щавелевой кислоты?
Ответ: 1:95.
В каком объеме 25%-ного раствора уксусной кислоты СН3СООН (плотность 1,035 г/мл) содержится 1 моль этой кислоты?
Ответ: 232 мл.
Какая часть моля СаСО3 способна прореагировать с 179 мл 4%-ного раствора НС1 (плотность 1,02 г/мл)?
Ответ: 0,1 моля.
Какая часть моля алюминия способна прореагировать с 86 мл 12%-ного раствора НС1 (плотность 1,06 г/мл)?
Ответ: 0,1 моля.
Какой объем 4н НС1 требуется для нейтрализации 10 г NаОН?
Ответ: 62,5 мл.
Какой объем 3н Н2S04 требуется для нейтрализации 8,415 г КОН?
Ответ: 50 мл.
Сколько миллилитров 0,4н. НС1 следует прибавить к раствору АgNО3 для получения 0,2866 г АgС1? Ответ: 5 мл.
Сколько граммов 5%-ного раствора АgNO3 требуется для обменной реакции со 120 мл 0,6н. раствора А1С13?
Ответ: 244,7 г.
Сколько литров 0,03н. раствора Н3РО4 способно прореагировать с 250 г 4%-ного раствора NаОН с образованием дигидроортофосфата натрия?
Ответ: 25 л.
Какой объем 0,1н. раствора Са(ОН)2 следует прибавить к 162 г 5%-ного раствора Са(НСО3)2 для образования карбоната кальция?
Ответ: 1 л.
Каким объемом 8н. Н2SO4 можно полностью перевести в сульфат 2,65 л 18%-ного раствора Nа2СО3 (плотность 1,2 г/мл)? Какой объем займет выделившийся при этом газ при н.у.?
Ответ: 1,35 л; 121 л.
Сколько миллилитров 6%-ного раствора НС1 (плотность 1,03 г/мл) следует прибавить к 400 мл 0,05н. АgNO3 для полного осаждения АgС1? Ответ: 11,8 мл.
Какой объем 4н. раствора КОН требуется для взаимодействия при нагревании с 1,6 л насыщенного раствора (NH4)2SO4, содержащего 43% соли (плотность 1,25 г/мл)? Какой объем займет выделившийся при этом аммиак при н.у.?
Ответ: 3,25 л; 292 л.
До какого объема следует разбавить водой 2,4 л 1,6н НС1 для получения 0,25н. раствора?
Ответ: 15,36 л.
До какого объема следует упарить 3,5 л 0,04н. КОН для получения 0,1н раствора?
Ответ: 1,4 л.
Смешаны 800 мл Зн КОН и 1,2 л 12%-ного раствора КОН (плотность 1,1 г/мл). Вычислить нормальность полученного раствора.
Ответ: 2,61н.
Смешаны 3 л 0,1М Н3РО4 с 2 л 9%-ного раствора той же кислоты (плотность 1,05 г/мл). Вычислить нормальность полученного раствора. О
Ответ: 1,337н
Сколько миллилитров 20%-ного раствора НС1 (плотность 1,1 г/мл) следует добавить к 4л 0,6н. НС1 для получения 1н раствора?
Ответ: 318 мл.
Сколько миллилитров 0,01н. AgNO3 потребуется для реакции обмена с 1 мл 10%-ного раствора НВr (плотность 1,073 г/мл)?
Ответ: 132,6 мл.
Плотность раствора серной кислоты, в 1 л которого содержится 577 г Н2SO4,равна 1,335 г/мл. Вычислить процентную концентрацию раствора, а также его нормальность, молярность, моляльность и мольные доли Н2SО4 и Н2O.
Ответ: 43,22%; 11,76н.; 5,88М; 7,76 моль/кг; 0,123; 0,877.
Определите нормальность, моляльность, процентную концентрацию и титр 0,8М Fe2(SO4)3, если плотность раствора равна 1 г/мл.
Ответ: 4,8н.; 1,18 моль/кг; 32%; 0,3199 г/мл.
Вычислить процентную концентрацию и моляльность 8н HNO3, плотность которой равна 1,246 г/мл. Каковы мольные доли HNO3 и Н2О в этом растворе? Ответ: 40,5%;10,8 моль/кг; 0,162; 0,838.
Вычислите грамм-эквивалент двухосновной кислоты, 37%-ный раствор которой 12,5н и имеет плотность 1,664 г/мл. Какая это кислота? Чему равны молярная, моляльная концентрации и титр раствора этой кислоты?
Ответ: 49,2 г; 6,25М; 5,94 моль/кг; 0,6156 г/мл.
B 1кг воды растворено 666 г КОН, плотность раствора равна 1,395 г/мл. Найти: массовую долю; молярность; моляльность раствора; мольные доли щелочи и воды. Ответ: 40%; 9,95 моль/л; 11,9 моль/кг; 0,176 и 0,824;
Плотность 15%-ного (по массе) раствора H2SO4 равна 1,105 г/мл. Вычислить: нормальность, молярность, моляльность раствора.
Ответ: 3,38н.; 1,69 моль/л; 1,80 моль/кг.
Плотность 9%-ного (по массе) раствора сахарозы C12H22O11 равна 1,035 г/мл. Вычислить концентрацию сахарозы в г/л; молярность; моляльность раствора.
Ответ: 93,2 г/л; 0,27 моль/л; 0,29 моль/кг.
Найти массу воды, необходимую для приготовления 1,5 моляльного раствора хлорида натрия, если имеется 10 г NaCl.
Ответ: 144г.
Титр раствора серной кислоты 0,0245 г/мл. Определить молярную концентрацию раствора.
Ответ: 0,25М.
Имеется 0,25н. раствор гидроксида натрия. Определить его титр.
Ответ: 0,01г/мл.
Рассчитать титр 0,15н. раствора: а) азотной кислоты; б) фосфорной кислоты; в) соляной кислоты.
Ответ: а) 0,0095 г/мл; б) 0,0049 г/мл; в) 0, 0055 г/мл
Вычислите молярность, нормальность и моляльность раствора 20%-ной Н2SO4 плотностью 1,14 г/см3.
Ответ: 2,3 моль /л; 4,6н.; 2,55 моль/кг.
Вычислить молярность и нормальность раствора КI, титр которого равен 0,0017 г/мл.
Ответ: 0,01М; 0,01н.
До какого объема нужно довести раствор при растворении 8,1 г FеС13, чтобы получить 0,1н. раствор? Каков титр раствора?
Ответ: 1,5 л; 0,0054 г/мл.
Чему равна моляльность раствора, приготовленного растворением 9 г глюкозы С6Н12О6 в 500 мл воды?
Ответ: 0,1 моль /кг.
Сколько граммов сахарозы C12H22O11 необходимо взять для приготовления 200 г раствора, моляльность которого равна 0,05 моль/кг?
Ответ: 3,36 г.
Вычислите моляльность и массовую долю раствора (плотность 1,107 г/мл), содержащего 50 г СuSO4 в 450 мл воды.
Ответ: 0,694 моль/кг; 10%.
Опишите, как приготовить 1 л 1%-ного, одномолярного и однoнормального раствора серной кислоты.
Чему равен титр растворов: а) 0,1н. НС1; б) 1н. КОН; в) 0,5н. HNO3? Выразить титры в г/мл и в мг/мл.
Вычислите титр растворов: а) 0,1н. Н2SO4; б) 0,02н. Н3РO4; в) 0,02н. NаОН; г) 0,004н. Са(ОН)2. Выразите титры в г/мл и в мг/мл.
Титр раствора, серной кислоты равен 0,0049 г/мл. Какова нормальность раствора?
Титр раствора NаОН равен 2 мг/мл. Какова нормальность раствора?
На нейтрализацию 20 мл 1н. раствора гидроксида натрия пошло 20 мл раствора серной кислоты. Чему равны нормальность и титр раствора кислоты?
На нейтрализацию 40 мл 0,1н. раствора азотной кислоты пошло 4 мл раствора гидроксида натрия. Чему равны нормальность и титр раствора щелочи?
На нейтрализацию 60 мл 0,25н. Н2SO4 пошло 180 мл раствора КОН. Чему равны нормальность и титр раствора КОН?
Ответ: 0,083л.; 4,66 мг/мл.
Вычислить нормальность, моляльность, мольную долю и титр 50%-ного раствора гидроксида натрия.
Вычислите титры (в мг/мл) растворов а) 30%-ного КОН; б) 10%-ного НС1; в) 4%-ного NаОН. Определите нормальность этих растворов.
Вычислите моляльность и мольную долю растворов, приведенных в задаче №3.27.
Смешали 2 л 10%-ного и 4 л 24%-ного раствора азотной кислоты. Чему равна процентная концентрация, моляльность и мольная доля полученного раствора?
Из 10 кг 20% - ного раствора NаС1 при охлаждении выделилось 400 г соли. Чему равна процентная концентрация, моляльность и мольные доли NаС1 и Н2О охлажденного раствора?
Вычислите осмотическое давление раствора, содержащего 90,08 г глюкозы С6H12O6 в 4 л раствора при 27°С.
Ответ: 3,12∙105 Па.
Найдите осмотическое давление при 0 °С для раствора, содержащего в 1 л 18,4 г глицерина С3Н8О3. Ответ: 4,54∙105 Па.
Рассчитайте осмотическое давление раствора неэлектролита, содержащего 1,52∙1023 молекул его в 0,5 л раствора при 0 и при 30°С.
Ответ: 11,35∙105 Па; 12,60∙105 Па.
В 1 л раствора при 25 °С содержится 6,84 г сахара C12H22O11 и 1/38 г этилового спирта С2Н5ОН. Каково осмотическое давление раствора? Ответ:12,39∙104Па.
При 0 °С осмотическое давление раствора сахара C12H22O11 равно 3,55∙105 Па. Сколько граммов сахара содержится в 1 л раствора?
Ответ: 53,53 г.
Осмотическое давление раствора, содержащего в 1л 3,2 г неэлектролита, равно 2,42∙105 Па при 20°С. Вычислите молекулярную массу неэлектролита.
Ответ: 32,2.
В 0,5 л раствора содержится 2 г неэлектролита и раствор при 0°С имеет осмотическое давление, равное 0,51∙105 Па. Какова молекулярная масса неэлектролита? Ответ: 178.
Найдите формулу вещества (маннита), содержащего 39,56% углерода, 7,69% водорода и 52,75% кислорода, если осмотическое давление раствора, содержащего в 1 л 72 г маннита, равно 9,00∙105 Па при 0°С. Ответ: С6H14O6.
Раствор анилина С6H5NH2 имеет такое же осмотическое давление, что и раствор, содержащий 3,2 г СН3ОН в 1 л воды при 18°С. Сколько граммов анилина содержится в 1 л раствора? Ответ: 9,30 г.
При какой температуре осмотическое давление раствора, содержащего в 1 л 45 г глюкозы С6Н12О6, достигнет 607,8 кПа? Ответ: 19,50С.
Вычислить осмотическое давление 25%-ного раствора сахара С12H22O11 при 15°С (плотность 1,105 г/мл). Ответ: 1935кПа.
Сколько граммов глюкозы С6H12О6 содержится в 200 мл раствора, осмотическое давление которого при 37°C составляет 810,4 кПа? Ответ: 11,3 г.
Осмотическое давление раствора, в 250 мл которого содержится 0,66 мочевины, равно 111,1 кПа при 33°С. Вычислите молекулярную массу мочевины. Ответ: 60,3.
Сколько молекул растворенного вещества содержится в 1 мл раствора, осмотическое давление которого при 54°С составляет 6065 Па?
Ответ: 1,34∙ 1018.
1 мм3 раствора содержит 1015 молекул растворенного вещества. Вычислить осмотическое давление раствора при 0°С. В каком объеме раствора содержится 1 моль растворенного вещества?
Ответ: 3772 Па; 602 л.
Из 342 г сахара С12Н22O11 и воды приготовлено 22,4 л раствора. Чему равно осмотическое давление при 0°С?
Вычислите осмотическое давление 5%-ного раствора ацетона (СН3)2СO в воде при 0°С. Плотность раствора 0,90 г/мл.
Ответ: 19 атм.
Вычислить осмотическое давление раствора при 17°С, если 1 л его содержит 18,4 г глицерина С3Н8O3.
Ответ: 4, 76 атм.
Опытным путем найдено, что осмотическое давление раствора, содержащего 5 г гемоглобина (белковое вещество крови) на 100 мл раствора, при 27°С равно 13,65 мм рт.ст. Вычислить молекулярную массу гемоглобина.
Ответ: ~68500.
В 7 л раствора содержится 24,4 г неэлектролита. Осмотическое давление раствора при 0°С равно 1,3 атм. Вычислить молекулярную массу неэлектролита. Ответ: 60.
Раствор сахара С12H12О11 при 0°С имеет осмотическое давление, равное 144 мм рт.ст. Сколько граммов сахара содержится в 1 л такого раствора?
Ответ: 2,3 г.
Осмотическое давление раствора глюкозы С6Н12O6 при 0°С равно 4,48 атм. Какова молярность такого раствора? Сколько граммов глюкозы содержит 1 л этого раствора?
Ответ: 0,2 моль/л; 36г.
40 мл раствора, содержащего 0,2 г растворенного вещества, при 27,3°С обнаруживают осмотическое давление, равное 1,2 атм. Вычислить молекулярную массу растворенного вещества.
Ответ: 102,75.
Выразить в мм рт.ст. осмотическое давление раствора при 0°С, содержащего 6,02∙1017 молекул растворенного вещества в 1 мл раствора.
Ответ: 680 мм рт.ст.
Выразить в мм рт.ст. осмотическое давление раствора при 10°С, содержащего 0,736 г глицерина С3Н803 в 400 мл раствора.
Ответ: 553 мм рт.ст.
Вычислить молярную концентрацию раствора, осмотическое давление которого при 0°С равно 1,12 атм.
Ответ: 0,05 моль/л.
При 0°С осмотическое давление раствора, содержащего 0,550 г гидрохинона в 500 мл раствора, равно 170,2 мм рт.ст. Вычислить молекулярную массу растворенного вещества.
Ответ: 110.
При 0°С осмотическое давление раствора, содержащего 3,04 г дифениламина в 600 мл раствора, равно 510,7 мм рт.ст. Вычислить молярную массу дифениламина. Ответ: 169.
Сколько воды надо прибавить к 5 л раствора сахара С12Н22O11, чтобы понизить его осмотическое давление с 10,13∙105 до 1,013∙105 Па?
Ответ: 45 л.
Во сколько раз повысится осмотическое давление раствора концентрации 0,1 моль/л при нагревании от 7 до 47°С?
Ответ: в 1,14 раза.
Давление пара эфира при 30°С равно 8, 64∙104 Па. Сколько молей неэлектролита надо растворить в 50 молях эфира, чтобы понизить давление пара при данной температуре на 2666 Па?
Ответ: 1,6 моль.
Понижение давления пара над раствором, содержащим 0,4 моля анилина в 3,04кг сероуглерода, при некоторой температуре, равно 1003,7 Па. Давление пара сероуглерода при той же температуре 1,0133∙105 Па. Вычислите молекулярную массу сероуглерода.
Ответ: 76,0.
При некоторой температуре давление пара над раствором, содержащим 62 г фенола С6H5ОН в 60 молях эфира, равно 0,507∙105 Па. Найдите давление пара эфира при этой температуре.
Ответ: 0,513∙105 Па.
. Давление пара воды при 50 °С равно 12334 Па. Вычислите давление пара раствора, содержащего 50 г этиленгликоля С2Н4(ОН)2 в 900 г воды.
Ответ: 12140 Па.
Определите давление пара над раствором, содержащим 1,212∙1023 молекул неэлектролита в 100 г воды при 100 °С. Давление пара воды при 100°С равно 1,0133∙105 Па.
Ответ: 0,98∙105 Па.
Давление водяного пара при 65°С равно 25003 Па. Определите давление пара над раствором, содержащим 34,2 г сахара С12H22O11 в 90 г воды при этой температуре. Ответ: 24512 Па.
Вычислите молекулярную массу глюкозы, если давление водяного пара над раствором 27 г глюкозы в 108 г воды при 100°С равно 98775,3 Па.
Ответ: 180.
Давление пара воды при 100°С равно 1,0133∙105 Па. Вычислите давление водяного пара над 10%-ным раствором мочевины СО(NН2)2 при этой температуре. Ответ: 0,98∙105 Па.
Давление пара над раствором 10,5 г неэлектролита в 200 г ацетона (СН3)2CO равно 21854,4 Па. Давление пара ацетона при этой температуре равно 23939,35 Па. Найдите молекулярную массу неэлектролита. Ответ: 32,0.
Рассчитайте молекулярную массу неэлектролита, если при 20°С давление водяного пара над 63%-ным водным раствором этого неэлектролита равно 1399,40 Па. Давление паров воды при этой температуре равно 2335,42 Па.
Ответ: 46, 0.
Давление пара воды при 25°С составляет 3167 Па. Вычислить для этой температуры давление пара раствора, в 450 г которого содержится 90 г глюкозы С6Н1206.
Ответ: 3090 Па.
Давление пара воды при 20°С составляет 2338 Па. Сколько граммов сахара C12H22O11 следует растворить в 720 г воды для получения раствора, давление пара которого на 18,7 Па меньше давления пара воды? Вычислить процентное содержание сахара в растворе.
Oтвет: 109 г; 13,5%.
При 0°С давление пара эфира (C2H5)2O составляет 2465 Па. Найдите для той же температуры: а) давление пара 5%-ного раствора анилина С6Н5NH2 в эфире; б) давление пара 10%-ного раствора бензойной кислоты С6Н5СООН в эфире.
Ответ:а) 23,65 кПа; б) 23,09 Па.
При 32°С давление пара водного раствора некоторого неэлектролита составляет 4721 Па, а давление пара воды при той же температуре 4753 Па. Вычислить осмотическое давление при той же температуре, приняв плотность раствора равной единице.
Ответ: 622 кПа.
Осмотическое давление водного раствора глицерина С3Н803 составляет при 0°С 567,3 кПа. Приняв плотность раствора равной единице, вычислить давление пара раствора при 0°С, если давление пара воды при той же температуре составляет 610,5 Па.
Ответ: 608 Па.
Чему равно давление пара раствора, содержащего 46 г глицерина С3Н803 в 900 г воды при 40°С, если давление пара воды при той же температуре 55,32 мм рт. ст.? Ответ: 55,1 мм рт.ст.
Давление пара раствора 27 г неэлектролита в 108 г воды при 75°С равно 270,1 мм рт.ст. Вычислить молекулярную массу неэлектролита, если давление пара воды при 75 °С равно 289,1 мм рт.ст.
Ответ: 68,5.
Давление пара раствора 8,89 г неэлектролита в 100 г воды при 0°С равно 4,54 мм рт.ст. Вычислить молекулярную массу неэлектролита, если давление пара воды при 0°С равно 4,58 мм рт.ст.
Ответ: 183,2.
Давление пара водного раствора глюкозы С6Н12О6 при 75°С равно 250 мм рт.ст. Вычислить процентную концентрацию раствора, если давление пара воды при 75 °С равно 289,1 мм рт.ст.
Ответ: 58,3%.
Давление пара чистого ацетона (СН3)2СO при 20°С равно 179,6 мм рт.ст. Вычислить давление пара раствора 2,5 г камфоры С10Н16О в 100 г ацетона при той же температуре.
Ответ: 177,9 мм рт.ст.
Давление пара раствора глицерина С3Н.8О3 в воде при 40°С равно 50 мм рт.ст. Сколько приблизительно молекул воды приходится на одну молекулу глицерина в указанном растворе? Давление пара воды при 40°С равно 55,32 мм рт.ст.
Ответ: ~11.
Давление пара эфира (С2Н5)2 O при 30°С равно 647,9 мм рт.ст.; давление пара раствора 3,1 г анилина в 370 г эфира при той же температуре равно 643,58 мм рт.ст. Вычислить молекулярную массу анилина.
Ответ: 93.
Давление пара воды при 40°С равно 55,32 мм рт.ст. Вычислить понижение давления пара при растворении 0,2 моль вещества в 540 г воды.
Ответ: 334 мм рт.ст
Давление пара эфира при 30°С равно 648 мм рт.ст. Сколько молей вещества надо растворить в 40 моль эфира, чтобы понизить давление пара при данной температуре на 10 мм рт.ст.?
Ответ: 0,627 моль.
Давление пара воды при 75°С равно 289,1 мм рт. ст. В скольких молях воды нужно растворить 0,4 моль вещества, чтобы при данной температуре понизить давление пара на 9 мм рт.ст.?
Ответ: 12,45 моль.
Давление пара воды при 55°С равно 633,9 мм рт.ст. Вычислить давление пара раствора, содержащего 29 г фенола С6Н5ОH в 900 г воды.
Ответ: 630,7 мм рт.ст.
Давление пара воды при 100°С равно 760 мм рт.ст. Вычислить давление пара над 4%-ным раствором мочевины СО(NН2)2 при этой температуре.
Ответ: 750,6 мм рт.ст
При некоторой температуре давление пара над раствором, содержащим 31 г анилина С6H5NH2 в 30 моль эфира, равно 540,8 мм рт.ст. Вычислить давление пара эфира при этой температуре.
Ответ: 546,8 мм рт.ст.
Над раствором, содержащим 5,59 маннозы в 180 г воды, давление пара при 80°С равно 354 мм рт.ст., а давление пара воды при этой температуре 355,1 мм рт.ст. Вычислить молекулярную массу маннозы. Ответ: 180.
При некоторой температуре давление пара над раствором, содержащим 2,44 г бензойной кислоты в 370,0 г эфира С4Н10О, равно 917,5 мм рт.ст. Давление пара эфира при этой температуре 921,2 мм рт.ст. Вычислить молекулярную массу бензойной кислоты. Ответ: 122.
Вычислить повышение температуры кипения раствора, содержащего 0,488 г бензойной кислоты С7Н6О2 в 50,0 г хлороформа Ехлороформа=3, 88 град. Ответ: 0,31 град.
Вычислить температуру кипения раствора, содержащего 0,5 моль растворенного вещества в 1000 г ацетона. Eацетона=1,5 град; температура кипения ацетона 56,0 град.
Ответ: 56,75 град.
Вычислить температуру кипения раствора анилина в этиловом эфире, содержащего 12 г анилина С6Н5NH2 в 200 г раствора. Еэфира=2,12 град; температура кипения эфира 35,6 град.
Ответ: 37°С.
В каком количестве сероуглерода нужно растворить 0,1 моль вещества, чтобы раствор кипел при 47°С? Температура кипения сероуглерода 46,3°С; ЕCS2 =2,29 град.
Ответ: 327 г.
Температура кипения эфира 35,6°С, Еэфира=2,12 град. Вычислить молекулярную массу бензойной кислоты, если 10%-ный раствор ее в эфире кипит при 37,53°С.
Ответ: 122.
Раствор, содержащий 4,6 г глицерина С3Н5(ОН)3 в 200 г ацетона, кипит при 56,73°С. Чистый ацетон закипает при 56,3°C. Вычислить эбуллиоскопическую константу ацетона. Ответ: 1,72°.
Сколько граммов глюкозы С6Н12О6 растворено в 500 г воды, если раствор закипает при 100,258°С?
Ответ: 45,35 г.
Сколько глицерина С3Н5(ОН)3 надо взять на 2 л воды, чтобы получить раствор с температурой кипения 106°С?
Ответ: 2,156 кг.
5 г некоторого вещества растворено в 200 г воды. Температура кипения раствора 100,432°С. Вычислить молекулярную массу растворенного вещества.
Ответ: 29,6.
Температура кипения раствора 0,36 г фосфора в 60 г сероуглерода (Е=2,4 град) на 0,12°С выше, чем у чистого растворителя. Чему равна молекулярная масса фосфора в растворе? Сколько атомов фосфора заключается в одной молекуле?
Ответ: Р4.
Температура кипения раствора 12,8 г серы в 250 г бензола (Е=2,57 град.) на 0,514°С выше, чем у чистого растворителя. Вывести молекулярную формулу серы в растворенном состоянии. Сколько атомов серы входит в состав одной молекулы этого вещества?
Ответ: S8.
Определите температуру кипения 10%-ного водного раствора глюкозы С6Н12O6.
Ответ: 100,32°C.
Определите температуру кипения раствора 1 г нафталина С10Н8 в 20 г эфира, если температура кипения эфира равна 35,6°С, а Е=2,16°.
Ответ: 36,44 °С.
Раствор, состоящий из 9,2 г иода и 100 г метилового спирта, закипает при 65,0°С. Сколько атомов входит в состав молекулы иода, находящегося в растворенном состоянии? Температура кипения спирта 64,7°С, а E=0,84°.
Ответ: I2.
Вычислить температуру кипения раствора, содержащего 100 г сахара С12Н22О11 в 750 г воды.
Ответ: 100,2°С.
Вычислить процентное содержание сахара С12Н22O11 в растворе, температура кипения которого 100,13°С.
Ответ: 7,88%.
В каком количестве воды следует растворить 23 г глицерина С3Н8О3, чтобы получить раствор с температурой кипения 100,104°С?
Ответ: 1250 г.
Какая часть моля сахара C12H22O11приходится на 1 моль воды в растворе, температура кипения которого 100,039°С?
Ответ: 1,35∙10-3 моль.
В скольких молях воды следует растворить 0,02 моля некоторого неэлектролита для получения раствора с температурой кипения 100,026°С?
Ответ: 22,2 моль.
Температура кипения ацетона 56,1°С, а Е=1,73°. Вычислить температуру кипения 8%-ного раствора глицерина С3Н803 в ацетоне. Ответ: 57,73°С.
Температура кипения эфира 34,5°С, а Е=2,16°. Вычислить молекулярную массу бензойной кислоты, если известно, что 5%-ный раствор этой кислоты в эфире кипит при 35,53°С.
Ответ: 122.
Температура кипения разбавленного раствора сахара C12H22O11 100,065°С. Вычислить осмотическое давление раствора при 0°С. Плотность раствора принять равной единице.
Ответ: 271,5 кПа.
Раствор 55,4 г неэлектролита в 2,5 л воды кипит при 100,16°С. Чему равна молекулярная масса неэлектролита?
Ответ: 72,0.
Повышение температуры кипения раствора 0,94 г фенола С6Н5ОН в 50 г этилового спирта (Е=1,16 град) 0,232°С. Найти молекулярную массу фенола. Ответ:94.
Раствор 15г хлороформа в 400г диэтилового эфира (Е=2,02 град) кипит при температуре, превышающей температуру кипения растворителя на 0,635°C. Вычислите молекулярную массу хлороформа.
Ответ: 119,3.
При какой температуре должен кипеть раствор, содержащий 0,062 моль неэлектролита в 200 мл воды?
Ответ: 100,16°С.
Раствор, содержащий 2,3 г С3Н8О3 в 100г ацетона (Ткип.=56,30С), кипит при 56,730С. Найдите эбуллиолскопическую константу для ацетона.
Ответ: 1,720С.
Сколько граммов сахара С12H22O11 надо растворить в 100 г воды, чтобы а) повысить температуру кипения на 1 град.; б) понизить температуру замерзания на 1 град.?
Ответ: а) 65,8 г; б) 18,4 г.
При растворении 13 г неэлектролита в 400 г диэтилового эфира (С2Н5)2O температура кипения повысилась на 0,453 градуса. Определить молекулярную массу растворенного вещества.
Ответ: 145.
Температура кипения водного раствора сахара C12H22O11 равна 101,4°С. Вычислить моляльность раствора. При какой температуре замерзает этот раствор? Ответ: 2 моль/кг; -3,72°С.
Вычислить понижение температуры замерзания раствора, содержащего 0,2 моль растворенного вещества в 750 г бензола (К=5,12 град).
Ответ: 1,365 град.
Температура замерзания уксусной кислоты 16,65°С, а К=3,9 град. Вычислить температуру замерзания раствора, содержащего 0,1 моль растворенного вещества в 150 г уксусной кислоты.
Ответ: 14,05 °С.
Вычислить температуру замерзания 10%-ного водного раствора глюкозы С6Н12О6.
Ответ: -1,048 °С.
Температура замерзания бензола 5,5°С. Криоскопическая константа 5,12 град. Сколько молей растворенного вещества содержится в 125 г бензола, если раствор замерзает при 4,99 °С?
Ответ: 0,012 моль.
Сколько глицерина С3Н803 нужно растворить в 200 г воды, чтобы раствор замерзал при -1 °С?
Ответ: 9,9 г.
Водный раствор сахара замерзает при -1,05°С. Сколько процентов сахара содержит этот раствор, если молекулярная масса сахара 342?
Ответ: 16,2%.
Раствор, содержащий 1,74 г растворенного вещества в 45,0 г воды, замерзает при -1,2°С. Вычислить молекулярную массу растворенного вещества. Ответ: 60.
Антифризы - жидкости с пониженной температурой замерзания, применяемые в системах охлаждения двигателей. Вычислить количество этиленгликоля С2Н4(ОН)2, которое необходимо прибавить к 1 кг воды для приготовления антифриза с температурой замерзания -15°С.
Ответ: 500 г.
При растворении 0,502 г ацетона (СН3)2 CO в 100 г уксусной кислоты температура замерзания понижается на 0,339° C. Вычислить криоскопическуго константу уксусной кислоты.
Ответ: 3,92 град.
Сколько граммов нафталина С10Н8 содержится в 3 кг бензола, если раствор замерзает при 4,55°С? Т.зам. бензола 5,5°С, а К=5,1 град.
Ответ: 71,5 г.
В 250 г воды растворено 1,6 г некоторого неэлектролита. Температура замерзания раствора -0,2°С. Вычислить молекулярную массу неэлектролита.
Ответ: 59,5.
Раствор, содержащий 6 г мочевины в 50 г воды, замерзает при -3,72°С. Вычислить молекулярную массу мочевины.
Ответ: 60.
Для приготовления охлаждающей жидкости на 20 л воды взято 6 л глицерина С3Н803. Чему равна температура замерзания приготовленной смеси? Плотность глицерина равна 1,26 г/мл.
Ответ: -7,56°С.
Формалин, уксусная кислота и глюкоза имеют одинаковый элементарный состав: С - 39,97%; Н - 6,73% и О - 53,30%. Приготовлены три раствора: по 1,5 г каждого из перечисленных веществ на 25 г воды. Температура замерзания растворов равна: первого - 3,72 °C, второго -1,86°С и третьего - 0,62°С, Вывести молекулярные формулы указанных веществ.
Ответ: Формалин СН2O; уксусная кислота СН3СOOН; глюкоза С6Н12O6.
Раствор 1,05 г неэлектролита в 30 г воды замерзает при -0,7°С. Вычислите молекулярную массу неэлектролита.
Ответ: 92,5.
Какова температура замерзания раствора неэлектролита, содержащего 2,02∙1023 молекул в литре воды?
Ответ: -0,62°С.
Определите формулу вещества, содержащего 39,34% углерода, 8,20% водорода и 52,46% серы, если раствор 0,2 г этого вещества в 26 г бензола замерзает при температуре на 0,318° ниже, чем чистый бензол.
Oтвет: C4H10S2.
Понижение температуры замерзания раствора 0,052 г камфоры в 26 г бензола равно 0,067°C . Рассчитайте молекулярную массу камфоры.
Ответ: 152,2.
Для приготовления охлаждающей жидкости на 30 л воды взято 9 л глицерина С3Н8О3. Чему равна температура замерзания приготовленного раствора? Плотность глицерина равна 1,261 г/мл.
Ответ: 7,6°С.
При какой температуре будет замерзать 25%-ный раствор этилового спирта С2Н5ОН в воде?
Ответ: -13,4°С.
При какой температуре будет замерзать раствор, содержащий в 4 л воды 500 г этиленгликоля С2Н4(ОН)2?
Ответ: -3,73°C.
Сколько граммов нафталина С10Н8 находится в 8 кг бензола, если этот раствор замерзает при 3,4 5°С? Температура замерзания чистого бензола 5,40 °С. Ответ: 392 г
Вычислить процентное содержание сахара С12Н22О11 в водном растворе, температура замерзания которого -0,41°С.
Ответ: 7%.
Вычислить температуру замерзания водного раствора мочевины СО(NH2)2, в котором на 100 молей воды приходится 1 моль растворенного вещества.
Ответ: -1,033°С.
Раствор сахара С12H22O11 оказывает при 27°C осмотическое давление, равное 156 кПа. Принимая плотность раствора равной единице, вычислить температуру его замерзания.
Ответ: -0,119°С.
В каком количестве воды следует растворить 0,5 кг глицерина С3H8O3 для получения раствора с температурой замерзания - 3°С?
Ответ: 3,37 кг.
При растворении 0,4 г некоторого вещества в 10 г воды температура замерзания раствора понижается на 1,24°C. Вычислить молекулярную массу растворенного вещества.
Ответ: 60.
Водный раствор глицерина замерзает при температуре -2,79°С. Вычислить число молей глицерина, приходящихся на каждые 100 молей воды, и давление пара раствора при 20°С. Давление пара воды при 20°С равно 2,34 кПа
Ответ: 2,7 моля.
Раствор сахара в воде показывает повышение температуры кипения на 0,312°С. Вычислить величину понижения температуры замерзания этого раствора. Ответ: 1,116°С.
Давление пара водного раствора глицерина составляет 98% от давления пара воды при той же температуре. Вычислить процентное содержание глицерина в растворе и температуру кристаллизации раствора.
Ответ: 9,44%; -2,1°С.
