
- •Гидролиз солей
- •Гидролиз солей
- •Константа гидролиза хлорида меди (II) поIступени связана с к(осн)2поIIступени; константа же гидролиза данной соли поIIступени связана с константой диссоциации основания к(осн)1 поIступени.
- •Так как константа диссоциации основания по Iступени значительно выше (на несколько порядков), чем константа диссоциации основания поIIступени, то
- •Учитывая выражение (3), можем записать:
- •Отношение
- •Константа диссоциации h2co3 поIступени превышает константу диссоциацииHco3- на несколько порядков. Так как Ккисл1»Ккисл2, то Кг1 »Кг2.
- •В этом случае константа электролитической диссоциации при 25 0с:
- •Умножим и числитель и знаменатель на ионное произведение воды
- •Итак, в данном случае
- •Полученная основная соль Sb(oh)2ci при стоянии разлагается по схеме
- •Гидролиз солей
- •Примеры решения задач
- •Варианты контрольных заданий
- •Лабораторная работа «Гидролиз солей»
Константа диссоциации h2co3 поIступени превышает константу диссоциацииHco3- на несколько порядков. Так как Ккисл1»Ккисл2, то Кг1 »Кг2.
4) Если соль образована катионом слабого основания и анионом слабой кислоты, то происходит гидролиз и по катиону и по аниону одновременно (поляризующим действием обладает и катион и анион соли). Примером может служить процесс гидролиза соли ацетата аммония:
а) в молекулярной форме
C
 H3COONH4
+ H2O
CH3COOH
+ NH4OH
;
H3COONH4
+ H2O
CH3COOH
+ NH4OH
;
б) в ионно-молекулярной форме
C
 H3COO-
+ NH4+
+ H2O
CH3COOH
+NH4OH
.
H3COO-
+ NH4+
+ H2O
CH3COOH
+NH4OH
.
Реакция и pH раствора определяется в данном случае силой образующихся слабых кислот и оснований. В этом случае константа электролитической диссоциации при 250С.
КNH4OH = 1,79 * 10-5
КCH3COOH = 1,86 * 10-5,
то есть почти одинаковы, связывание ионов H+ и OH- происходит в равной степени, а поэтому и реакция раствора остаётся практически нейтральной
pH ≈ 7.
Таким образом, среда раствора зависит от соотношения константы диссоциации основания и константы диссоциации кислоты, которые получаются в результате гидролиза.
Если константа диссоциации основания больше константы диссоциации кислоты, то среда щёлочная (pH > 7).
Например, гидролиз соли NH4CN.
N
 H4CN
+ H2O
NH4OH
+ HCN
H4CN
+ H2O
NH4OH
+ HCN
N
 H2+
+ CN-
+ H2O
NH4OH
+ HCN
H2+
+ CN-
+ H2O
NH4OH
+ HCN
В этом случае константа электролитической диссоциации при 25 0С
КNH4OH = 1,79 * 10-5
КHCN = 7,9*10-10
Так как Косн> Ккисл, то среда щёлочная иpH > 7.
Если константа диссоциации кислоты больше константы диссоциации основания, то среда кислая (pH < 7).Например, гидролиз солиFe(CH3COO)3:
F
 e(CH3COO)3
+ H2O
Fe(OH)3↓
+ CH3COOH
e(CH3COO)3
+ H2O
Fe(OH)3↓
+ CH3COOH
F
 e3+
+ 3CH3COO-
+ H2O
Fe(OH)3↓
+CH3COOH
e3+
+ 3CH3COO-
+ H2O
Fe(OH)3↓
+CH3COOH
В этом случае константа электролитической диссоциации при 25 0с:
КCH3COOH = 1,86 * 10-5
КFe(OH)3 = 2,4*10-23
Так как Ккисл> Косн, то среда кислая иpH < 7.
Охарактеризуем количественно гидролиз соли, образованной слабым основанием и слабой кислотой. Запишем уравнение гидролиза в ионно-молекулярной форме:
C
 H3COO-
+ NH4+
+ H2O
CH3COOH
+ NH4OH
H3COO-
+ NH4+
+ H2O
CH3COOH
+ NH4OH
По закону действующих масс константа равновесия этой реакции будет иметь вид
Кр
=
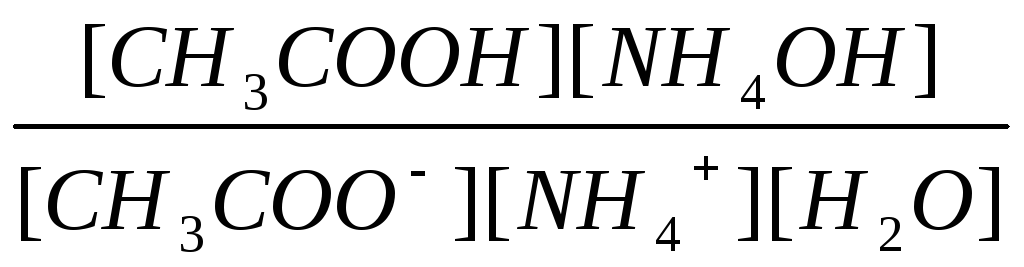 ;
(29)
;
(29)
концентрация воды в растворе соли есть величина постоянная [H2O] = const, поэтому
Кг
= Кр[H2O]
=
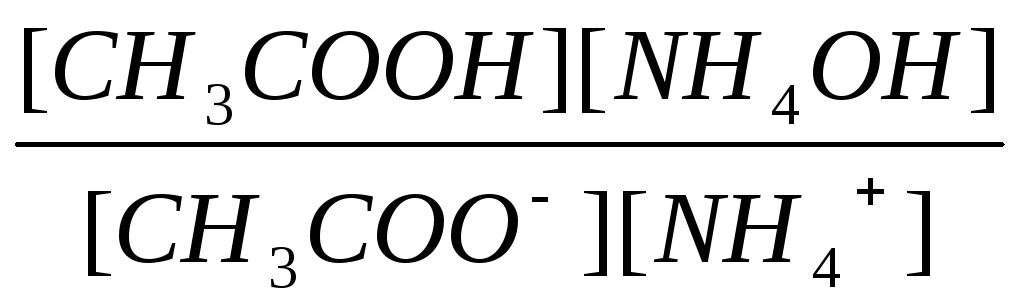 (30)
(30)
Умножим и числитель и знаменатель на ионное произведение воды
КH2O = [H+] * [OH-] (31)
Тогда уравнение (30) можно записать таким образом:
Кг
=
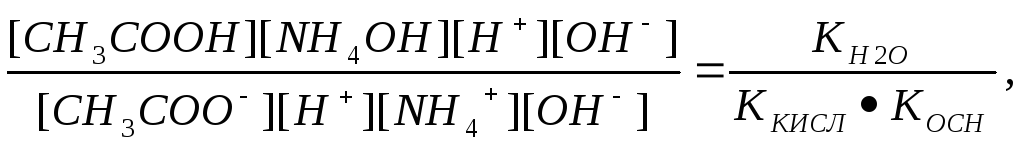 (32)
(32)
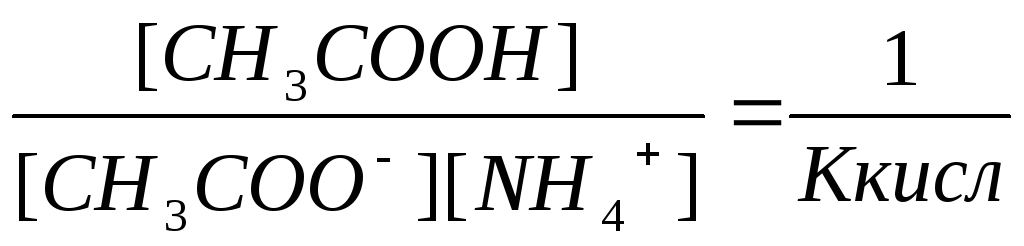 ,
(33)
,
(33)
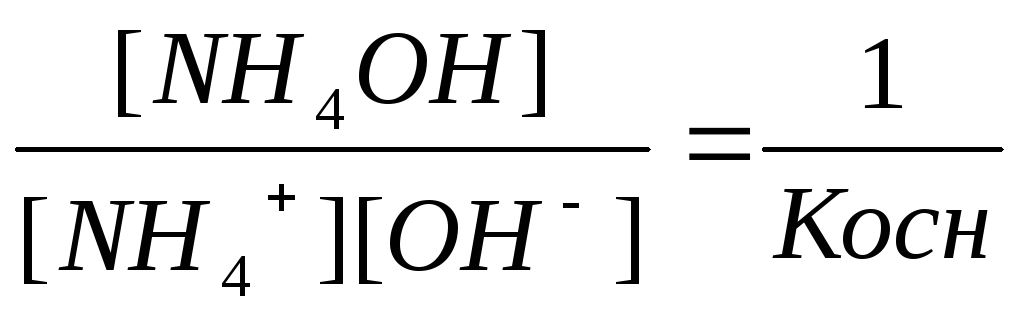 ,
(34)
,
(34)
где Ккисл – константа диссоциации CH3COOH, а Косн – константа диссоциации NH4OH.
Итак, в данном случае
Кг =
![]() . (35)
. (35)
Из полученного уравнения следует, что константа гидролиза тем больше, чем больше KH2O, чем меньше константа диссоциации кислоты (Ккисл) и основания (Косн), то есть чем слабее кислота и основание, образующие соль, подвергающуюся гидролизу.
Гидролиз представляет собой в большинстве случаев обратимый процесс, следовательно, может установиться равновесие.
Рассмотрим это на примере гидролиза хлорида сурьмы (III) SbCI3:
I стадия:
а) в молекулярной форме
S
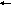 bCI3
+
H2O
Sb(OH)CI2↓+HCI;
bCI3
+
H2O
Sb(OH)CI2↓+HCI;
б )
в ионно-молекулярной форме
)
в ионно-молекулярной форме
S
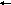
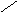
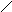 b3+
+ 3CI-
+ H2O
[Sb(OH)]2+
+ 2CI-
+ H+
+ CI-;
b3+
+ 3CI-
+ H2O
[Sb(OH)]2+
+ 2CI-
+ H+
+ CI-;
в) в краткой ионно-молекулярной форме
S
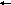 b3++
H2O
[Sb(OH)]2+
+ H+.
b3++
H2O
[Sb(OH)]2+
+ H+.
II стадия:
а) в молекулярной форме
S
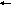 b(OH)CI2
+ H2O
Sb(OH)2CI
+ HCI;
b(OH)CI2
+ H2O
Sb(OH)2CI
+ HCI;
б) в ионно-молекулярной форме
[
 Sb(OH)]2+
+ 2CI-
+
H2O
[Sb(OH)2]+
+ CI-
+ H+
+ CI-;
Sb(OH)]2+
+ 2CI-
+
H2O
[Sb(OH)2]+
+ CI-
+ H+
+ CI-;
в) в краткой ионно-молекулярной форме
[
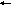 Sb(OH)]2+
+ H2O
[Sb(OH)2]+
+ H+.
Sb(OH)]2+
+ H2O
[Sb(OH)2]+
+ H+.
