
- •Стерлитамакский филиал
- •7. Э л е к т р о х и м и я в в е д е н и е
- •И с т о р и ч е с к и й о ч е р к
- •7.1 Растворы электролитов
- •7.1.1 Основы теории электролитической диссоциации
- •Причины электролитической диссоциации
- •7.1.2 Теория сильных электролитов дебая и гюккеля
- •7.2.1 Удельная и эквивалентная электропроводности
- •7.2.2 Закон кольрауша
- •7.2.3 Зависимость электропроводности сильных и слабых электролитов от концентрации электролита
- •7.2.4 Подвижность и числа переноса ионов
- •7.2.5 Кондуктометрия
- •7.2.5.1 Измерение электропроводности
- •7.2.5.2 Применение кондуктометрии
- •1.Степень диссоциации электролитов
- •2. Константа диссоциации электролита
- •3.Определение произведения растворимости (пр) труднорастворимых соединений (электролитов).
- •4.Кондуктометрическое титрование
- •5.Электропроводность как метод физико-химического анализа
- •7.3 Электродвижущие силы и равновесные электродные потенциалы
- •7.3.1 Гальванический элемент и электролизер. Законы электролиза
- •7.3.2.1 Термодинамика гальванического элемента
- •7.3.2.2 Определение термодинамических параметров химической реакции
- •7.3.3 Скачки потенциала на границе раздела фаз в электрохимических системах
- •7.3.4 Электродные потенциалы
- •7.3.5 Классификация электродов
- •7.3.6 Водородный электрод
- •7.3.7 Каломельный электрод
- •Потенциал его определяемся соотношением
- •7.3.8 Измерение эдс. Нормальный элемент
- •7.3.9 Концентрационные цепи
- •К цепям второго рода относятся цепи с газовыми или амальгамными электродами.
- •7.3.10 Диффузионные потенциалы
- •7.3.11 Окислительно-восстановительные электроды и цепи
- •7.3.12 Применение потенциометрических методов
- •7.3.13 Стеклянный электрод
- •7.3.14 Потенциометрическое титрование
- •7.4 Неравновесные электрохимические процессы
- •7.4.1 Поляризация
- •7.4.2 Концентрационная поляризация
- •7.4.4 Перенапряжение выделения водорода
- •7.4.5 Полярография
- •Топливные элементы
- •Метода защиты металлов от коррозии
- •8. Химическая кинетика
- •8.1 Скорость химической реакции
- •8.4 Необратимая реакция второго порядка
- •8.5 Обратимая реакция первого порядка
- •А в.
- •8.6 Обратимая реакция второго порядка
- •8.7 Параллельные реакции
- •8.8 Последовательные реакции
- •Подставим выражение в уравнение. Тогда
- •8.9 Методы определения порядка реакции
- •8.10 Влияние температуры на скорость реакции
- •8.11 Теория активных столкновений молекул
- •8.12 Применение теории столкновений к бимолекулярным реакциям. Расчет константы скорости
- •8.13 Бимолекулярный механизм активации мономолекулярной реакции
- •8.14 Теория активного комплекса или переходного состояния
- •8.15 Цепные реакции
- •8.16 Фотохимические реакции
- •8.17 Особенности гетерогенных процессов
- •Растворение твердых тел в жидкостях
- •9. Каталитические реакции
- •9.1 Особенности и классификация каталитических процессов
- •9.2 Гомогенный катализ
- •9.3 Обобщенная теория кислот и оснований. Кислотно-основный катализ
- •9.6 Теории гетерогенного катализа
- •9.6.1 Мультиплетная теория
- •9.6.2 Теория активных ансамблей
- •9.6.3 Электронная теория
- •Содержание
- •7.4 Неравновесные электрохимические процессы
- •8. Химическая кинетика
- •9. Каталитические реакции
- •450062, Г. Уфа, ул. Космонавтов, 1.
- •453118, Г. Стерлитамак, пр. Октября, 2.
8.9 Методы определения порядка реакции
Вид дифференциального уравнения скорости химической реакции устанавливается на основании опытных данных по зависимости концентраций реагирующих веществ и продуктов реакции от времени. Концентрации определяются обычными химическими или физико-химическими методами анализа (например, измерение оптической плотности, электропроводности, потенциала электрода, диэлектрической постоянной, теплопроводности газовой смеси и др.). Для определения дифференциального уравнения скорости химической реакции необходимо определить как общий порядок реакции, так и порядок по отдельным компонентам реагирующей системы. Для определения порядка реакции можно использовать следующие методы.
1. Метод подстановки. Иногда порядок реакции можно установить, проверив, какое из уравнений лучше описывает опытные данные. Для этого по опытным значениям концентраций в различные моменты времени рассчитывают константу скорости реакции по уравнению первого, второго и третьего порядка. Можно считать, что уравнение описывает процесс, если полученные по нему значения констант колеблются около какой-то средней величины, и отклонения от среднего значения лежат в пределах возможных ошибок определения.
2. Графический метод. Зависимость концентрации от времени для реакций различных порядков может быть выражена прямой линией, если выбрать соответствующую систему координат. Так, для реакции первого порядка прямая получается в системе координат lgc — t, для второго порядка при с01=с02 в системе — t и для третьего порядка в системе — t. По тангенсу угла наклона прямых можно определить константу скорости реакции.
3. Метод определения времени половинного превращения. Время половинного превращения для реакций различного порядка по-разному зависит от начальной концентрации реагентов. Для реакции первого порядка t1/2=, не зависит от с0; для реакции второго порядка t1/2 = , обратно пропорционально с0; для реакции третьего порядка t1/2=3 1/(2kс20 ), обратно пропорционально c02. Проведя опыты с различными начальными концентрациями реагирующих веществ, найдя t1/2, можно сделать вывод о порядке реакции.
t`
= k![]() ;
;
t``
= k![]() ;
;
![]() =
(
=
(![]() )n-1;
)n-1;
lg![]() = (n-1)lg
= (n-1)lg![]() ;
;
n
=
![]() + 1.
+ 1.
4. Метод Вант-Гоффа. Проводится два опыта, в которых начальные концентрации вещества, по которому определяется порядок реакции, равны c1 и c2 (концентрации других веществ во много раз больше). Тогда скорости реакции в первом и втором опытах будут:
-![]() = kc1n;
= kc1n;
-![]() = kc2n.
= kc2n.
Поделим эти уравнения, прологарифмируем и найдем:
lg![]() - lg
- lg![]() = n(lgc1
– lgc2);
= n(lgc1
– lgc2);
n
=
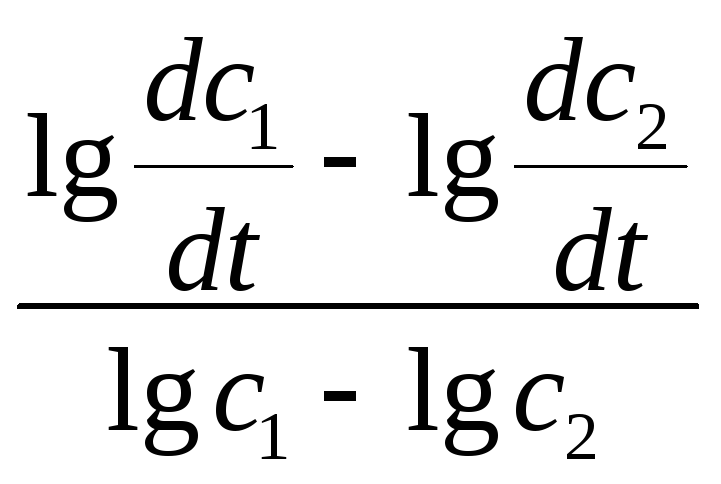 ;
;
 .
.
5. Метод изоляции, или метод избытка реагента. По этому методу, предложенному Оствальдом, проводят серию опытов, в каждом из которых изучается влияние концентрации только одного из исходных веществ на скорость реакции. Для этого все остальные исходные вещества берут в таком избытке, по сравнению с исследуемым, чтобы их концентрации в ходе реакции можно было считать практически постоянными. Составляют кинетические уравнения и определяют порядок реакции по каждому из исследуемых исходных веществ при помощи первого, второго или третьего способов. Сумма порядков реакций по всем исходным веществам представляет собой порядок реакции в целом.
