
- •Министерство высшего образования
- •Введение
- •1. Химическая термодинамика предмет и задачи термодинамики
- •1.1 Основные понятия и определения химической
- •1.2 Первый закон термодинамики
- •1.3 Применение первого закона термодинамики к процессам в любых системах
- •1.6 Теплоемкость. Связь теплоемкости с
- •1.7 Зависимость теплового эффекта oт температуры.
- •1.8 Второй закон термодинамики
- •1.9 Энтропия
- •1.10 Второй закон термодинамики для обратимых и
- •1.12 Постулат планка.Вычисление абсолютной энтропии
- •1.14 Энергия гельмгольца (изохорно-изотермический
- •1.15 Энергия гиббса (изобарно-изотермический
- •1.16 Уравнение гиббса-гельмгольца
- •1.17 Характеристические функции
- •1.18 Химический потенциал.Летучесть
- •1.20 Уравнение изотермы реакции
- •1.21 Зависимость константы равновесия от температуры
- •1.23 Тепловая теорема нернста
- •1.24 Расчет химического равновесия с помощью
- •2. Фазовые равновесия
- •2.1 Общие понятия
- •2.2 Условия фазового равновесия
- •2.3 Правило фаз гиббса
- •2.4 Уравнение клаузиуса-клапейрона
- •2.5 Однокомпонентная система воды
- •2.6 Диаграммы состояния двухкомпонентных
- •2.6.1 Система с неограниченной растворимостью
- •2.6.3 Система с ограниченной растворимостью
- •2.7 Трехкомпонентные системы
- •3. Растворы
- •3.1 Характеристика растворов
- •3.2 Закон рауля
- •3.5 Жидкие бинарные системы. Идеальные растворы
- •3.6 Растворы с положительными и отрицательными
- •3.7 Состав паровой фазы над растворами. Законы
- •3.7.1 Диаграммы состав – давление пара (температура
- •3.7.2 Перегонка. Ректификация
- •Ректификация
- •3.8 Термодинамика концентрированных
- •3.10 Растворимость твердых тел в жидкостях
- •3.12Распределение растворенного вещества между
- •4.2 Математическое описание волнового движения
- •4.3 Уравнение шредингера
- •4.4 Решение уравнения шредингера
- •4.7 Распространение волнового уравнения на
- •4.8 Атомные термы
- •5.1 Ионная связь. Энергия кристаллической решетки
- •5.2 Ковалентная связь
- •5.4 Расчет молекулярного иона водорода
- •5.7 Квантовохимические представления о координационных соединениях
- •5.9 Водородная связь
- •6.1 Дипольный момент молекул
- •Содержание
- •1.Химическая термодинамика
- •2.Фазовые равновесия
- •3.Растворы
- •4.Строение атомов
- •5.Химическая связь
- •6.Электрические и магнитные свойства молекул
3.2 Закон рауля
Давление пара вещества над раствором равно давлению пара чистого вещества, умноженному на его мольную долю в растворе.
= по+ RTlnPi
= жо + RTlni
d = RTdlnPi
d = RTdlnNi
dlnPi = dlnNi
ln![]() = lnN1
= lnN1
P1 = P10N1
![]() =
N1
=
N1
1
-
![]() = 1 - N1
= 1 - N1
P10
-
![]() = 1
- N1
= 1
- N1
![]() = N2
= N2
Относительное понижение давления насыщенного пара растворителя над разбавленным раствором нелетучего вещества в летучем растворителе, независимо от природы растворителя и температуры, равно мольной доле растворенного вещества.
3.3 ПОНИЖЕНИЕ ТЕМПЕРАТУРЫ ЗАМЕРЗАНИЯ И ПОВЫШЕНИЕ
ТЕМПЕРАТУРЫ КИПЕНИЯ РАЗБАВЛЕННЫХ РАСТВОРОВ
Температурой замерзания чистой жидкости является та строго постоянная температура, при которой кристаллы находятся в равновесии с жидкостью, т.е. имеют такое же давление насыщенного пара, как и жидкость.
Температурой кипения чистой жидкости или раствора называется та температура, при которой давление насыщенного пара становится равным внешнему давлению.
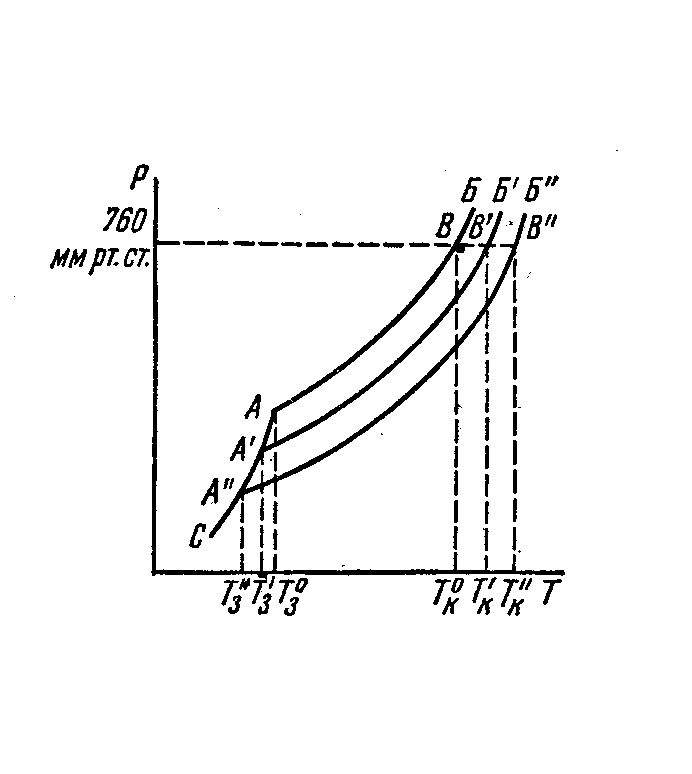
Тз = km
Тз
= k![]()
k
=
![]()
Tk = Em
Tk=E![]()
E=
![]()
3.4 ОСМОТИЧЕСКОЕ ДАВЛЕНИЕ И ЕГО ЗАКОНЫ







Раствор Растворитель

ЗАКОНЫ ОСМОТИЧЕСКОГО ДАВЛЕНИЯ
При постоянной температуре осмотическое давление прямо пропорционально концентрации или обратно пропорционально молярному объему вещества.
При данной концентрации осмотическое давление пропорционально абсолютной температуре.
При одинаковой температуре и одинаковой концентрации разные вещества имеют одно и то же осмотическое давление.
=![]() RT=cRT
RT=cRT
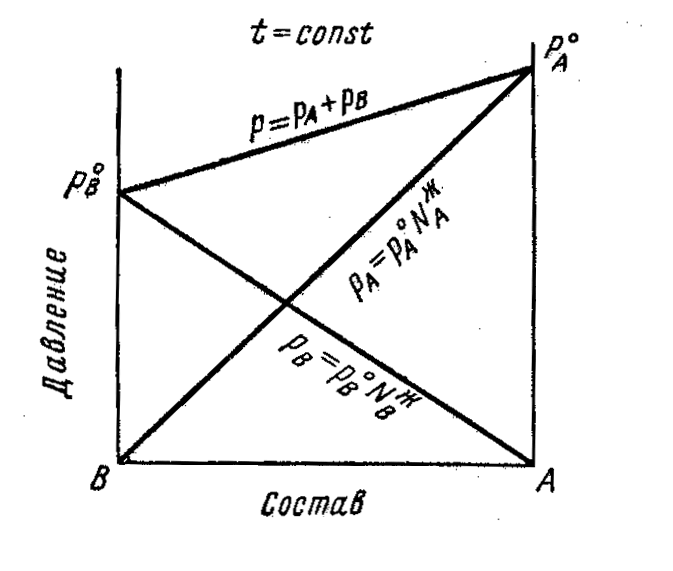
3.5 Жидкие бинарные системы. Идеальные растворы
Рассматриваются законы равновесия между жидкой и паровой фазами систем, образованных двумя достаточно летучими и неограниченно растворимыми друг в друге компонентами.
Наибольший интерес представляют диаграммы: состав- давление пара и состав-температура кипения.
При заданной температуре общее давление Р раствора складывается из парциальных давлений РА и Рв компонентов
Р = Pа + Рв
Различают три группы растворов - идеальные, предельно разбавленные и неидеальные.
Идеальным называется раствор, в котором силы взаимодействия FА.В между молекулами разных видов равны силам взаимодействия FA-A и FB-B между молекулами одного вида. Поведение идеального раствора, подобно поведению идеального газа, зависит только от концентрации компонентов и температуры.
Согласно закона Рауля
Pi = Рi°NiЖ
Р = Ра + Рв = РА0 NAЖ+ РВ0 NBЖ= РА°NАЖ + РB0 (1 - NAЖ) =
== РВ0 + NAЖ(PA0 – PB0)
Неидеальные растворы FB-B FA.B FA.A
Предельно разбавленные растворы - растворы, в которых концентрация растворенного вещества бесконечно мала.
Pi = Pi0NiЖ
Р2 = K2N2 (закон Генри)
