
- •Экзаменационныевопросы
- •Биохимия-биохимияполостирта
- •Функциибелков
- •2.Сложные белки. Классификация, строение, примеры. Строение ифункции миоглобина.
- •Серповидно-клеточнаяанемия
- •Нарушениесинтезагемоглобина
- •4.Общая характеристика ферментов. Специфичность ферментов. Виды специфичности, примеры. Строение ферментов. Кофакторы и коферменты. Классификация и номенклатура ферментов.
- •Существуютшестьклассовферментов
- •Ферментыизбирательнывсвоемдействии
- •Ферментыизбирательнывсвоемдействии
- •Лекарстваобычноингибируютферменты
- •Ингибированиеферментов
- •Особенности строения и функционирования аллостерическихферментов:
- •Регуляция каталитической активности ферментов белок- белковыми взаимодействиями.
- •Активация ферментов в результате присоединения регуляторныхбелков.
- •Регуляция каталитической активности ферментов путёмфосфорилирования/дефосфорилирования
- •Естьпатологии,прикоторыхферменты неработают
- •Энзимотерапия-
- •Биологическоеокисление
- •1. Катаболизм и анаболизм. Общая схема обмена веществ и энергии в организме человека. Специфические и общие пути катаболизма.
- •РольАтф
- •2. Окислительное декарбоксилирование пирувата. Строение пируватдегидрогеназного комплекса. Стадии окислительного декарбоксилирования пирувата. Регуляция пируватдегидрогеназногокомплекса.
- •Окислениеацетатадаетмногоэнергии
- •Циклтрикарбоновыхкислот
- •Энергетическая
- •Окислительноефосфорилирование
- •Дыхательнаяцепьвключаетмножествобелков-переносчиков
- •Комплекс.Надн-КоQ-оксидоредуктаза
- •Комплекс.Фад-зависимыедегидрогеназы
- •Комплекс.КоQ-цитохромc-оксидоредуктаза
- •Комплекс.Цитохромс-кислород-оксидоредуктаза
- •Комплекс
- •Ингибиторыокислительногофосфорилирования
- •Структурно-функциональнаяхарактеристикамитохондрий
- •Существуетмногоактивныхформкислорода
- •Свободныерадикалымогутобразоватьсяспонтанно
- •Активныерадикалымогутобразоватьсяспециально
- •9.Антиоксидантная система организма.Антиоксиданты неферментативной природы. Ферментные системы антиоксидантной защиты. Агрессивностьсвободныхрадикаловнадоконтролировать
- •10.Физиологическоезначениесвободно-радикального окисления. Фагоцитоз и воспаление.
- •Свободныерадикалымогутприноситьпользу
- •Обменуглеводов
- •2.Структураифункциипредставителейуглеводов:моносахаридов, дисахаридов, гомополисахаридов.
- •Моносахариды-этоструктурнаяединицалюбыхуглеводов
- •Дисахаридычастоприсутствуютвпище
- •Уполисахаридовструктурнаяирезервнаяфункция
- •Функции
- •Углеводылегкоусваиваются
- •Перевариваниеуглеводоввжелудочно-кишечномтракте
- •Непереносимостьлактозыисахарозы
- •Мальабсорбцияфруктозы
- •Для переноса моносахаридов через мембраны требуются белки-транспортеры
- •Транспорт моносахаровчерезмембраны
- •6. Пути превращения глюкозы в клетке. Источники глюкозы в клетке. Фосфорилирование глюкозы, ключевая роль глюкозо-6-фосфата. Фруктозаигалактозадолжныпревратитьсявглюкозу
- •Превращениемоносахаров
- •Превращениегалактозы
- •Превращениефруктозы
- •Гексокиназа-первыйферментметаболизмаглюкозы
- •Гликоген-этолегкоиспользуемыйрезервэнергии
- •Синтези распадгликогенареципрокны
- •10.Генетические нарушения синтеза (агликогеноз) и распада гликогена (печеночные, мышечные и смешанные гликогенозы). Агликогенозы
- •Гликогенозы
- •Гликолиз
- •Анаэробныйгликолиз-самодостаточныйпроцесс
- •14.Судьба продуктов гликолиза в аэробных условиях.Глицеролфосфатная и малатаспартатнаячелночные системы. Энергетический выход аэробного окисления глюкозы.
- •НадНгликолизамогутдоставлятьсявмитохондрии
- •Челночныесистемы
- •17.Глюкозо-лактатный цикл (цикл кори), его значение при физической работе. Источники молочной кислоты в организме. Глюкозо-аланиновый цикл, его значение при физической работе и голодании.
- •Вразныхклеткахпентозофосфатныйпутьидетпо-разному
- •Нарушенияпентозофосфатногопутиестьумногихлюдей
- •Обменлипидов
- •Функции липидовтесносвязанысихстроением
- •Перевариваниелипидовможетлегконарушиться
- •Причинынарушенийперевариваниялипидов
- •Удетейсвоипричуды Особенностиперевариванияжираудетей
- •Количествобелкавпищенеобходимопросчитывать
- •Чтозначитполноценныйбелок?
- •Перевариваниебелковначинаетсявжелудке
- •Втонкомкишечникебелкидолжныполностьюрасщепиться
- •Удетейсвоипричуды Особенностиперевариваниябелковудетей
- •ПроблемыЖкТвлияютнавесьорганизм
- •Появлениеаммиакавклеткахнепрерывно
- •Сначалааммиактребуетсяобезвредить
- •Связанныйаммиакпереноситсявпеченьипочки
- •Дляудаленияаммиакаестьдваспособа
- •Аммиактоксичендляорганизма
- •Наследственныеиприобретенныеформыгипераммониемий
- •Строениепиримидиновыхоснованийинуклеозидов
- •Строениенуклеотидов
- •Синтезпиримидиновыхнуклеотидовлинейный
- •Синтездезоксирибонуклеотидовпроисходитвтриреакции
- •Реакциядефосфорилирования
- •Реакциявосстановления
- •Реакцияфосфорилирования
- •Пуриновыеоснованиясодержатдвойнойцикл Строениепуриновыхоснованийинуклеозидов
- •Строениенуклеотидов
- •Синтезпуриновыхнуклеотидовдовольносложен
- •Синтез5'-фосфорибозиламина
- •Синтезинозинмонофосфата
- •Синтезаденозинмонофосфатаигуанозинмонофосфата
- •ОбразованиенуклеозидтрифосфатовАтФиГтф.
- •Пуриныраспадаютсясобразованиеммочевойкислоты
- •Пуриновыеоснованиядолжныиспользоватьсяповторно
- •Накоплениемочевойкислотыбьетпосуставамипочкам
- •Нарушенияобменапуринов
- •Связьобменасерина,глицина,метионинаицистеина
- •Нарушениеобменаметионинаицистеина Гомоцистеинемия
- •Обменфенилаланинаитирозина
- •Фенилкетонурия-самоеяркоенарушениеобменааминокислот
- •Гормоны
- •Гормоныгипофизарно-надпочечниковойсистемы
- •Адренокортикотропныйгормон
- •Глюкокортикоиды
- •Гормонытиреоиднойфункции Тиреотропныйгормон
- •Йодтиронины
- •6. Глюкагон: биологическое значение, регуляция синтеза и секреции, механизм действия,органы-мишени, влияние на обмен веществ – регулируемые ферменты и процессы.
- •Сахарныйдиабет-биохимическоезаболевание
- •Причинысахарногодиабета
- •Диагностикасахарногодиабета
- •Последствияиосложнениясахарногодиабета
- •Биохимияпечениикрови
- •Причинынарушенийперевариваниялипидов
- •Гемнеобходимдлямногихферментов
- •Угемоглобинаестьмолекулярныеболезни Серповидно-клеточнаяанемия
- •Нарушениесинтезагемоглобина
- •Распадгема-многостадийныйпроцесс
- •Существуюттритипанарушенийобменабилирубина
- •Желтухичастовстречаютсяуноворожденных
- •Встречаютсянаследственныепеченочныежелтухи
- •Химические механизмы регуляции кислотно- основного состояния. Буферные системыкрови – фосфатная, белковая, бикарбонатная, гемоглобиновая.Физиологическиесистемы
- •26.Клеточная модель свертывания крови, основные процессы, происходящие на каждой стадии. Стадии: инициация, амплификация, распространение (образование фибрина).
- •Биохимияполостирта
- •Угликопротеиновразнообразныефункции
- •Сывороткакрови
- •Паратиреоидныйгормон
- •ВитаминD(кальциферол,антирахитический)
- •Кальцитонин
- •Амелогенез
- •XII и XIV типов. Состав и функции пульпы. Коллагеновые и неколлагеновые (остеопонтин, остеонектин, интегрины, амелогенины, щелочная фосфатаза и другие) белки пульпы.
- •Белкидентина
- •Структурадентина
- •Пульпазуба
- •Методикавыявлениязубныхотложений
- •4.2.Составдесневойжидкости
Экзаменационныевопросы
подисциплине
Биохимия-биохимияполостирта
длястудентовстоматологическогофакультета
Белкииферменты
1. Функции белков в организме человека. Физиологически активные пептиды. Уровни структурной организации белков. Первичная, вторичная, третичная и четвертичная структуры белка. Связи, их стабилизирующие. Глобулярные, фибриллярные, трансмембранные белки: особенности строения, примеры. Фолдинг белков. Шапероны. Денатурация и ренативация белков. Прионы и прионные болезни.

Функциибелков
Работаифункциибелковлежатвосновеструктурылюбогоорганизмаивсехпротекающихвнем жизненныхреакций.Любые нарушения этихбелковприводят к изменению самочувствияи нашего здоровья. Необходимость изучения строения, свойств и видов белков кроется в многообразии их функций.
Первые слова из определения Ф.Энгельсом понятия жизни "Жизнь есть способ существования белковыхтел, "досихпор,попрошествииполуторавеков,непотерялисвоейправильностии
актуальности.
Структурнаяфункция
Веществосоединительнойтканиимежклеточныйматриксформируют белкиколлаген,эластин,кератин,протеогликаны.
Непосредственно участвуют в построении мембран и цитоскелета (интегральные, полуинтегральные и поверхностные белки) –спектрин(поверхностный,основной белокцитоскелетаэритроцитов),гликофорин(интегральный,фиксируетспектриннаповерхности).К даннойфункцииможно отнести участие всозданииорганелл –рибосомы.
Ферментативнаяфункция
Всеферментыявляютсябелками.
Втожевремяестьданныеосуществованиирибозимов,т.е.рибонуклеиновыхкислот,
обладающих каталитической активностью.
Гормональнаяфункция
Регуляциюисогласованиеобменавеществвразныхклеткахорганизмаосуществляютгормоны. Такиегормоныкакинсулиниглюкагонявляютсябелками,все гормоныгипофизаявляются пептидами или небольшими белками.
Рецепторнаяфункция
Этафункциязаключаетсявизбирательномсвязываниигормонов,биологическиактивных веществ и медиаторов на поверхности мембран или внутри клеток.
Транспортнаяфункция
Толькобелкиосуществляютпереносвеществвкрови,например,липопротеины(перенос жира),гемоглобин(связывание кислорода),гаптоглобин (транспорт
гема),трансферрин(транспортжелеза).Белкитранспортируютвкровикатионыкальция,магния, железа, меди и другие ионы.
Транспортвеществчерезмембраныосуществляютбелки-Na+,К+-АТФаза(антинаправленный трансмембранныйпереносионовнатрияикалия),Са2+-АТФаза(выкачиваниеионовкальцияиз клетки),глюкозные транспортеры.
Резервнаяфункция
Вкачествепримерадепонированногобелкаможнопривестипроизводствоинакоплениев яйцеяичного альбумина.
Уживотныхичеловекатакихспециализированныхдепонет,нопридлительномголодании используются белкимышц, лимфоидныхорганов, эпителиальных тканейипечени.
Сократительнаяфункция
Существуетрядвнутриклеточныхбелков,предназначенныхдляизмененияформыклеткии движениясамой клетки илиееорганелл(тубулин,актин,миозин).
Защитнаяфункция
Защитнуюфункцию,предупреждаяинфекционныйпроцессисохраняяустойчивостьорганизма, выполняютиммуноглобулиныкрови, факторысистемыкомплемента(пропердин), при повреждениитканейработаютбелкисвертывающейсистемыкрови-например,фибриноген, протромбин, антигемофильный глобулин.Механическуюзащитув виде слизистыхи кожи осуществляют коллаген ипротеогликаны.
К даннойфункциитакжеможноотнести поддержание постоянстваколлоидно-осмотическогодавлениякрови, интерстицияивнутриклеточныхпространств,а такжеиныефункциибелков крови.
Белковаябуфернаясистемаучаствуетвподдержаниикислотно-щелочногосостояния.
Строениебелка
Белок–этопоследовательностьаминокислот,связанныхдругсдругомпептиднымисвязями.
Легкопредставить, что количествоаминокислот может быть различно: от минимума двухдо любыхразумныхвеличин.Биохимикиусловилисьсчитать,чтоесликоличествоаминокислотне превышает 10, то такое соединение называетсяпептид;если от 10 до 40аминокислот –полипептид, если более 40 аминокислот –белок.
Линейнаямолекулабелка,образующаясяприсоединенииаминокислотвцепьпри
помощипептидныхсвязей, являетсяпервичной структурой. Образно ее можно сравнить с обычнойнитьюнакоторуюнавешенодонесколькихсотенбусинокдвадцатиразличныхцветов (по числу аминокислот).
Строениеаминокислот,ихпоследовательностьисоотношениевпервичнойструктуре определяет дальнейшее поведение молекулы: ее способность изгибаться, сворачиваться, формироватьтеилииныесвязивнутрисебя.Формымолекулы,создаваемыеприсвертывании,последовательномогутприниматьвторичный,третичныйичетвертичныйуровеньорганизации.
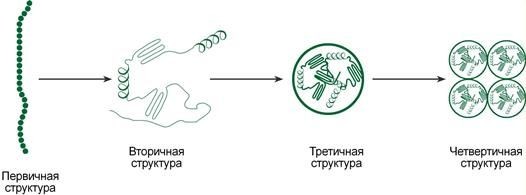
Схематичное представление последовательности укладки белков в четвертичную структуру
Науровневторичнойструктурыбелковые"бусы"способныукладыватьсяв
видеспирали(подобнодвернойпружине)иввидескладчатого слоя,когда"бусы"уложенызмейкой и удаленные части "бус" оказываются рядом.
Укладка белка во вторичную структуруплавно переходит в формированиетретичной структуры.Третичнаяструктура-этоотдельныеглобулы,вкоторыхбелокуложенкомпактно,в виде трехмерного клубка.
Некоторые белковые глобулысуществуют ивыполняют свою функцию не поодиночке, а группамиподве,трииболеештук.Такиегруппыназываютсячетвертичнойструктуройбелка.
Объединениеаминокислотчерезпептидныесвязисоздаетлинейнуюполипептиднуюцепь, которая называетсяпервичной структурой белка
Учитывая,чтовсинтезебелковпринимаетучастие20аминокислотисреднийбелоксодержит 500аминокислотныхостатков,томожноговоритьоневообразимомколичествепотенциально возможныхбелков. В организме человека обнаружено около 100 тысячразличныхбелков.
Первичная структура белков, т.е. последовательность аминокислот в нем, программируется последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида в ДНК приводиткизменениюаминокислотногосоставаи,следовательно,структурысинтезируемогобелка.
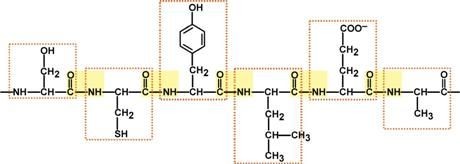
Участокбелковойцепидлинойв6аминокислот(Сер-Цис-Тир-Лей-Глу-Ала) Пептидные связи выделены желтым фоном, аминокислоты - рамкой.
Если изменение последовательности аминокислот носит не летальный характер, а приспособительныйилихотябынейтральный,тоновыйбелокможетпередатьсяпонаследству иостатьсяв популяции. В результатевозникают новые белкис похожимифункциями. Такое явление называетсяполиморфизмбелков.
Вторичнаяструктурабелка–этоспособукладкиполипептиднойцепивболеекомпактную структуру,прикоторойпроисходитвзаимодействиепептидныхгруппсобразованиеммежду ними водородных связей.
Формирование вторичной структуры вызвано стремлением пептида принять конформацию с наибольшимколичествомсвязеймеждупептиднымигруппами.Типвторичнойструктурызависит от устойчивости пептидной связи, подвижности связи между центральным атомом углерода и углеродом пептиднойгруппы, размером аминокислотного радикала. Все указанное вкупе с аминокислотной последовательностью впоследствии приведет к строго определенной конфигурации белка.
Выделяютдвавозможныхвариантавторичнойструктуры: ввиде"каната" –α-спираль(α-структура),иввиде"гармошки"–β-складчатый слой(β-структура).Водномбелке,какправило,одновременно присутствуют обе структуры, но в разном долевом соотношении. В глобулярных белках преобладает α-спираль, в фибриллярных – β-структура.
 Вторичнаяструктураобразуетсятолькоприучастииводородныхсвязеймеждупептидными
группами:атом
кислорода одной группы реагирует с
атомом водорода второй, одновременно
кислород второй пептидной группы
связывается с водородом третьей и т.д.
Вторичнаяструктураобразуетсятолькоприучастииводородныхсвязеймеждупептидными
группами:атом
кислорода одной группы реагирует с
атомом водорода второй, одновременно
кислород второй пептидной группы
связывается с водородом третьей и т.д.
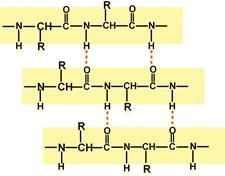
Участие водородных связей вформированиивторичнойструктуры
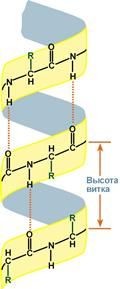
Укладкабелкаввидеα-спирали
α-Спираль
Даннаяструктураявляетсяправоза крученнойспиралью,образуетсяприпомощиводородныхсвязеймеждуп
ептиднымигруппами1-гои4-го,4-гои7-го,7-гои10-гоитакдалееаминокислотныхостатков.
Формированию спирали препятствуютпролинигидроксипролин,которые из-за своейциклическойструктурыобусловливают"перелом"цепи,т.е.ее принудительныйизгибкак,например, вколлагене.
Высотавиткаспиралисоставляет0,54нмисоответствуетвысоте3,6аминокислотныхостатков, 5 полныхвитков соответствуют 18 аминокислотам и занимают 2,7 нм.
β-Складчатыйслой
Вэтом способе укладки белковая молекулалежит "змейкой", удаленные отрезки цепи оказываются поблизости друг от друга. В результате пептидные группы ранее удаленных аминокислотбелковойцеписпособнывзаимодействоватьприпомощиводородныхсвязей.
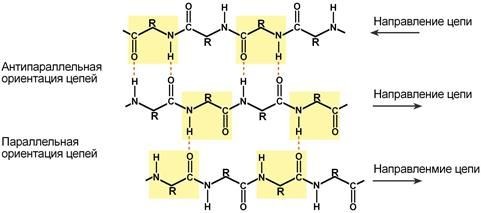
Укладкабелкаввидеβ-складчатогослоя
Под направлением белковой цепи понимают направление от N-конца (N-концевойаминокислоты)
к C-концу (С-концевой аминокислоте).
Ориентацияреагирующихучастковможетбытьпараллельна(когдасоседниецепиидутводном направлении)илиантипараллельна(цепиидутвпротивоположномнаправлении).Таких взаимодействующихдруг с другом участков одного белка может быть от двухдо пяти.
Третичнаяструктура–этоукладкаполипептиднойцепивглобулу("клубок").Четкойграницы междувторичной итретичнойструктурами провестинельзя, однаковосноветретичной структурылежатвзаимосвязимеждурадикаламиаминокислот,отстоящимидалекодруготдруга в цепи.Благодарятретичнойструктуре происходит еще более компактнаяукладка белковойцепи.
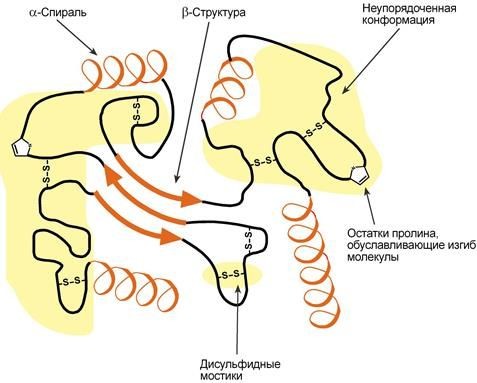
Схематичноепредставлениеукладкибелкавтретичнуюструктуру
Нарядус α-спиралью и β-структурой в третичной структуреобнаруживается так называемая неупорядоченная конформация, которая может занимать значительную часть молекулы. В разныхбелкахнаблюдаетсяразноесоотношениетиповструктур.Например,инсулинсодержит 52%α-спиралии6%β-структуры,трипсин–14%α-спиралии45%β-структуры.
Аминокислотыпринимаютучастиевформированиитретичнойструктуры,образуясвязисвоими функциональными группами (радикалами), например:
водородные–междуНО-,СООН-,NH2-группамирадикаловаминокислот,
дисульфидные–междуостаткамицистеина,
гидрофобные–междуостаткамиалифатическихиароматическихаминокислот,
ионные–междуСОО–-группамиглутаматаиаспартатаиNH3+-группамилизинаиаргинина,
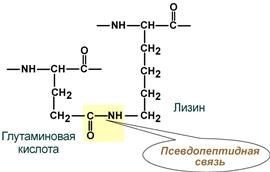 псевдопептидные–междудополнительнымиСОО–-группамиглутаматаиаспартатаи
дополнительными NH3+-группами
лизина и аргинина.
псевдопептидные–междудополнительнымиСОО–-группамиглутаматаиаспартатаи
дополнительными NH3+-группами
лизина и аргинина.
Еслибелкисостоятиздвухиболееполипептидныхцепей,связанныхмеждусобой нековалентными(не пептиднымии недисульфидными)связями,тоговорят, что они обладаютчетвертичной структурой.
Такиеагрегаты
стабилизируютсяводороднымисвязями,ионнымисвязямииэлектростатическимивзаимоде йствиями между остатками аминокислот, находящимися на поверхности глобулы.
Подобныебелкиназываютсяолигомерами,аихиндивидуальныецепи–
протомерами(мономерами,субъединицами).Еслибелкисодержат2протомера,тоони называются димерами, если 4, то тетрамерами и т.д.
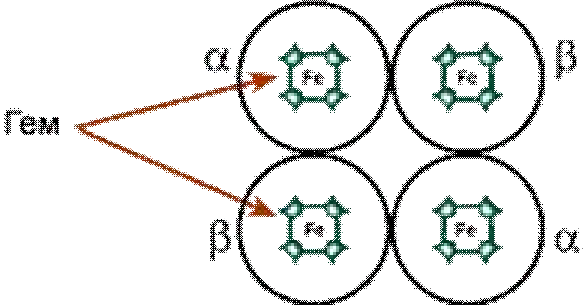 Например,гемоглобин–белокэритроцитов,переносящий
кислород, состоит из 4 гемсодержащих
субъединиц – 2 α-
субъединицыи2β-субъединицывгемоглобиневзрослых,2
α-субъединицы и 2 γ-субъединицы в
фетальномгемоглобине.
Например,гемоглобин–белокэритроцитов,переносящий
кислород, состоит из 4 гемсодержащих
субъединиц – 2 α-
субъединицыи2β-субъединицывгемоглобиневзрослых,2
α-субъединицы и 2 γ-субъединицы в
фетальномгемоглобине.
Лактатдегидрогеназа–фермент,принимающийактивное
участиевокисленииглюкозывбескислородныхусловиях, такжевключает 4субъединицы–Н (heart)и М(muscle)в разных сочетаниях: Н4, Н3М1, Н2М2, Н1М3, М4., всего 5изоферментов.
Строениететрамерагемоглобинавзрослых
Креатинкиназа–фермент, участвующий врегенерацииАТФпримышечномсокращении, состоитиз2субъединиц–В(brain)иМ(muscle)вразныхсочетаниях:ВВ,ВМ,ММ.Всего3изофермента.
Взаимодействиепротомеровдругсдругомосуществляетсяпопринципукомплементарности, т.е. их поверхностьподходит другдругу по геометрическойформе и пофункциональным группам аминокислот (возникновение ионных и водородныхсвязей).
Так как субъединицы в
олигомерах очень тесно взаимодействуют
между собой, то любое изменение
конформации какой-либо одной
субъединицыобязательновлечет
за собой изменение других субъединиц.
Этот эффект называетсякооперативное
взаимодействие.
Например, в легкиху гемоглобина кооперативное взаимодействие субъединицв 300 раз ускоряетприсоединениекислородакгемоглобину.Втканяхотдачакислородатакжеускоряется в 300 раз.
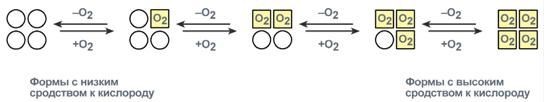
Схемакооперативноговзаимодействиясубъединицвгемоглобине
Классификацияпофункции
Всоответствиисбиологическимифункциямивыделяют:
структурныебелки (коллаген,кератин),
ферментативные(пепсин,амилаза),
транспортные(трансферрин,альбумин,гемоглобин),
резервно-пищевые(белки яицизлаков),
сократительныеидвигательные(актин,миозин,тубулин),
защитные(иммуноглобулины,тромбин,фибриноген),
регуляторные(соматотропныйгормон,адренокортикотропныйгормон,инсулин).
 Классификацияпостроению
Классификацияпостроению
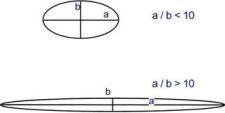
Взависимостиотформымолекулывыделяютглобулярныеи фибриллярные белки. Вглобулярныхбелкахсоотношение продольной и поперечной осей составляет менее 10 и в большинстве случаев не более 3-4. Эти белки характеризуются компактной трехмерной укладкой полипептидных цепей.
Например:инсулин,альбумин,глобулиныплазмыкрови.
Фибриллярные белкиимеют соотношение осей более 10. Они состоят из пучков полипептидныхцепей,спиральюнавитыхдругнадругаисвязанныемеждусобойпоперечными ковалентными и водородными связями. Выполняют защитную и структурную функции.
Например:кератин,миозин,коллаген.
Поколичествубелковыхцепейводноймолекулевыделяютмономерныебелки,которые имеют однусубъединицу(протомер) иполимерныебелки, имеющие несколько субъединиц. Например, кмономернымбелкам относятсяальбумины, миоглобин,
кполимерным-гемоглобин(4субъединицы), ферментылактатдегидрогеназаи
креатинкиназа(4и2субъединицы,соответственно),гексокиназа(2субъединицы).Субъединицы вбелкемогут бытькак одинакового,так и различногостроения.
Естьиболеекрупные белки.КнимотносятсяРНК-полимеразаE.coli–5цепей,аспартаткарбамоилтрансфераза – 12 протомеров, глутаминсинтетаза– 12
протомеров,пируватдегидрогеназа–72белковыхцепи.
Похимическомусоставувсебелкиподразделяютнапростыеисложные.Простыебелки содержат вструктуре толькоаминокислоты(альбумины,глобулины,гистоны, протамины).
Сложныебелки,кромеаминокислот,имеютнебелковыекомпоненты:
нуклеопротеины,
фосфопротеины,
металлопротеины,
липопротеины,
хромопротеины,
гликопротеины.
Фолдингбелков
Фолдинг –это процесс укладки вытянутойполипептидной цепи вправильную трехмерную пространственнуюструктуру.Дляобеспеченияфолдингаиспользуетсягруппавспомогательных белковподназваниемшапероны(chaperon,франц.–спутник,нянька).Онипредотвращают взаимодействие новосинтезированныхбелков друг с другом, изолируют гидрофобные участки белков от цитоплазмы и"убирают" ихвнутрь молекулы, правильно располагают белковыедомены.
Вцеломшапероныспособствуютпереходуструктурыбелковотпервичногоуровнядо третичного и четвертичного.
Принарушениифункциишапероновивотсутствиифолдингавклеткеформируютсябелковые отложения– развиваетсяамилоидоз. Насчитывают около 15 вариантов амилоидоза.
Чтобывыделитьбелкиизраствораилиразделитьбелкипофизико-химическимсвойствам достаточно удалить один или оба фактора, обеспечивающих ихрастворимость -
зарядигидратную оболочку.Таккакрастворимостьбелковзависит толькоот них,то исчезновение одного или обоихэтихфакторов ведет к полному или частичномуосаждению белкаи,конечно,кпотереегофункций.Некоторыеспособыосажденияпозволяютвпоследствии восстановить нативные свойства и работоспособность белков.
Обратимость осаждения белков обусловленасохранениемпервичной структуры белка. Восстановлениефизико-химическихибиологическихсвойствбелканазываетсяренативация (ренатурация). Иногда дляренативации достаточно просто удалить повреждающий агент.
Денатурация
Денатурация – необратимое осаждение белка из-за разрыва связей, стабилизирующих четвертичную,третичную, вторичную структуры белка, сопровождаемое изменениемрастворимости,вязкости, химическойактивности, снижением илиполной потерей биологической функции.
Физическаяденатурация
Вызываетсяповышениемтемпературы, ультрафиолетовыми микроволновымизлучением, механическими воздействиями, ионизацией заряженными частицами.
Химическаяденатурация
Зависитотприродыденатурирующегореагента:
кислотыищелочиобразуютводородныесвязиспептиднымигруппами,
органическиерастворители образуютводородныесвязи и вызываютдегидратацию,
алкалоидыобразуютсвязисполярнымигруппамииразрываютсистемуводородныхи ионныхсвязей,
тяжелыеметаллывзаимодействуютсзаряженнымирадикалами,нейтрализуют отрицательные заряды и разрывают систему водородных и ионных связей.
