
- •1. Одноатомные спирты. Перераспределение электронной плотности в молекуле при введении группы -он. Химические свойства. Представители: метанол, этанол, холестерин. Биороль.
- •5. Аминоспирты. Аминоэтанол. Холин и ацетилхолин. Аминофенолы: дофамин, норадреналин, адреналин. Понятие о биологической роли этих соединений.
- •7. Двухосновные карбоновые кислоты: щавелевая, малоновая, янтарная, глутарова, фумаровая. Взаимное влияние карбоксильных групп. Химические свойства.
- •8. Омыляемые липиды. Триоцилглицерины. Образование, гидролиз и гидрирование жиров. Определение степени ненасыщенности(йодное число). Высшее жирные кислоты, входящие в состав липидов. Мыла.
- •9. Омыляемые липиды. Фосфолипиды. Фосфатидные кислоты. Фосфатидилколомины(кефалины) и фосфатидилхолины(лецитины). Строение, биологическая роль.
- •11. Стереоизомерия молекул с двумя и более центрами хиральности на примере винной кислоты. Энантиомеры сигма-диастериомеры, мезоформы, рацематы.
- •13. Кетоновые тела, образование и выведение из организма. Образование лимонной кислоты с участием кофермента а.
- •1.По строению радикала.
- •2. По характеру радикала
- •3. По частоте обнаружения в белках
- •4. По способности синтезироваться в организме
- •21. Стереоизомеры моносахаридов на примере глюкозы: энантиомеры сигма-диастереомеры эпимеры. Цикло-оксо-таутомерия, аномеры. Биороль глюкозы
- •22. Химические свойства глюкозы: образование o- и n-гликозидов, реакции окисления и восстановления. Типы брожения. Формы существования в организме(фосфаты). Биороль продуктов реакций.
- •23. Дезоксисахара и аминосахара: дезоксирибоза, глюкозамин, галактозамин. Строение, биороль. N-гликозиды на примере тимидина.
- •24. Олигосахариды: мальтоза, лактоза. Строение, восстановительные свойства, гидролиз. Биороль
- •25. Гомополисахариды: крахмал, гликоген, целлюлоза, пектиновые вещества. Строение, тип связи, гидролиз. Биороль.
- •26. Гетерополисахариды: гиалуроновая кислота, хондроитинсульфаты. Строение, биороль. Представление о строении и роли гепарина.
- •27. Пиримидин и его производные: урацил, тимин, цитозин. Лактим-лактамная таутомерия. Биороль. 5-Фторурацил, применение.
- •28. Пурин. Аминопурины: аденин и гуанин. Лактим-лактамная таутомерия. Нуклеозиды, нуклеотиды. Амф, адф, атф, их строение и биологическая роль.
- •29. Нуклеиновые кислоты. Биороль. Нуклеиновые основания. Нуклеозиды. Нуклеотиды. Фрагмент цепи днк.
- •31. Вода. Строение молекулы, содержание в организме, роль воды и растворов в жизнедеятельности организмов.
- •32. Растворимость газов в жидкостях. Зависимость от природы газа, температуры, давления, присутствия электролитов. Законы Генри, Дальтона, Сеченова, формулировка и математическое выражение.
- •33. Закон Генри. Его физиологическое значение. Гипоксия, кессонная болезнь, гбо.
- •34. Коллигативные свойства. Давления насыщенного пара. Первый закон Рауля.
- •I закон Рауля
- •35. Диаграмма зависимости давления насыщенного пара от температуры. Изменения температуры кипения и замерзания растворов. Второй закон Рауля.
- •II закон Рауля
- •36. Второй закон Рауля. Криометрия. Расчёт осмотического давления по понижению температуры замерзания.
- •37. Осмос. Осмотическое давление. Закон Вант-Гоффа. Роль осмоса и осмотического давления в медицине.
- •38. Коллигативное свойство растворов электролитов. Изотонический коэффициент. Экспериментальное определение, связь со степенью диссоциации. Законы Рауля и Вант-Гоффа для растворов электролитов.
- •39. Биороль осмоса. Состав и осмотическое давление плазмы. Онкотическое давление.
- •40. Понятие изо-, гипер-, гипотонических растворов. Плазмолиз. Гемолиз. Примеры использования изо- и гипертонических растворов в медицине.
- •41. Слабые электролиты, степень и константа диссоциации. Закон разведения Оствальда, вывод, математическое выражение.
- •42. Сильные электролиты. Основные положения теории сильных электролитов. Активность. Коэффициент активности. Ионная сила растворов. Закон Дебая-Хюккеля.
- •43. Роль электролитов в жизнедеятельности организма. Электролитный состав биожидкостей. Водно-солевой баланс в норме.
- •44. Водно-солевой баланс в норме и при патологиях. Лечение при обезвоживании. Гипо- и гипергидратация, коррекция.
- •45. Ионное произведение воды. Водородный и гидроксильный показатели. Интервалы значений pH биожидкостей в норме.
- •46. Водородный показатель, его экспериментальное определение. Кислотность: активная, резервная, общая. Интервалы значений pH биожидкостей в норме и при патологиях.
- •47. Буферные растворы, буферные системы. Состав, классификация, зона буферного действия, механизм действия.
- •48. Состав и механизм действия ацетатной буферной системы. Вывод уравнения Гендерсона-Гассельбаха. Факторы, влияющие на pH буферного раствора.
- •49. Состав механизм действия аммиачной буферной системы. Вывод уравнения Гендерсона-Гассельбаха. Факторы, влияющие на pH буферного раствора.
- •50. Буферные системы крови. Состав и механизм действия гемоглобиновой и оксигемоглобиновой буферных систем.
- •51. Буферные системы плазмы крови. Состав и механизм буферного действия гидрокарбонатной буферной системы. Уравнение Гендерсона-Гассельбаха для расчёта pH плазмы.
- •52. Буферные системы крови. Механизм буферного действия на примере фосфатной буферной системы.
- •53. Состав и механизм действия белковой буферной системы при физиологических значениях ph.
- •54. Механизм совместного действия гидрокарбонатноя и гемоглобиновой буферных систем в организме.
- •55. Буферная ёмкость, её зависимость от различных факторов. Зона буферного действия.
- •56. Понятие о кислотно-основном состоянии. Вк и Вщ буферных систем организма. Основные показатели кос в норме. Ацидоз. Алкалоз. Коррекция.
1. Одноатомные спирты. Перераспределение электронной плотности в молекуле при введении группы -он. Химические свойства. Представители: метанол, этанол, холестерин. Биороль.
ОДНОАТОМНЫЕ СПИРТЫ.
СН3–OH метиловый спирт, метанол
СН3–СН2–OH этиловый спирт, этанол
СН3–СН2– СН2–OH пропиловый спирт, пропанол-1
H3C–CH(OH)–CH пропанол-2
Химические свойства.
1.Образование солей. Спирты взаимодействуют с Na с образованием алкоголятов. Спирты проявляют слабые кислые свойства и поэтому не взаимодействуют со щелочами. 2СН3СН2–OH + 2Na → 2СН3СН2–ONa + Н2 СН3СН2–OH + NаОН → реакция не идет
2. Образование простых эфиров (реакция межмолекулярной дегидратации), протекает в присутствии кислоты, чаще всего серной, при нагревании. СН3–OH + НО–СН3 → СН3–O–СН3 + Н2О диметиловый эфир
3. Образование сложных эфиров (реакция этерификации) СН3СОOH + НО–СН3 → СН3СОOСН3 + Н2О Уксусная кислота метиловый эфир этановой кислоты Этановая кислота
4. Реакция элиминирования (внутримолекулярной дегидратации), протекает в присутствии кислоты при нагревании. СН3СН2–OH → СН2 =СН2 + Н2О Этанол Этилен
5. Реакции окисления. Первичные спирты окисляются до альдегидов, вторичные – до кетонов. СН3СН2СН2–OH → СН3СН2СН(O) Первичный спирт альдегид СН3СН(ОН)СН3 → СН3С(О)СН3 Вторичный спирт кетон
6. Окисление спиртов в организме (in vivo) происходит под действием кофермента НАД+ до альдегидов и кетонов.
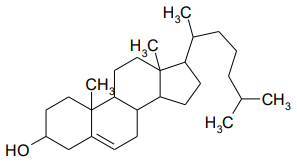
холестерин: Он синтезируется в печени из уксусной кислоты (80%), а также поступает с пищей (желток, печень, мозг) (20%). Холестерин является предшественником витамина Д3, стероидных гормонов (половых гормонов, глюкокортикоидов, минералкортикоидов), желчных кислот. При нарушении обмена холестерина он откладывается в сосудах в виде бляшек, что приводит к атеросклерозу.
2. Многоатомные спирты: этиленгликоль, глицерин, инозит. Особенности химического поведения вызванные взаимным влиянием функциональных групп. Качественная реакция на диольный фрагмент, сложные эфиры многоатомных спиртов.
Многоатомные спирты
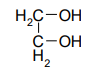
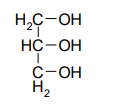
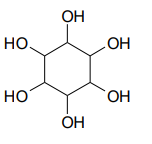
Этиленгликоль Глицерин Инозит
Химические свойства.
1. Многоатомные спирты проявляют те же свойства, что и одноатомные, но многоатомные спирты являются более сильными кислотами Бренстеда, чем одноатомные вследствие электроноакцепторного действия второй гидроксильной группы, поэтому они могут взаимодействовать с нерастворимым гидроксидом меди Сu(ОН)2 с образованием растворимого хелатного комплекса синего цвета. Это качественная реакция на диольный фрагмент.
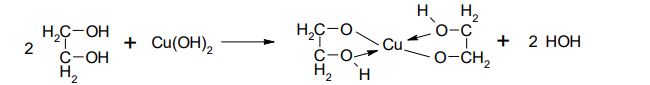
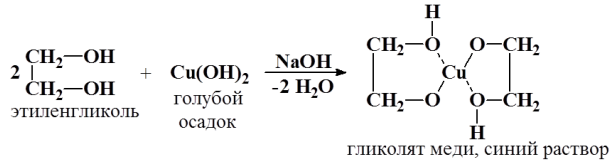
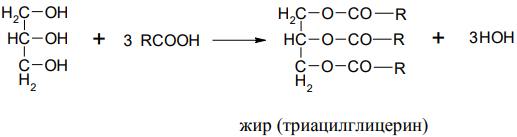
2. Очень важная реакция многоатомных спиртов – это образование сложных эфиров. Например, глицерин взаимодействует с азотной кислотой, фосфорной кислотой и высшими карбоновыми кислотами.
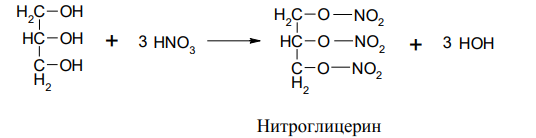
Нитроглицерин – это вещество взрывчато и токсично, но в виде 1%-раствора применяется как сосудорасширяющее средство.
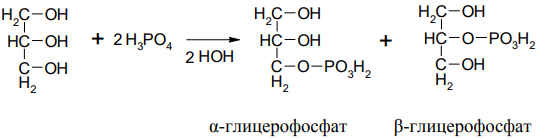
Глицерофосфары – структурные элементы фосфолипидов, применяются как общеукрепляющее средство.
Сложные эфиры глицерина и высших карбоновых кислот – жиры и масла.
3. Фенолы одно- и двух атомные. Особенности фенольного гидроксила. Химические свойства фенолов, применение в медицине. Система гидрохинон-хинон. Фенолы как антиоксиданты. Качественная реакция на фенольный гидроксил.
Фенолы. Фенолы – это спирты, в которых одна или несколько ОН групп связаны с бензольным кольцом.
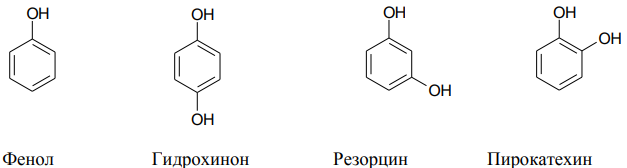
Фенол или карболовая кислота – первый антисептик, токсичен.
Гидрохинон (п-дигидроксифенол) применяется в фотографии как проявитель, в организме участвует в переносе электронов от субстрата к кислороду.
Резорцин (м-дигидроксифенол) используется при лечении кожных заболеваний в виде мазей.
Пирокатехин (о-дигидроксифенол, катехол) является структурным элементом биологически активных соединений (БАВ), например катехоламинов (дофамин, норадреналин, адреналин).
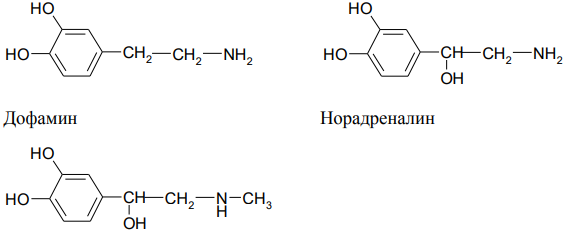
адреналин, участвует регуляции сердечной деятельности, обмена углеводов. Выделяется в кровь при физиологических стрессах («гормон страха»).
Химические свойства фенолов.
1.В отличие от спиртов фенолы проявляют слабые кислые свойства вследствие электроноакцепторного влияния бензольного кольца и взаимодействуют с сильными основаниями (щелочами), а со слабыми основаниями, например гидроксидом натрия, в реакцию не вступают.
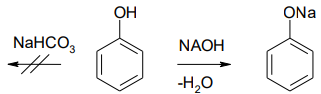
2.Фенолы с хлоридом железа (III) образуют устойчивые комплексные соединения железа разной окраски. Эта реакция используется как качественная на фенольный гидроксил.
С6Н5ОН + FeCl3 → (С6Н5О)3Fe + 3HCl Сине-фиолетовое окрашивание
3.Окисление фенолов. Двухатомные фенолы легко окисляются в хиноны. Хиноны - это сильные окислители. Система хинон – гидрохинон участвует в процессе переноса электронов от субстрата к кислороду воздуха.
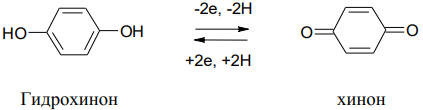
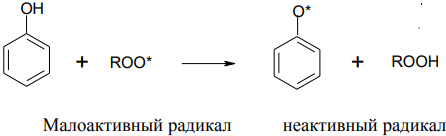
4.Фенолы являются антиоксидантами, они улавливают свободные радикалы, препятствуют пероксидному окислению липидов, которые образуют мембраны клеток. Их образно называют «ловушками радикалов», к ним относится, например, витамин Е (α-токоферол).
4. Тиоспирты. Кислотные свойства в сравнении с кислородными аналогами. Биологическая роль SH-группы. Кофермент А- важнейший тиоспирт организма. Биороль. 2,3-димеркаптопропанол и унитиол, применение в медицине.
Тиоспирты (тиолы). Тиоспирты – серусодержащие аналоги спиртов.
Общая формула R-SH,
функциональная группа SН – тиогруппа.
Представители:
CH3-SH метантиол
C2H5-SH этантиол
Химические свойства.
1.Тиолы – более сильные кислоты, чем алифатические спирты вследствие большой поляризуемости серы, поэтому они взаимодействуют не только с металлами, но и со щелочами, а также с оксидами тяжелых металлов.
2СН3СН2–SH + 2Na → 2СН3СН2–SNa + Н2
СН3СН2–SH + NаОН → СН3СН2–SNa + Н2O
СН3СН2–SH + HgО → (СН3СН2–S)2 Hg + Н2O
2.Тиолы легко окислятся в организме под действием слабых окислителей до дисульфидов. Этот процесс обратим. Эта обратимая реакция играет важную роль в окислительно-восстановительных процессах.
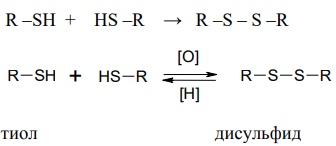
Дисульфидная связь имеет большое значение для формирования третичной структуры белков, ферментов, гормонов белковой природы, что определяет биологическую активность этих соединений.
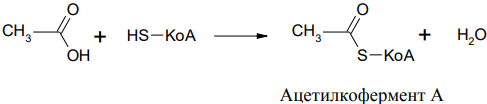
Кофермент реакций ацилирования – кофермент А, который обозначается KoA –SH, является тиолом и содержит SH группу, он играет важную роль в процессах обмена веществ, активирует карбоновые кислоты. Например, уксусная (этановая) кислота и кофермент А образуют тиоэфир, который называется ацетилкофермент А и переносит в организме (in vivo) ацетильные группы.
Вещества, содержащие SH группу, используют как антидоты (противоядия) при отравлении солями тяжелых металлов (Hg+2 , Pb+2 , As+2 , Cd+2).

