
Блок информации - иммунотерапия
.pdfИММУНОТЕРАПИЯ
Под иммунотерапией (ИТ) понимают различные терапевтические способы воздействия на систему иммунитета (СИ), основанные на использовании иммунологических принципов и методов, с целью лечения заболеваний.
Близко к понятию «иммунотерапия» стоит «иммунокоррекция».
Иммунокоррекция (ИК) – совокупность методов лечения, обеспечивающих исправление дефектов в СИ. Этим понятием подчеркивается целенаправленность применяемых средств на коррекцию, восстановление иммунореактивности, хотя эти средства и методы могут ничем не отличаться от иммунотерапевтических, однако иммунокоррекция включает и такие способы не терапевтического восстановления или угнетения иммунореактивности, как реконструктивные операции – пересадку органов и клеток системы иммунитета и, наоборот, удаление органов, клеток, молекул СИ у больных. Пересадки тимуса, костного мозга и особенно генная терапия иммунодефицитов (например, дефицита аденозиндезаминазы) – наиболее яркие примеры иммунокоррекции.
Иммунореабилитация (ИР) — комплекс иммунологических, иммунокоррегирующих, иммунопрофилактических, социальных, экологических, биомедицинских мероприятий, направленных на восстановление измененной иммунологической реактивности больного или популяции определенного контингента населения. На современном этапе иммунореабилитология уже рассматривается как самостоятельная наука, подразумевающая изучение процессов восстановления функциональной способности иммунной системы до физиологической нормы под воздействием комплекса лечебно-профилактических системных мероприятий для достижения полного выздоровления больного (при остром течении болезни) или стойкой клиникоиммунологической ремиссии при исчезновении или минимализации рецидивов (при хронической
ееформе) (9,11).
Внастоящее время выделяют специализированную и прикладную иммунореабилитацию. Специализированные иммунореабилитационные мероприятия применяют в тех случаях, когда симптомы иммунопатологического состояния превалируют в патогенезе заболевания (при трансплантационной болезни, аллергических и аутоиммунных заболеваниях, когда иммунопатология проявляется инфекционным, опухолевым или иммунопролиферативным синдромом). При этом иммунокоррекция занимает ведущее место, является обязательной и проводится только специалистами-иммунологами в рамках специализированных реабилитационных учреждений иммунологического профиля.
Прикладная (вторичная) иммунореабилитация используется при не столь выраженной симптоматике, когда лечение пациенты получают, как правило, на базе медицинских учреждений по профилю основного заболевания, но также могут пользоваться и консультацией специалистаиммунолога.
Следует отметить, что больные с нарушенной функцией иммунной системы требуют длительного, планомерного, дифференцированного и патогенетического лечения, соответствующего уровню выявленных клинико-иммунологических нарушений. ИР должна быть поэтапной, с применением на всех этапах иммунокорригирующих препаратов или методов, позволяющих нормализовать иммунный дисбаланс, и проходить обязательно под контролем иммунологического мониторирования.
При рецидивирующем течении она должна включать базисную, восстановительную и поддерживающую ИР, а также предусматривать ряд основных этапов. Первый этап — клинический (длительность от 14 до 45 дней) обычно проводится в условиях стационара с целью постановки достоверного клинического диагноза и установления степени иммунной патологии, либо в период обострения основного заболевания. Второй этап — амбулаторный, является самым длительным (до 3-х лет) и заключается в проведении восстановительного лечения в амбулаторных условиях (восстановительная иммунореабилитация). Третий этап — санаторно-курортный (ежегодный, не менее 24 дней в год). Это поддерживающая иммунореабилитация, которая проводится после исчезновения признаков обострения заболевания и может следовать за клиническим или амбулаторным этапами.
Лекарственные препараты, лечебный эффект которых связан с преимущественным (или селективным) действием на иммунную систему, называются иммунотропными (ИТП) (рис. 3.1).
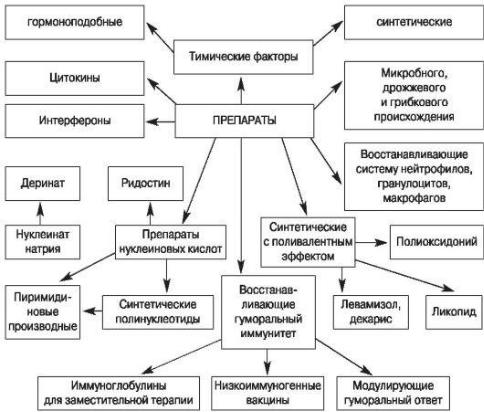
Часто такие свойства находят у препаратов, использующихся для лечения заболеваний, не связанных с иммунными нарушениями.
Назначение ИТП должно обосновываться:
1)клиническими и лабораторными данными, в том числе данными иммунограммы и специфических лабораторных методов обследования больного;
2)точным диагнозом, тяжестью заболевания и формой его течения – острого или хронического;
3)возрастом пациента (каждый возрастной период требует особых подходов к ИТ и ИР);
4)возможностью более широкого спектра воздействия на организм, чем то, о котором можно судить по происхождению и аннотационным данным ИТП.
.
Рис. 3.1. Классификация основных иммунотропных препаратов, используемых для восстановления нормального функционирования дефектной иммунной системы (10)
Необходимо помнить, что иммунная система имеет тонкие механизмы регуляции, с выраженными взаимозависимостью и взаимозаменяемостью компонентов, в связи с чем применение ИТП, независимо от исходной направленности и степени избирательности его действия, в конечном итоге вызовет многогранный эффект и повлияет на функционирование всей иммунной системы.
Взависимости от целей иммунотерапии и иммунокоррекции выделяют следующие группы:
1)иммунотерапия заболеваний с повышенной реактивностью (аллергические и аутоиммунные болезни);
2)иммунокоррекция первичных и вторичных иммунодефицитных болезней;
3)иммунотерапия опухолей и лимфопролиферативных заболеваний;
4)иммунотерапия посттрансплантационных реакций;
5)иммунокоррекция нарушений репродукции;
6)иммунотерапия некоторых инфекционных заболеваний.
Иммунотерапевтический эффект можно получить путем применения специфических препаратов (например, использование специфических аллергенов при АСИТ или специфических
иммуноглобулинов при лечении конкретных инфекционных заболеваний) или неспецифических средств.
По механизму действия различают активную ИТ, при которой иммунная система формирует активный иммунный ответ на введенный препарат, и пассивную ИТ, когда в организм вводят готовые факторы с иммунологической активностью (иммуноглобулины, сыворотки, цитокины).
В зависимости от типа используемых препаратов выделяют 2 основных подхода к ИТ:
1)медикаментозная ИТ (предполагает использование лекарственных препаратов, воздействующих на СИ);
2)иммунобиотерапия (использование агентов биологической природы, получаемых преимущественно с помощью современных биотехнологий и генноинженерных методов
моноклональных антител, |
рекомбинантных цитокинов |
и их агонистов в рамках |
антицитокиновой терапии, |
других молекул, а также клонированных клеток). |
|
Основные группы иммунотропных препаратов
По характеру эффекта на иммунную систему, который предполагается достигнуть, иммунотропные препараты подразделяют на:
иммуностимуляторы — лекарственные препараты, которые преимущественно усиливают иммунитет, доводя пониженные показатели до нормальных значений;
иммуномодуляторы — препараты, восстанавливающие в терапевтических дозах функции иммунной системы — нормализуют состояние иммунитета, повышая сниженные и, наоборот, снижая повышенные показатели иммунитета;
иммундепрессанты — препараты, подавляющие иммунный ответ.
Назначение иммуномодуляторов и иммуностимуляторов показано при лечении иммунодефицитов, прежде всего вторичных, при комплексной терапии хронических инфекционных заболеваний (в фазу ремиссии). Для лечения аллергических и аутоиммунных заболеваний нет препаратов, официально разрешенных к использованию.
3.1. Иммуномодуляторы
Выделяют следующие группы иммуномодуляторов
1.Препараты на основе природных факторов:
1)препараты, происходящие из организма человека и высших позвоночных:
препараты иммуноглобулинов (широко используются для заместительной терапии - обычно пожизненно, а также при лечении инфекционных заболеваний: иммуноглобулин человеческий, интраглобин*, октагам*, пентаглобин*, сандоглобулин* и др.);
пептидные препараты (пептиды тимуса и их аналоги, пептиды иной природы);
цитокины и их рецепторы (интерфероны и их индукторы, нерлейкины, растворимые рецепторы цитокинов);
2)препараты бактериального происхождения:
на основе клеточной стенки бактерий;
на основе нуклеиновых кислот;
прочие препараты микробного происхождения.
2.Cинтетические препараты:
1)циклические соединения;
2)полиэлектролиты;
3)синтетические аналоги природных иммуномодуляторов;
4)другие синтетические иммуномодуляторы.
Эндогенные пептиды (препараты тимического и костномозгового происхождения, а также синтетические аналоги гормонов тимуса)
Препараты этой группы первого поколения были созданы российскими учёными под руководством академика Р.В. Петрова из экстрактов тимуса и костного мозга — центральных органов иммунной системы. К препаратам, содержащим комплекс тимических пептидов, экстрагированных из тимуса крупного рогатого скота, относят тактивин, тималин, тимопоэтин; к препаратам, содержащим экстракты тимуса, - тимостимулин®, вилозен*. Препараты II и III
поколений представляют собой синтетические аналоги естественных гормонов тимуса или фрагментов этих гормонов, обладающих биологической активностью (тимопентин*, иммунофан* - на основе участков тимопоэтина, бестим* - аналог дипептида, входящего в комплекс тимических пептидов).
Главная мишень в организме для иммуномодуляторов тимического происхождения - Т- лимфоциты. При исходно пониженных показателях препараты этого ряда повышают количество Т- клеток и их функциональную активность за счет стимуляции дифференцировки и пролиферации предшественников Т-лимфоцитов в зрелые клетки, усиления продукции ими цитокинов, и как следствие — активация факторов врожденного иммунитета.
Мишенью фармакологического действия иммуномодулятора костномозгового происхождения миелопида* (комплекса биорегуляторных пептидных медиаторов, продуцируемых клетками костного мозга свиней) служат лимфоциты (в первую очередь В), и нейтрофилы, поскольку он вызывает усиление общей митотической активности клеток костного мозга, приводящей к усилению процессов лифо - и гранулоцитопоэза. В результате повышается образование зрелых форм соответствующих клеток, увеличивается их количество в периферической крови и функциональная активность. Наиболее выражена стимуляция гуморального иммунного ответа, сопровождаемая значительным повышением уровня антител даже на фоне облучения, действия цитостатиков и антибиотиков.
Цитокины
Область медицинского использования цитокинов узка, что обусловлено особенностями их физиологии: быстро выводятся из организма, оказывают местное действие, не обладают избирательностью действия и работают по принципу сети, в связи с чем введение экзогенного цитокина приводит обычно к усилению выработки практически всех компонентов сети, вызывая развитие побочных эффектов и осложнений.
Ранее других нашли медицинское применение интерфероны: α- и β-ИФН— при лечении вирусных инфекций, прежде всего вирусных гепатитов В и С, ИФН-β— для лечения рассеянного склероза, ИФН-α2 – злокачественных опухолей (применение с этой же целью ИЛ-2 приостановлено), факторы роста гемопоэтических клеток (гранулоцитарно-макрофагальные колониестимулирующие факторы ГМ-КСФ и Г-КСФ в составе соответственно препаратов молграмостим и филграстим) — для ститмуляции грануломиелопоэза и гранулопоэза, в том числе при лечении опухолей; для локального лечения злокачественных новообразований возможно применение перфузии ФНО-α.
Наиболее часто в практике используются препараты ИФН-α при лечении и профилактике вирусных инфекций:
1)природный - ИФН человеческий лейкоцитарный (из донорской крови человека);
2)рекомбинантные аналоги ИФН-α и β:
реальдирон* (ИФН-α 2в);
интрон А* (ИФН-α 2в);
реаферон*, виферон* (ИФН-α 2);
роферон-А* (ИФН-α 2а);
виферон (ИФН-α 2в, витамин Е, аскорбиновая кислота);
бетафеорон* (ИФН-β 1в).
Молекулы цитокинов служат основой для создания естественных препаратов, представляющих собой экстракты лейкоцитов, обогащенные цитокинами (лейкинферон — комплекс ИЛ-1, 6, 8, ИФН-α, ФНО-α; и близкий по составу суперлимф, в котором действующим началом, помимо цитокинов, являются дефензимы), и рекомбинантных препаратов (беталейкин, ронколейкин, молграмостин). В лечебных целях наиболее часто используются рекомбинантные формы. Основное фармакологическое свойство беталейкина* - усиление лейкопоэза и восстановление костномозгового кроветворения после действия цитостатиков и рентгеновского облучения; ронколейкина*, содержащего ИЛ-2 - активация и индукция пролиферации Т-клеток (в частности естественных Трег) и В-лимфоцитов.
Наиболее часто встречаются 4 типа осложнений цитокинотерапии: 1) гриппоподобный синдром;
2)шок, подобный септическому (в отсутствие бактериемии);
3)синдром протекания капилляров;
4)синдром наркотической зависимости.
Иммуномодуляторы микробного происхождения
Главная мишень для этой группы препаратов — фагоцитирующие клетки. Они усиливают поглотительную и микробицидную активность, продукцию провоспалительных и других групп цитокинов, экспрессию молекул МНС, что в свою очередь приводит к активации Т-лимфоцитов и формированию адаптивных форм иммунного ответа.
Условно их разделяют на препараты 3-х поколений:
1)вакцина БЦЖ (как стимулятор противоопухолевого иммунитета), полисахариды бактериального происхождения (пирогенал, продигиозан), имевшие множество побочных эффектов и использовавшиеся для активации антибактериального иммунитета;
2)лизаты бактерий, содержащие рибосомы условно-патогенных бактерий — частых возбудителей инфекционных заболеваний человека, применяемые одновременно в качестве вакцинных и иммустимулирующих препаратов (бронхомунал, ИРС-19, имудон и др.);
3)полусинтетические аналоги мурамилпептида клеточной стенки бактерий (ликопид).
Препараты нуклеиновых кислот микробного и животного происхождения
Иммуномодуляторы на основе бактериальных и дрожжевых нуклеиновых кислот используются как стимуляторы лейкопоэза и иммунитета. К ним относят нуклеинат натрия (натриевая соль нуклеиновой кислоты, полученная из дрожжей путём гидролиза и дальнейшей очистки), способствующий росту и размножению практически всех делящихся клеток, в том числе пролиферации Т- и В-лимфоцитов; ридостин* (РНК, выделенная из пекарских дрожжей). Мишенями среди клеток иммунной системы для данной группы препаратов являются клетки, несущие TLR-9 (в первую очередь клетки врожденного иммунитета, NK и В-лимфоциты).
К препаратам нуклеиновых кислот животного происхождения относят деринат* (натриевая соль нативной ДНК, выделенной из молок осетровых рыб), полудан* (высокоочищенная смесь натриевых солей ДНК и РНК, также получаемых из молок осетровых рыб). На основе нуклеиновых кислот разработан ряд синтетических препаратов, например полудан* - комплекс полиаденил-уридиловой кислоты. Условно к данной группе препаратов можно отнести инозин пранобекс (изопринозин*) - комплекс инозина с ацетиламидобензойной кислотой, метилурацил* и инозин (рибоксин*) - комплексное соединение, состоящее из гипоксантин-рибозида.
Все препараты из группы нуклеиновых кислот - выраженные индукторы интерферона. Однако следует иметь в виду, что синтетические и естественные препараты нуклеиновых кислот, содержащие предшественники ДНК и РНК, индуцируют рост и размножение не только эукариотических, но и прокариотических клеток. Так, для натрия нуклеината показана возможность стимуляции роста и размножения бактерий.
Синтетические иммуномодуляторы
Первые низкомолекулярные синтетические иммуномодуляторы первоначально были разработаны для других целей. Так, левамизол (декарис), был создан как противоглистный препарат. Его действие состоит в повышении функциональной активности Т-лимфоцитов, усилении экспрессии цитокиновых рецепторов, стимуляции выработки цитокинов. В связи с этим левамизол применялся при иммунотерапии опухолей и иммунодефицитных состояний на фоне хронических легочных процессов и т.д. Однако из-за токсичности препарат используют более ограниченно, чем раньше.
Диуцифон был первоначально апробирован как антилепрозный химиопрепарат. Он является костимулятором выработки ИЛ-2, эффективен при иммунодефицитных состояниях (включая ожоговую болезнь) и аллергических заболеваниях. Используется для адаптивной иммуноцитотерапии больных тяжелыми формами аллергических дерматитов.
К более современным низкомолекулярным синтетическим иммуномодуляторам можно отнести галавит (обладает противовоспалительными свойствами, ингибируя функциональнометаболическую активность макрофагов, в частности, избыточную продукцию фактора некроза опухолей, интерлейкина-1, активных форм кислорода и других провоспалительных цитокинов, определяющих степень воспалительных реакций, их цикличность, а также выраженность интоксикации), гепон (препарат с преимущественно противовирусным действием за счет индукции синтеза ИФН-α, β), глутоксим (представитель класса тимопоэтинов, оказывает модулирующее действие на внутриклеточные процессы тиолового обмена, стимулируя гемопоэз, восстанавливая функцию поверхностных рецепторов клеток; имеет высокую тропность к клеткам центральных органов иммунитета и системы лимфоидной ткани), аллоферон (эффективный индуктор синтеза эндогенных интерферонов и активатор системы естественных киллеров).
Высокомолекулярные, химически чистые иммуномодуляторам на основе полиэлектролитов, полученные с помощью направленного химического синтеза, были созданы в Институте иммунологии МЗ РФ в процессе проведения исследований в области синтетических вакцин. Микробные эпитопы в комплексе с полиэлектролитными носителями являются сильными вакцинирующими препаратами. В связи с этим были изучены собственные адъювантные свойства полиэлектролитов, и они были использованы в качестве самостоятельных иммуномодулирующих препаратов. В медицинскую практику внедрен препарат полиоксидоний. Основной мишенью препарата являются макрофаги и В-лимфоциты, а главным результатом использования — усиление гуморального иммунитета. Применение препарата показано при вторичных иммунодефицитных состояниях на фоне хронических воспалительных процессов, злокачественных опухолях, цитотоксической терапии (включая облучение), послеоперационных состояниях, ожоговой и других травмах. В комплексе лечебных средств его рекомендуют использовать также при лечении аллергических и вирусных заболеваний.
Индукторы ИФН
Особую группу иммуномодуляторов составляют индукторы ИФН. Они являются препаратами с комбинированным эффектом: этиотропным, направленным непосредственно на вирус-возбудитель, и иммуномодулирующим. Это разнородная по составу группа высоко- и низкомолекулярных природных и синтетических соединений, объединенных способностью вызывать в организме образование собственного эндогенного интерферона всех иммунологических классов (α, β и γ) в разных пропорциях. Хорошо сочетаются друг с другом, рекомбинантными ИФН-α, иммуномодуляторами и химиотерапевтическими средствами. Комбинированное применение обычно приводит к потенцированию эффектов индукторов интерферонов. Наиболее часто используются синтетические препараты: арбидол*, амиксин*, циклоферон*, неовир*; из природных - полифенолы растительного происхождения.
Индукторы интерферонов имеют ряд преимуществ перед рекомбинантными ИФН:
1)не обладают антигенностью;
2)стимулированный синтез эндогеннного интерферона не вызывает гиперинтерферонемии и соответственно связанных с ней побочных эффектов (в отличие от рекомбинантных ИФН);
3)однократное введение индукторов интерферонов обеспечивает длительную циркуляцию интерферонов на терапевтическом уровне, в то время как для достижения такого уровня экзогенных интерферонов требуется многократное введение высоких доз рекомбинантных ИФН;
4)рекомбинантные ИФН, принимая участие в иммунных реакциях организма, стимулируют неспецифическую цитотоксичность иммуноцитов и вызывают экспрессию молекул МНС в тех популяциях клеток, для которых это не характерно в отсутствии воспаления; данного эффекта, способного стать причиной усугубления аутоиммунного ответа организма, лишены индукторы ИФН;
5)некоторые индукторы интерферона (амиксин) обладают уникальной способностью запускать синтез интерферона в определенных популяциях клеток, что предпочтительнее, чем поликлональная стимуляция иммуноцитов рекомбинантными ИФН;
6)широко применяемые рекомбинантные ИФН являются препаратами α-интерферона, что существенно ограничивает их противовирусные свойства, так как для эффективной противовирусной защиты необходимо наличие всех трех классов интерферонов, синтез которых вызывается индукторами интерфероногенеза.
Препараты растительного происхождения
В настоящее время за рубежом весьма широко для стимуляции иммунитета используют препараты растительного происхождения, в частности различные производные эхинацеи пурпурной. Некоторые из этих препаратов - иммунал*, эхинацин ликвидум*, эхинацея композитум С, эхинацея-ВИЛАР* - зарегистрированы в России как иммуностимуляторы. Однако препараты подобного рода более целесообразно относить к биологически активным добавкам или адаптогенам типа женьшеня, элеутерококка, пантокрина* и др. Все эти соединения в той или иной степени обладают иммуностимулирующим эффектом, но вряд ли их можно отнести к ЛС, обладающим селективным действием на иммунную систему человека.
3.2. Иммунодепрессанты
Иммунодепрессанты - лекарственные средства, угнетающие иммунологические реакции организма. Их применение обосновано в трансплантологии, при терапии многих форм аутоиммунных и аллергических, лимфопролиферативных заболеваний.
Иммунодепрессанты в зависимости от механизмов действия подразделяют на:
1)подавляющие иммунный ответ в целом - за счет угнетения процессов роста и размножения клеток либо разных тканей организма, в т. ч. злокачественно перерожденных, либо избирательно лимфоцитов (цитостатики);
2)оказывающие специфическое иммунодепрессивное действие (например, антилимфоцитарная сыворотка);
3)устраняющие воспалительные реакции, сопровождающие иммунные процессы, обладающие выраженным противовоспалительным и лишь частично иммунодепрессивным действием (глюкокортикоиды, антицитокиновые препараты).
Особенно выраженная иммунодепрессивная активность присуща химическим цитостатикам. Препараты этой группы первого поколения (азатиоприн, циклофосфамид, метотрексат и др.) являются антиметаболитами, в основном структурными аналогами азотистых оснований, входящих в состав нуклеотидов, аналогов фолиевой кислоты и нарушают процесс репликации ДНК, приводя клетку к гибели; не обладают избирательностью действия, влияя на все делящиеся клетки организма; в настоящее время используются ограниченно.
В последнее время созданы новые ксенобиотики, превосходящие по цитостатическому эффекту ранее применявшиеся. К ним относятся лефлюпомид, мизорибин, микофенолат мофетил, бреквинар, Более современными препаратами являются иммунофилин-связывающие агенты - циклоспорин (первоначально полученный из почвенного гриба и в дальнейшем синтезированный химически) и его функциональные аналоги (такролимус, ранее называемый FK 506 - препарат, выделенный из стрептомицет, химически синтезированный и относимый к антибиотикам группы макролидов). Они имеют существенные преимущества перед другими группами иммунодепрессантов, поскольку действуют прицельно на активируемые Т-клетки, блокируя трансдукцию и клеточный цикл, нарушая их активацию, но не повреждая сами лимфоциты. Особенно эффективны при формировании у пациентов аллергии Т-клеточного типа. Иным механизмом действия, приводящим к сходному результату, обладает антибиотик рапамицин (сирулим), также выделенный из стрептомицет.
Антицитокиновая терапия
Это новый подход к лечению преимущественно аутоиммунных заболеваний, основанный на применении биологических генно-инженерных препаратов — антагонистов цитокинов), избирательно блокирующих ключевые элементы воспалительной реакции. Возможно использование рекомбинантных аналогов природных белков - рецепторных антагонистов ИЛ-1, растворимые рецепторы для ФНО-α, а также гуманизированные моноклональные антитела к ФНО- α, блокирующих его на мембране клеток и/или в сыворотке крови. На сегодняшний день антицитокиновая терапия - достаточно дорогостоящий метод. В России первый антицитокиновой препарат был официально зарегистрирован в 2001 году; более доступной для российских пациентов антицитокиновая терапия стала в 2006 г. в связи с введением государственной программы дополнительного лекарственного обеспечения и др.
Другая важная область использования лечебных препаратов на основе моноклональных
антител — онкология, в особенности лечение лейкозов. Эти препараты способны с высокой специфичностью взаимодействовать с теми или иными молекулярными мишенями в опухоли, эксперессированными на поверхности опухолевой клетки с достаточной плотностью, чтобы вызвать элиминацию клетки путем:
комплментзависимого цитолиза;
фагоцитоза опсониррованной клетки;
антителозависимого контактного цитолиза.
Наиболее яркий пример успешного лечения хронического В-клеточного лимфолейкоза является препарат мабтера (на основе моноклональных антител (МкАТ) класса IgG к СD20 — одному из основных маркеров В-лимфоцитов, а также САМРАТН — к молекуле СD52). Все МкАТ, используемые в иммунотерапии, исходно являются мышиными, но с помощью генно-инженерных процедур все их составные части (кроме V-гена) гуманизированы (заменены на человеческие). Такие процедуры необходимы для снижения иммуногенности МкАТ, то есть образования в ответ на их введение нейтрализующих антител, и тем самым предотвращение при последующих введениях препарата его быстрой нейтрализации и снижения эффективности.
Наиболее важными факторами, мешающими эффективному использованию моноклональных антител, являются гетерогенность опухолевой массы и иммуногенность антител. Гетерогенность опухоли означает, что далеко не все опухолевые клетки могут содержать антиген, против которого направлено данное специфичное антитело. Кроме того, вследствие генетической нестабильности в опухолевых клетках часто происходят мутации, в том числе связанные с поверхностными антигенами. В результате часть клеток легко «ускользает» от терапевтического действия данного моноклонального антитела. Это a priori не позволяет обеспечивать 100% эффективность при использовании моноклональных антител и является причиной их главного парадокса: основное достоинство антител - их специфичность, но чем специфичнее антитело, тем больше шансов у опухолевых клеток избежать их влияния.
Для лечения солидных опухолей разрабатывают препараты иммунотоксинов — молекул, совмещающих прицельность антител и цитотоксичность растительных токсинов.
Одним из перспективных направлений иммунобиотерапии также является цитотерапия и генотерапия злокачественных опухолей, являющиеся альтернативой небезопасной цитокинотерапии. Оно основано на использовании собственных клеток иммунной системы, обработанных цитокинами invitro, с последующим введением в организм уже активированных аутологичных клеток, более интенсивно лизирующих опухолевые. Такое направление получило название адоптивной иммуноцитотерапии. Известно 3 вариантов клеток, используемых с данной целью: LAK (NK-клетки, стимулированные invitro цитокинами), CIK (мононуклеары, активировнные моноклональными антителами к СD3, с добавлением смеси цитокинов, обеспечивающих избирательную пролиферацию только Т-лимфоцитов и их дифференцировку в ЦТЛ), TIL-клетки (T-лимфоциты, инфильтрирующие опухоль).
Для лечения опухолевых заболеваний также разрабатываются комбинация методов цитотерапии и генотерапии. Принцип их заключается в переносе клеток, в которые предварительно трансфецированы гены, кодирующие вещества с противоопухолевой активностью (чаще всего, цитокинов - ИФН-γ, ФНО-α, ИЛ-1, 12), в опухолевую ткань.
Изолированно генотерапию используют при лечении ПИД, в частности, некоторых видов ТКИН (в аутологичные клетки костного мозга больного вне организма встраивают ген, восполняющие дефект, после чего их трансплантируют в организм).
Еще одним интенсивно разрабатывающимся направлением иммунобиотерапии является использование лечебных вакцин на основе дендритных клеток разных типов и разной степени зрелости (в зависимости от целей использования вакцины). ДК культивируют invitro в присутствии ростовых цитокинов и РАМР-содержащих стимуляторов, а также антигенов — потенциально протективных молекул, против которых будет направлено действие препарата. Предполагается возможность использования подобных вакцин при лечении злокачественных опухолей, аутоиммунных и аллергических заболеваний.
