
- •Занятие 1. Биохимия соединительной и костной ткани
- •Фибриллярные белки соединительной ткани: коллаген, эластин, их строение, аминокислотный состав, отличительные особенности, функции. Представление о десмозине.
- •Этапы синтеза коллагена. Внутриклеточные реакции гидроксилирования и гликозилирования, роль ионов железа и аскорбиновой кислоты. Внеклеточное формирование коллагенового волокна.
- •Витамин с, пищевые источники, суточная потребность, биохимические функции, характерные признаки недостаточности.
- •Гликозаминогликаны, виды, особенности строения, свойства, функции. Гликопротеины и протеогликаны.
- •Н еколлагеновые белки соединительной ткани. Фибронектин, строение, функция, лиганды, места связывания. Рецептор к фибронектину.
- •Костная ткань: структура, минеральные и органические вещества кости. Значение цитрата для костной ткани.
- •Минерализация костной ткани. Регуляция остеогенеза, минерализации и деминерализации.
- •Паратиреиодный гормон, его роль в метаболизме костной ткани. Кальцитонин и витамин д. Роль в регуляции фосфорно-кальциевого обмена кости.
Занятие 1. Биохимия соединительной и костной ткани
Фибриллярные белки соединительной ткани: коллаген, эластин, их строение, аминокислотный состав, отличительные особенности, функции. Представление о десмозине.
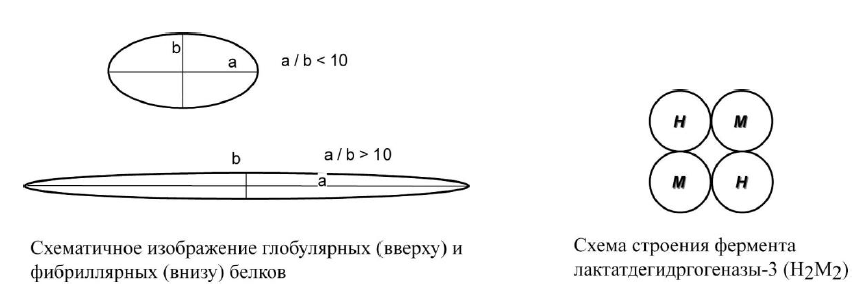
Фибриллярные – соотношение осей >10. Они состоят из пучков полипептидных цепей, спиралью навитых друг на друга и связанные между собой поперечными ковалентными и водородными связями. Выполняют защитную и структурную функции. Например, кератин, миозин, коллаген.
КОЛЛАГЕН
Фибриллярный белок с уникальной структурой. Составляет основу межклеточного вещества соединительной ткани сухожилий, кости, хряща, кожи, но имеется, конечно, и в других тканях.
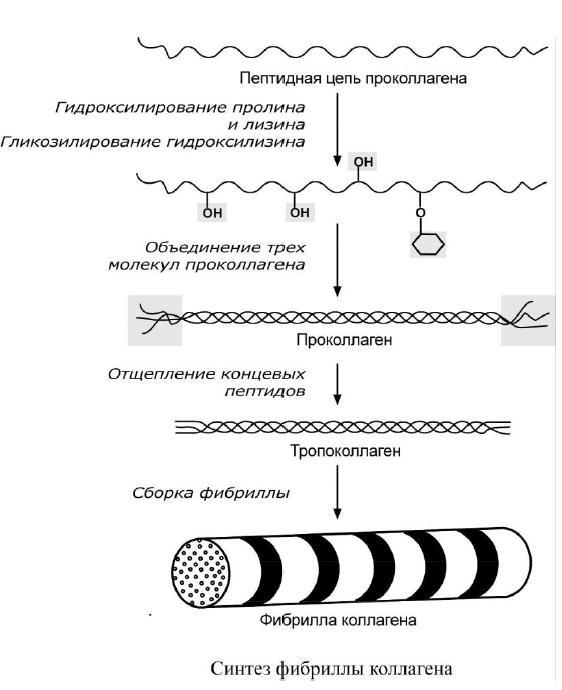
Полипептидная цепь коллагена включает 1000 аминокислот и носит название α-цепь. Насчитывается около 30 вариантов α-цепи коллагена, но все они обладают одним общим признаком – в большей или меньшей степени включают повторяющийся триплет [Гли-Х-Y], где X и Y – любые, кроме глицина, аминокислоты. В положении X чаще находится пролин или, гораздо реже, 3-оксипролин, в положении Y встречается пролин и 4-оксипролин. Также в положении Y часто находится аланин, лизин и 5-оксилизин. На другие аминокислоты приходится около трети от всего количества аминокислот. Гидроксилирование пролина и лизина осуществляют соответствующие гидроксилазы, железосодержащие ферменты, для их полноценной работы необходим витамин С (аскорбиновая кислота).
Структура пролина и оксипролина не позволяет образовать α -спиральную структуру, из-за этого образуется левозакрученная спираль, где на один виток приходится 3 аминокислотных остатка. Коллаген обычно содержит моносахаридные (галактоза) и дисахаридные (глю-коза-галактоза) молекулы, соединенные с ОН-группами некоторых остатков оксилизина.
Молекула тропоколлагена построена из 3 α-цепей, сплетенных между собой в плотный жгут – тропоколлаген (длина 300 нм, диаметр 1,6 нм). Полипептидные цепи прочно связаны между собой через α-аминогруппы остатков лизина. Тропоколлаген формирует крупные коллагеновые фибриллы диаметром 10-300 нм. Поперечная исчерченность фибриллы обусловлена смещением молекул тропоколлагена друг относительно друга на 1/4 их длины.
Время полужизни коллагена исчисляется неделями и месяцами. Ключевую роль в его обмене играет коллагеназа, расщепляющая тропоколлаген на 1/4 расстояния с С-конца между глицином и лейцином. В результате распада коллагена появляется свободный гидроксипролин. При поражении соединительной ткани (болезнь Пейджета, гиперпаратиреоидизм) экскреция гидроксипролина возрастает и имеет диагностическое значение.
 По
мере старения организма в тропоколлагене
образуется все большее число поперечных
связей, что делает фибриллы коллагена
в соединительной ткани более жесткими
и хрупкими. Это ведет к повышенной
ломкости кости и снижению прозрачности
роговицы глаза в старческом возрасте.
По
мере старения организма в тропоколлагене
образуется все большее число поперечных
связей, что делает фибриллы коллагена
в соединительной ткани более жесткими
и хрупкими. Это ведет к повышенной
ломкости кости и снижению прозрачности
роговицы глаза в старческом возрасте.
ЭЛАСТИН
По строению в общих чертах эластин схож с коллагеном. Находится в связках, эластичном слое сосудов. Структурной единицей является тропоэластин с молекулярной массой 72 кДа и длиной 800 аминокислотных остатков. В нем гораздо больше лизина, валина, аланина и меньше гидроксипролина. Отсутствие пролина обусловливает наличие спиральных эластичных участков.
 Характерной
особенностью эластина является
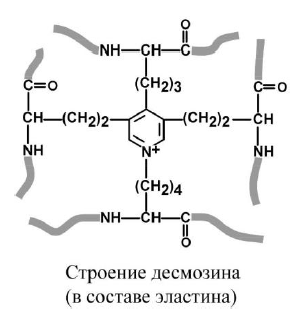
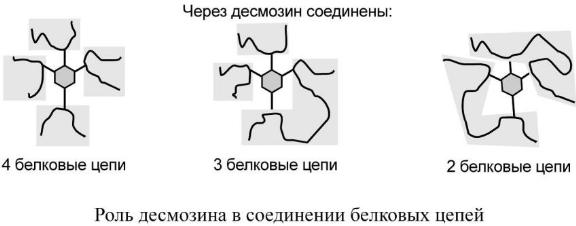
формирование из четырех молекул лизина
своеобразной структуры – десмозина,
который своими 4-мя группами объединяет
белковые цепи в системы, способные
растягиваться во всех направлениях.
α-Аминогруппы
и α-карбоксильные
группы десмозина включаются в пептидные
связи одной или нескольких белковых
цепей.
Характерной
особенностью эластина является
формирование из четырех молекул лизина
своеобразной структуры – десмозина,
который своими 4-мя группами объединяет
белковые цепи в системы, способные
растягиваться во всех направлениях.
α-Аминогруппы
и α-карбоксильные
группы десмозина включаются в пептидные
связи одной или нескольких белковых
цепей.
Общим для эластина и коллагена является большое содержание глицина и пролина, наличие оксипролина, хотя последнего в эластине примерно в 10 раз меньше, чем в коллагене. Как и в коллагене, в эластине мало метионина и отсутствуют триптафан и цистеин. В отличие от коллагена в эластине значительно больше валина и аланина и меньше глутаминовой кислоты и аргинина.В межклеточном пространстве молекулы эластина образуют волокна и слои, в которых полипептидные цепи связаны множеством жестких поперечных сшивок в разветвленную сеть: четыре остатка лизина, соединяясь своими радикалами, образуют замещенное пиридиновое кольцо.
