
- •Занятие 3. Адреналин, глюкагон, соматотропный гормон, глюкокортикоиды Вопросы для аудиторной работы:
- •Характеристика глюкагона: регуляция синтеза и секреции, химическая структура, механизм действия, органы-мишени, влияние на обмен веществ – регулируемые ферменты и процессы.
- •Мишени и эффекты. Α1-Адренорецепторы
- •Патология. Гиперфункция
- •Соматотропный гормон: регуляция синтеза и секреции, химическая структура, органы-мишени,
- •Пептиды проопиомеланокортина
Занятие 3. Адреналин, глюкагон, соматотропный гормон, глюкокортикоиды Вопросы для аудиторной работы:
Характеристика глюкагона: регуляция синтеза и секреции, химическая структура, механизм действия, органы-мишени, влияние на обмен веществ – регулируемые ферменты и процессы.
Строение. Представляет собой полипептид, включающий 29 аминокислот с молекулярной массой 3,5 кДа и периодом полураспада 3-6 мин.
Синтез. Осуществляется в клетках поджелудочной железы и в клетках тонкого кишечника.
(из лекции). Глюкагон синтезируется как часть большого белка-предшественника, называемого проглюкагон. Проглюкагон образуется в α-клетках островков Лангерганса в поджелудочной железе и в L-клетках кишечника. Он содержит несколько связанных пептидов: связанный с глицинтином; связанный с глюкагоноподобным пептидом 1 (GLP-1) и 2 (GLP-2). Глюкагон отщепляется от проглюкагона в поджелудочной железе и составляет от 30 до 40% иммунореактивного глюкагона крови. Оставшаяся иммунореактивность вызвана другими продуктами расщепления проглюкагона, выделяющимися из поджелудочной железы и кишечника. Панкреатический глюкагон имеет период полураспада - от 3 до 6 минут. В плазме крови глюкагон не связан с каким-либо транспортным белком и выводится в основном печенью и почками.
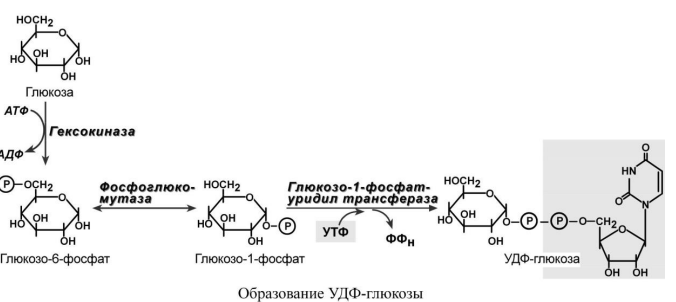
 По
Тимину. Синтез гликогена начинается с
образования глюкозо-6-фосфата под
действием глюкокиназы в печени или
других гексокиназ в остальных тканях.
Как уже говорилось, глюкокиназа обладает
низким сродством к глюкозе, и в гепатоцитах
глюкоза будет задерживаться только при
ее высоких концентрациях. Непосредственно
синтез гликогена осуществляют следующие
ферменты: 1. Фосфоглюкомутаза – превращает
глюкозо-6-фосфат в глюкозо-1-фосфат. 2.
Глюкозо-1-фосфат-уридилтрансфераза –
фермент, осуществляющий ключевую реакцию
синтеза. Необратимость этой реакции
обеспечивается гидролизом образующегося
дифосфата.
По
Тимину. Синтез гликогена начинается с
образования глюкозо-6-фосфата под
действием глюкокиназы в печени или
других гексокиназ в остальных тканях.
Как уже говорилось, глюкокиназа обладает
низким сродством к глюкозе, и в гепатоцитах
глюкоза будет задерживаться только при
ее высоких концентрациях. Непосредственно
синтез гликогена осуществляют следующие
ферменты: 1. Фосфоглюкомутаза – превращает
глюкозо-6-фосфат в глюкозо-1-фосфат. 2.
Глюкозо-1-фосфат-уридилтрансфераза –
фермент, осуществляющий ключевую реакцию
синтеза. Необратимость этой реакции
обеспечивается гидролизом образующегося
дифосфата.
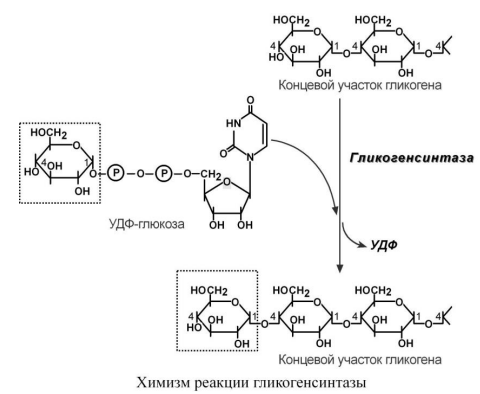
3. Гликогенсинтаза – образует α1,4-гликозидные связи и удлиняет гликогеновую цепочку, присоединяя активированный С1 УДФ-глюкозы к С4-глюкозы на концевом участке гликогена.
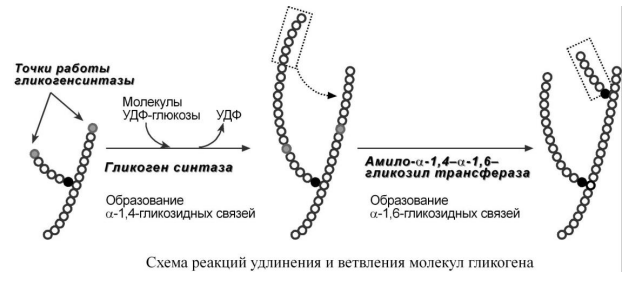
4. Амило-1,4-1,6-гликозилтрансфераза, "гликоген-ветвящий" фермент – переносит фрагмент с минимальной длиной в 6 остатков глюкозы на соседнюю цепь с образованием 1,6-гликозидной связи.
Регуляция синтеза и секреции: активируют: гипогликемия, адреналин; уменьшают: глюкоза, жирные кислоты.
(из лекции). Главный регулятор синтеза и секреции глюкагона является концентрация глюкозы в крови по принципу обратной связи. Также: Повышают: аминокислоты (аланин, аргинин), жирные кислоты, кетоновые тела и нейромедиаторы. Голодание и физическая нагрузка (вследствие аминацедемии). Снижают: GLP-1. Стимулятором секреции GLP-1 служит желудочный ингибирующий полипептид (из клеток слизистой оболочки верхних отделов тонкого кишечника), секреция которого стимулируется глюкозой.
По Тимину. Метаболизм гликогена в печени регулируется несколькими гормонами, одни из которых активируют ферменты синтеза гликогена, а другие – ферменты распада гликогена. Основные ферменты метаболизма гликогена активны либо в фосфорилированной, либо в дефосфорилированной форме. Присоединение фосфатов к ферментам производят протеинкиназы, источником фосфата является АТФ:
фосфорилаза гликогена активируется после присоединения фосфатной группы,
синтаза гликогена после присоединения фосфата инактивируется.
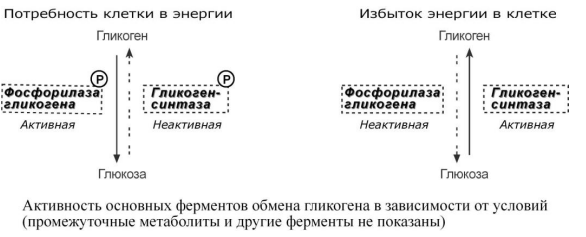 Фосфорилирование
указанных ферментов начинается после
воздействия на клетку адреналина,
глюкагона и некоторых других гормонов.
В результате адреналин и глюкагон
вызывают гликогенолиз, активируя
фосфорилазу гликогена. Дефосфорилирование
этих ферментов осуществляют
протеинфосфатазы. Активатором
протеинфосфатаз, через сложный
внутриклеточный механизм передачи
сигнала, выступает инсулин. Таким
способом инсулин запускает синтез
гликогена за счет быстрой активации
гликогенсинтазы и инактивации
гликогенфосфорилазы.
Фосфорилирование
указанных ферментов начинается после
воздействия на клетку адреналина,
глюкагона и некоторых других гормонов.
В результате адреналин и глюкагон
вызывают гликогенолиз, активируя
фосфорилазу гликогена. Дефосфорилирование
этих ферментов осуществляют
протеинфосфатазы. Активатором
протеинфосфатаз, через сложный
внутриклеточный механизм передачи
сигнала, выступает инсулин. Таким
способом инсулин запускает синтез
гликогена за счет быстрой активации
гликогенсинтазы и инактивации
гликогенфосфорилазы.
Одновременно инсулин и глюкокортикоиды увеличивают синтез гликогена, увеличивая количество молекул гликогенсинтазы. Для регуляции активности фосфорилазы и синтазы гликогена используется особый каскадный аденилатциклазный механизм.
Скорость гликогенолиза лимитируется только скоростью работы фосфорилазы гликогена. Ее активность может изменяться тремя способами: ковалентная модификация, кальций-зависимая активация, аллостерическая активация с помощью АМФ
 Механизм
действия. Аденилатциклазный.
Механизм
действия. Аденилатциклазный.
Мишени и эффекты. Конечным эффектом является повышение концентрации глюкозы и жирных кислот в крови.
Жировая ткань: повышает активность внутриклеточной гормон-чувствительной липазы и, соответственно, стимулирует липолиз.
Печень: активация глюконеогенеза и гликогенолиза, за счет повышенного поступления жирных кислот из жировой ткани усиливает кетогенез.
Глюкагон стимулирует высвобождение инсулина из β-клеток поджелудочной железы. Стимулируемое глюкагоном выделение инсулина, скорее всего, необходимо для поддержания уровня глюкозы в крови в физиологическом диапазоне.
Патология. Гиперфункция. Глюкагонома – редко встречающееся новообразование из группы нейроэндокринных опухолей. У больных отмечается гипергликемия и поражение кожи и слизистых оболочек.
Глюкагонома – опухоль поджелудочной железы, происходящая из альфа-клеток, секретирующая глюкагон, приводящая к развитию гипергликемии и характерной сыпи. Диагностика основана на выявлении повышенного содержания глюкагона в крови и данных методов визуализации. Локализацию опухоли устанавливают с помощью КТ и эндоскопической ультрасонографии. Лечение подразумевает проведение резекции.
Глюкагон является гормоном, секретируемым поджелудочной железой в норме, когда понижается уровень глюкозы в крови. Он симулирует гликогенолиз в печени и, таким образом, повышает уровень глюкозы в крови.
Глюкагономы - это вид эндокринной опухоли поджелудочной железы, которая возникает из альфа-клеток поджелудочной железы. Они встречаются очень редко и схожи с другими опухолями островков в том, что первичный и метастатические очаги характеризуются медленным ростом: 15-летняя выживаемость достаточно высока. Большинство глюкагоном являются злокачественными.
Средний возраст, в котором проявляются симптомы, составляет 50 лет; 80% больных – женщины. Некоторые пациенты имеют множественную эндокринную неоплазию 1-го типа.
По Тимину.
Гликогеновые болезни.
Это наследственные заболевания, обусловленные недостаточностью каких-либо ферментов, отвечающих за метаболизм гликогена. Средняя частота встречаемости составляет 1:40000.
Гликогенозы. Синдром гликогеноза возникает в результате дефекта фермента синтеза или мобилизации гликогена, что приводит к накоплению или изменению структуры гликогена в разных тканях, чаще в печени и мышцах. В настоящее время гликогенозы делят по патогенетическому признаку на печеночные, мышечные и смешанные формы. Всего существует 12 типов гликогенозов. По патогенетическому признаку гликогенозы делят: • печеночные – 0, I, III, IV, VI, VIII, IX, Х, ХI типов, • мышечные – V и VII типов, • смешанные – II типа.
Печёночные гликогенозы. Гликогеноз I типа или болезнь фон Гирке обусловлен аутосомно-рецессивным дефектом глюкозо-6-фосфатазы. Из-за того, что этот фермент есть только в печени и почках, преимущественно страдают эти органы, и болезнь носит еще одно название – гепаторенальный гликогеноз. Даже у новорожденных детей наблюдаются гепатомегалия и нефромегалия, обусловленные накоплением гликогена не только в цитоплазме, но и в ядрах клеток. Кроме этого, активируется синтез липидов с возникновением стеатоза печени. Так как фермент необходим для дефосфорилирования глюкозо-6-фосфата с последующим выходом глюкозы в кровь, у больных отмечается гипогликемия, и, как следствие, ацетонемия, метаболический ацидоз, ацетонурия.
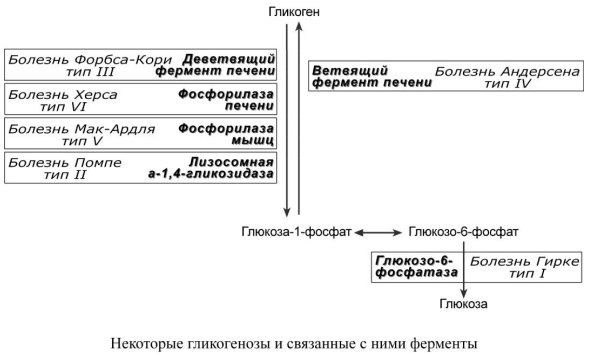 Гликогеноз
III типа или болезнь Форбса-Кори или
лимит-декстриноз – это аутосомно-рецессивный
дефект амило-α1,6-глюкозидазы, "деветвящего"
фермента, гидролизующего α1,6-гликозидную
связь. Болезнь имеет более доброкачественное
течение, и частота ее составляет примерно
25% от всех гликогенозов. Для больных
характерна гепатомегалия, умеренная
задержка физического развития, в
подростковом возрасте возможна небольшая
миопатия.
Гликогеноз
III типа или болезнь Форбса-Кори или
лимит-декстриноз – это аутосомно-рецессивный
дефект амило-α1,6-глюкозидазы, "деветвящего"
фермента, гидролизующего α1,6-гликозидную
связь. Болезнь имеет более доброкачественное
течение, и частота ее составляет примерно
25% от всех гликогенозов. Для больных
характерна гепатомегалия, умеренная
задержка физического развития, в
подростковом возрасте возможна небольшая
миопатия.
При гликогенозе IV типа (болезнь Андерсена, 1% всех гликогенозов), связанного с дефектом ветвящего фермента, образуется гликоген с короткими цепочками и резко уменьшается скорость гликогенолиза.
Гликогеноз VI типа (болезнь Херса, 25% всех гликогенозов), связан с дефицитом печеночной фосфорилазы гликогена. При этом отсутствует мобилизация гликогена, развивается гепатомегалия и гипогликемия.
Мышечные гликогенозы.
Для этой группы гликогенозов характерны изменения ферментов мышечной ткани. Это приводит к нарушению энергообеспечения мышц при физической нагрузке, к болям в мышцах, судорогам. Гликогеноз V типа (болезнь Мак-Ардля, 1% всех гликогенозов) – отсутствие мышечной фосфорилазы. При тяжелой мышечной нагрузке возникают судороги, миоглобинурия, хотя легкая работа не вызывает каких-либо проблем.
Смешанные гликогенозы. Эти заболевания касаются и печени, и мышц, и других органов. Гликогеноз II типа (болезнь Помпе, 10% всех гликогенозов) – поражаются все гликогенсодержащие клетки из-за отсутствия лизосомальной α1,4-глюкозидазы. Происходит накопление гликогена в лизосомах и в цитоплазме. Заболевание является наиболее злокачественным. Больные умирают в грудном возрасте из-за кардиомегалии и тяжелой сердечной недостаточности.
Агликогенозы. Агликогенозы – состояния, связанные с отсутствием гликогена. В качестве примера агликогеноза можно привести наследственный аутосомно-рецессивный дефицит гликоген-синтазы. Симптомами является резкая гипогликемия натощак, особенно утром, появляется рвота, судороги, потеря сознания. В результате гипогликемии наблюдается задержка психомоторного развития, умственная отсталость. Болезнь несмертельна при адекватном лечении (частое кормление), хотя и опасна.
Характеристика адреналина: химическая структура, регуляция синтеза и секреции, реакции синтеза, адренергические рецепторы, их распределение, механизм действия в зависимости от рецептора, органы-мишени, влияние на обмен веществ в зависимости от рецептора – регулируемые ферменты и процессы, гипо- и гиперфункция – метаболические нарушения, связь функции гормона с характерными клиническими проявлениями. Основы лечения.
Строение. Гормоны надпочечников адреналин и норадреналин под общим названием катехоламины представляют собой производные аминокислоты тирозина. Роль адреналина является гормональной, норадреналин преимущественно является нейромедиатором.
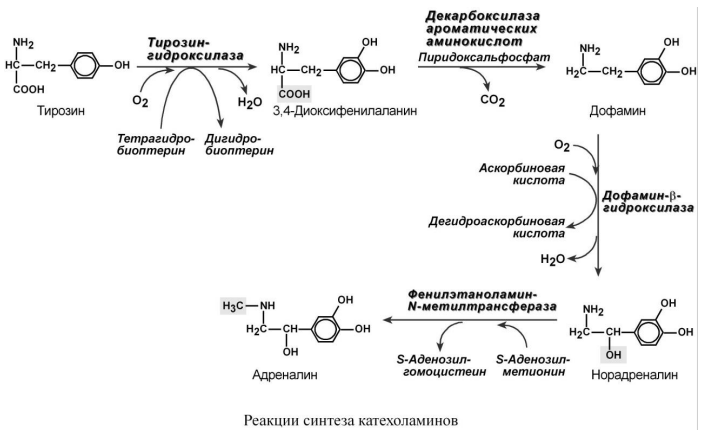 Синтез.
Осуществляется
в клетках мозгового слоя надпочечников
(80% всего адреналина), синтез норадреналина
(80%) происходит также в нервных синапсах.
Синтез.
Осуществляется
в клетках мозгового слоя надпочечников
(80% всего адреналина), синтез норадреналина
(80%) происходит также в нервных синапсах.
Регуляция синтеза и секреции. Активируют: стимуляция чревного нерва, стресс. Уменьшают: гормоны щитовидной железы.
(из лекции) Синтез катехоламинов в мозговом веществе надпочечников контролируется сывороточной концентрацией аминокислоты тирозина. Секреция А и НА из мозгового вещества надпочечников стимулируется различными стрессами (включая боль, кровоизлияние, физические упражнения и тд) и опосредуется стресс-индуцированной передачей нервных импульсов, исходящих из адренергических ядер в гипоталамусе.
Эти импульсы стимулируют высвобождение нейротрансмиттера ацетилхолина из преганглионарных нейронов, которые иннервируют адреномедуллярные клетки. Ацетилхолин деполяризует плазматические мембраны этих клеток, обеспечивая быстрое поступление внеклеточного Ca2+ в цитозоль, а он стимулирует высвобождение адреналина и норадреналина из гранул хромафинных клеток во внеклеточное пространство экзоцитозом
Механизм действия. Механизм действия гормонов разный в зависимости от рецептора. Степень активности рецептора может изменяться в зависимости от концентрации соответствующего лиганда. Например, в жировой ткани при низких концентрациях адреналина более активны α2-адренорецепторы, при повышенных концентрациях (стресс) – стимулируются β1-, β2-, β3-адренорецепторы.
Адренорецепторы расположены на пре- и постсинаптических мембранах, на клеточной мембране вне синапса. Их типы неравномерно распределены по разным органам. При этом орган может иметь либо рецепторы только одного типа, либо нескольких типов. Конечный адренергический эффект зависит: от преобладания типа рецепторов в органе/ткани, от преобладания типа рецепторов на конкретной клетке, от концентрации гормона в крови, от состояния симпатической нервной системы.
Кальций-фосфолипидный механизм: при возбуждении α1-адренорецепторов.
Аденилатциклазный механизм при задействовании α2-адренорецепторов аденилатциклаза ингибируется, при задействовании β1- и β2-адренорецепторов аденилатциклаза активируется.
