
- •1. Основные пути образования аммиака в тканях. Реакции дезаминирования биогенных аминов, аденозина, гуанина, аминокислот.
- •3. Транспортные формы аммиака в крови (глутамин, аспарагин, аланин). Реакции их образования. Глюкозо-аланиновый цикл.
- •4. Роль печени, почек и кишечника в связывании и выведении аммиака.
- •6. Гипераммониемии, их причины и последствия. Нормальный и предельно допустимый уровень концентрации аммиака в крови. Причины токсичности аммиака.
- •10. Реакции превращения тирозина в диоксифенилаланин, дофамин, норадреналин и адреналин.
- •11. Нарушение анаболической функции тирозина – альбинизм и паркинсонизм. Молекулярные причины, биохимические основы патогенеза, характерные особенности заболеваний, основы лечения.
Занятие 2: Образование продуктов азотистого обмена. Обезвреживание аммиака. Метаболизм отдельных аминокислот.
Вопросы внеаудиторной работы: 1. Строение нуклеозидов и нуклеотидов. Пуриновые и пиримидиновые азотистые основания.
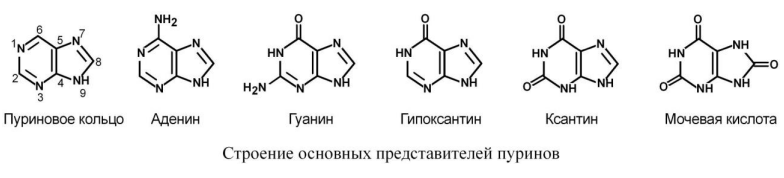 Пуриновые
нуклеотиды.
Пуриновые
нуклеотиды.
 К
пуриновым азотистым основаниям относят
аденин и гуанин. Гипоксантин, ксантин
и мочевая кислота являются конечными
продуктами обмена пуринов в организме
человека и большинства млекопитающих
и птиц.
К
пуриновым азотистым основаниям относят
аденин и гуанин. Гипоксантин, ксантин
и мочевая кислота являются конечными
продуктами обмена пуринов в организме
человека и большинства млекопитающих
и птиц.
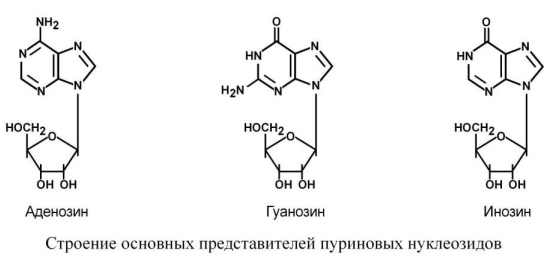
На основе азотистых оснований синтезируются нуклеозиды, представляющие собой комбинацию азотистого основания и рибозы (или дезоксирибозы).
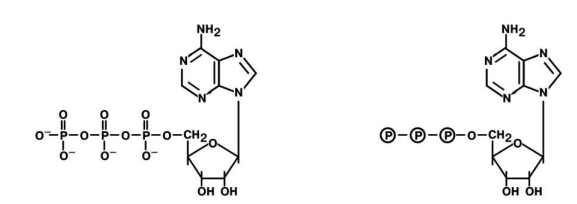
Присоединением одного, двух или трех остатков фосфорной кислоты к нуклеозиду достигается образование соответственно нуклеозид(моно-,ди-,три)фосфатов.
 Синтез
пуриновых оснований происходит во
всех клетках организма, главным образом
в печени. Исключение составляют
эритроциты, полиморфноядерные лейкоциты,
лимфоциты. Условно все реакции синтеза
можно разделить на 4 этапа: 1. Синтез
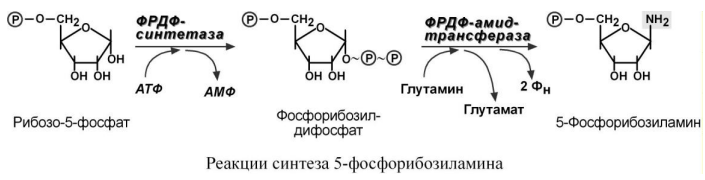
5'-фосфорибозиламина. Рибозо-5-фосфат
является тем якорем, на основе которого
синтезируется сложный пуриновый цикл.
Первая реакция синтеза пуринов заключается
в активации углерода в первом положении
рибозо-5-фосфата, это достигается синтезом
5-фосфорибозил-1-дифосфата (ФРДФ). Вторая
реакция – это перенос NH2-группы глутамина
на активированный атом С1 рибозо-5-фосфата
с образованием 5-фосфорибозиламина.
Указанная NH2-группа фосфорибозиламина
уже принадлежит будущему пуриновому
кольцу и ее азот будет атомом номер 9.
Синтез
пуриновых оснований происходит во
всех клетках организма, главным образом
в печени. Исключение составляют
эритроциты, полиморфноядерные лейкоциты,
лимфоциты. Условно все реакции синтеза
можно разделить на 4 этапа: 1. Синтез
5'-фосфорибозиламина. Рибозо-5-фосфат
является тем якорем, на основе которого
синтезируется сложный пуриновый цикл.
Первая реакция синтеза пуринов заключается
в активации углерода в первом положении
рибозо-5-фосфата, это достигается синтезом
5-фосфорибозил-1-дифосфата (ФРДФ). Вторая
реакция – это перенос NH2-группы глутамина
на активированный атом С1 рибозо-5-фосфата
с образованием 5-фосфорибозиламина.
Указанная NH2-группа фосфорибозиламина
уже принадлежит будущему пуриновому
кольцу и ее азот будет атомом номер 9.
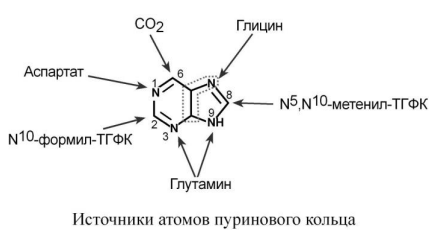
2. Синтез инозинмонофосфата (ИМФ). 5-фосфорибозиламин вовлекается в девять реакций, и в результате образуется первый пуриновый нуклеотид – инозинмонофосфорная кислота (ИМФ). В этих реакциях источниками атомов пуринового кольца являются глицин, аспартат, еще одна молекула глутамина, углекислый газ и производные ТГФК. В целом на синтез пуринового кольца затрачивается энергия 6 молекул АТФ.
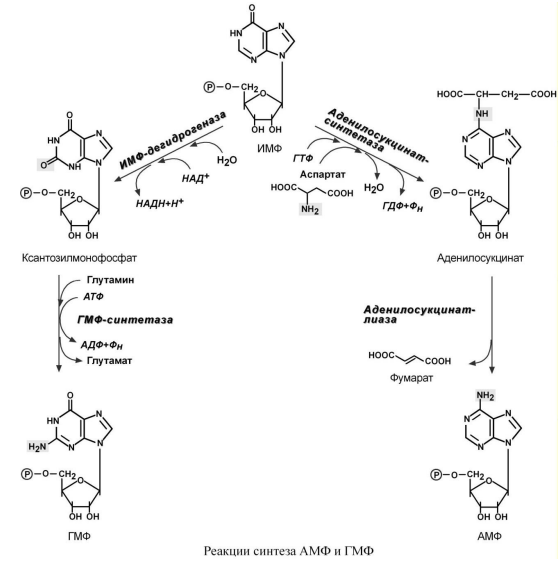 3.
Синтез аденозинмонофосфата (АМФ) и
гуанозинмонофосфата (ГМФ). ГМФ образуется
в двух реакциях – сначала ИМФ окисляется
ИМФ-дегидрогеназой до ксантозилмонофосфата,
источником кислорода является вода,
акцептором водорода – НАД. После этого
работает ГМФ-синтетаза, она использует
универсальный клеточный донор NH2-групп
– глутамин, источником энергии для
реакции служит АТФ. АМФ также образуется
в двух реакциях, но в качестве донора
NH2-группы выступает аспарагиновая
кислота. В первой, аденилосукцинат-синтетазной,
реакции на присоединение аспартата
используется энергия распада ГТФ, во
второй реакции аденилосукцинат-лиаза
производит удаление части аспарагиновой
кислоты в виде фумарата.
3.
Синтез аденозинмонофосфата (АМФ) и
гуанозинмонофосфата (ГМФ). ГМФ образуется
в двух реакциях – сначала ИМФ окисляется
ИМФ-дегидрогеназой до ксантозилмонофосфата,
источником кислорода является вода,
акцептором водорода – НАД. После этого
работает ГМФ-синтетаза, она использует
универсальный клеточный донор NH2-групп
– глутамин, источником энергии для
реакции служит АТФ. АМФ также образуется
в двух реакциях, но в качестве донора
NH2-группы выступает аспарагиновая
кислота. В первой, аденилосукцинат-синтетазной,
реакции на присоединение аспартата
используется энергия распада ГТФ, во
второй реакции аденилосукцинат-лиаза
производит удаление части аспарагиновой
кислоты в виде фумарата.
4. Образование нуклеозидтрифосфатов АТФ и ГТФ. Синтез ГТФ осуществляется в 2 стадии посредством переноса макроэргических фосфатных групп от АТФ.
Синтез АТФ происходит несколько иначе. АДФ из АМФ образуется также за счет макроэргических связей АТФ. Для синтеза же АТФ из АДФ в митохондриях есть фермент АТФ-синтаза, образующий АТФ в реакциях окислительного фосфорилирования.
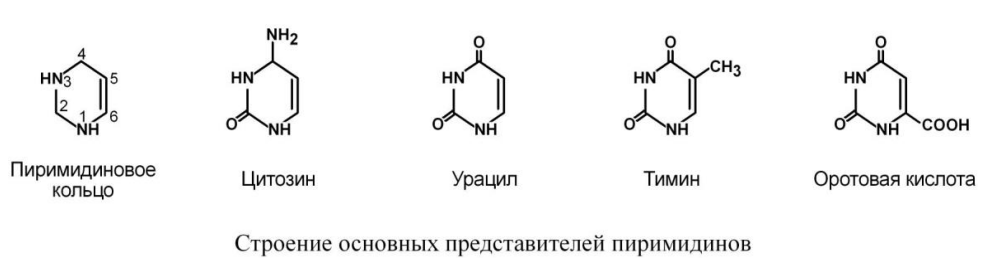
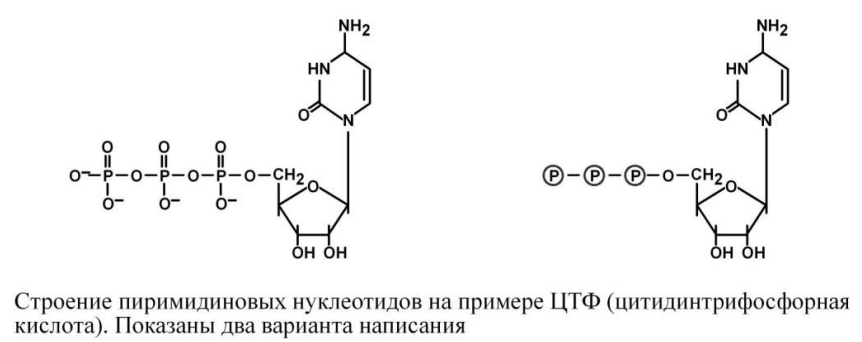
Пиримидиновые основания.
К пиримидиновым азотистым основаниям относят тимин, цитозин и урацил.
На основе азотистых оснований синтезируются нуклеозиды, представляющие собой комбинацию азотистого основания и рибозы (или дезоксирибозы).
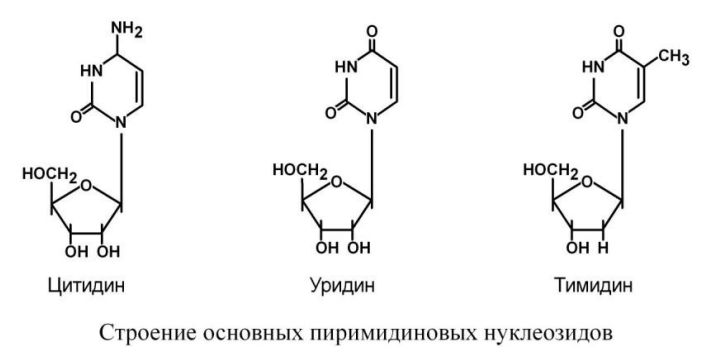
Присоединением одного, двух или трех остатков фосфорной кислоты к нуклеозиду достигается образование соответственно нуклеозид(моно-, ди-, три)фосфатов.
Синтез перимидиновых оснований.
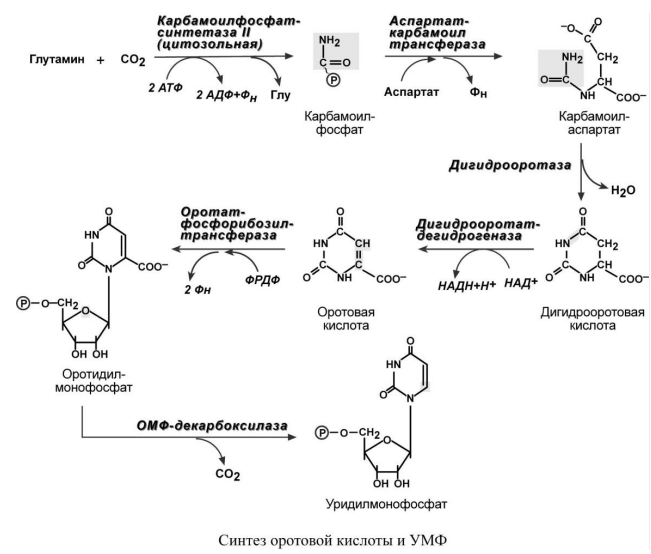 Синтез
пиримидиновых оснований происходит во
всех клетках организма. В реакциях
синтеза участвует глутамин, СО2, аспартат,
затрачивается 2 молекулы АТФ. Условно
можно выделить этапы синтеза: 1. Образование
карбамоилфосфата, эта реакция идет в
цитозоле. Источником аминогруппы
выступает глутамин.
Синтез
пиримидиновых оснований происходит во
всех клетках организма. В реакциях
синтеза участвует глутамин, СО2, аспартат,
затрачивается 2 молекулы АТФ. Условно
можно выделить этапы синтеза: 1. Образование
карбамоилфосфата, эта реакция идет в
цитозоле. Источником аминогруппы
выступает глутамин.
 2.
Образование пиримидинового кольца
после присоединения аспарагиновой
кислоты и реакции дегидратации. Первым
пиримидиновым основанием является
оротовая кислота. 3. Синтез оротидилмонофосфата
и уридинмонофосфорной кислоты (УМФ). В
реакции с фосфорибозилдифосфатом (ФРДФ)
к оротовой кислоте присоединяется
рибозо-5-фосфат и образуется
оротидилмонофосфат, непосредственный
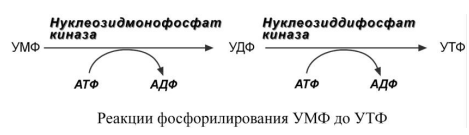
предшественник УМФ. 4. Синтез УТФ
осуществляется в 2 стадии посредством
переноса макроэргических фосфатных
групп от АТФ.
2.
Образование пиримидинового кольца
после присоединения аспарагиновой
кислоты и реакции дегидратации. Первым
пиримидиновым основанием является
оротовая кислота. 3. Синтез оротидилмонофосфата
и уридинмонофосфорной кислоты (УМФ). В
реакции с фосфорибозилдифосфатом (ФРДФ)
к оротовой кислоте присоединяется
рибозо-5-фосфат и образуется
оротидилмонофосфат, непосредственный
предшественник УМФ. 4. Синтез УТФ
осуществляется в 2 стадии посредством
переноса макроэргических фосфатных
групп от АТФ.
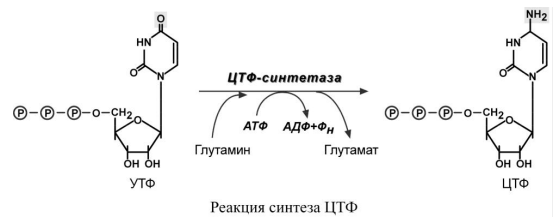 5.
Синтез ЦТФ происходит из УТФ с затратой
энергии АТФ при участии глутамина,
являющегося источником NH2-группы.
5.
Синтез ЦТФ происходит из УТФ с затратой
энергии АТФ при участии глутамина,
являющегося источником NH2-группы.
Вопросы для аудиторной работы.
1. Основные пути образования аммиака в тканях. Реакции дезаминирования биогенных аминов, аденозина, гуанина, аминокислот.
Аммиак постоянно образуется во всех органах и тканях организма. Наиболее активными его продуцентами в кровь являются органы с высоким обменом аминокислот и биогенных аминов – нервная ткань, печень, кишечник, мышцы.
Основными источниками аммиака являются следующие реакции:
внутримолекулярное дезаминирование гистидина, катаболизм некоторых аминокислот (серина, треонина, глицина) – в печени,
окислительное дезаминирование глутаминовой кислоты во всех тканях (кроме мышечной), особенно в печени и почках,
дезаминирование амидов глутаминовой и аспарагиновой кислот – в печени и почках,
катаболизм биогенных аминов – во всех тканях, в наибольшей степени в нервной ткани,
жизнедеятельность бактерий толстого кишечника,
распад пуриновых и пиримидиновых оснований – во всех тканях.
2.Основные способы связывания аммиака в клетках: восстановительное аминирование (реаминирование), фермент, значение реакции; образование амидов глутаминовой и аспарагиновой кислот, химизм, локализация, биологическое значение; синтез карбамоилфосфата, его значение в митохондрии и цитозоле.
Для удаления аммиака из организма используется включение его в состав мочевины в печени и выведение ее с мочой, и удаление почками в виде аммонийных солей.
Однако, так как аммиак является чрезвычайно токсичным соединением, то предварительно в тканях (!) происходят реакции его обезвреживания (временного связывания) для переноса в печень и почки. – синтез глутаминовой кислоты и глутамина, синтез аспарагина:
синтез глутаминовой кислоты (восстановительное аминирование) – взаимодействие α-кетоглутарата с аммиаком. Реакция по сути обратна реакции окислительного дезаминирования, однако в качестве кофермента используется НАДФН. Происходит практически во всех тканях, кроме мышечной, но имеет небольшое значение, т.к. для глутаматдегидрогеназы предпочтительным субстратом является глутаминовая кислота и равновесие реакции сдвинуто в сторону α-кетоглутарата,
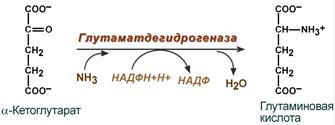 Реакция
синтеза глутаминовой кислоты
Реакция
синтеза глутаминовой кислоты
синтез глутамина – взаимодействие глутамата с аммиаком. Является главным способом уборки аммиака, наиболее активно происходит в нервной и мышечной тканях, в почках, сетчатке глаза, печени. Реакция протекает в митохондриях.
Реакция синтеза глутамина
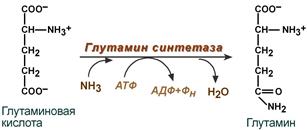 Образование
большого количества глутамина обеспечивает
высокие концентрации его в крови (0,5-0,7
ммоль/л).
Образование
большого количества глутамина обеспечивает
высокие концентрации его в крови (0,5-0,7
ммоль/л).
Так как глутамин проникает через клеточные мембраны путем облегченной диффузии, то он легко попадает не только в гепатоциты, но и в другие клетки, где есть потребность в аминогруппах. Азот, переносимый глутамином, используется клетками для синтеза пуринового кольца и гуанозинмонофосфата (ГМФ), синтеза цитидинтрифосфата (ЦТФ), аспарагина, глюкозамино-6-фосфата (предшественник всех остальных аминосахаров).
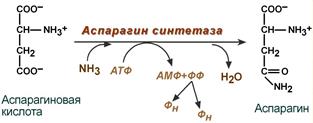 Реакция синтеза аспаргина.
Реакция синтеза аспаргина.
синтез аспарагина – взаимодействие аспартата с аммиаком. Является второстепенным способом уборки аммиака, энергетически невыгоден, т.к. при этом тратятся 2 макроэргические связи,
Синтез мочевины
В печени весь удаляемый аммиак используется для синтеза мочевины. Увеличение синтеза мочевины наблюдается при распаде тканевых белков и азотистых соединений (голодание, воспалительные процессы, сахарный диабет) или при избыточном белковом питании. У младенцев и детей синтез мочевины может быть снижен по двум причинам: незрелость печени и активный синтез белков и нуклеиновых кислот при росте организма. Определение концентрации мочевины в крови является ценным диагностическим показателем.
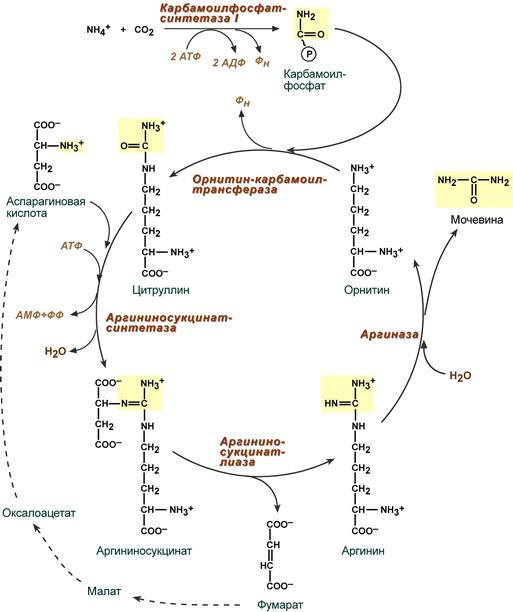 Реакции
синтеза мочевины являются циклическим
процессом и получили название орнитиновый
цикл. Синтез мочевины начинается в
митохондриях (первая и вторая реакции),
оставшиеся три реакции идут в цитозоле.
Для переноса цитруллина и орнитина
через митохондриальную мембрану
существуют специальные переносчики.
Реакции
синтеза мочевины являются циклическим
процессом и получили название орнитиновый
цикл. Синтез мочевины начинается в
митохондриях (первая и вторая реакции),
оставшиеся три реакции идут в цитозоле.
Для переноса цитруллина и орнитина
через митохондриальную мембрану
существуют специальные переносчики.
В образовании одной молекулы мочевины участвует 1 молекула NH4+, 1 молекула CO2, аминогруппа 1 молекулы аспарагиновой кислоты, затрачивается 4 макроэргических связи трех молекул АТФ.
Реакция синтеза карбамоилфосфата и орнитиновый цикл: Как побочный продукт орнитинового цикла образуется фумаровая кислота, переносимая обратно в митохондрии. Здесь в реакциях ЦТК из нее образуется оксалоацетат, который трансаминируется с глутаматом до аспартата, выходит в цитозоль и вновь реагирует с цитруллином.
В противоположность аммиаку мочевина является нетоксичным и нейтральным соединением. При хронической почечной недостаточности, когда продукты азотистого обмена не выводятся из организма, токсичное действие на организм оказывает совсем не мочевина, а совокупность более чем 200 других веществ.
