
пальЗанятие 2: Липолиз. Бета-окисление жирных кислот. Метаболизм кетоновых тел и фосфолипидов.
Внеаудиторные вопросы: 1. Характеристика сложных липидов.
Г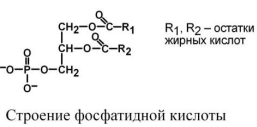 лицерофосфолипиды.
лицерофосфолипиды.
В организме человека наиболее распространены глицерофосфолипиды (ФЛ). В качестве их общего предшественника выступает фосфатидная кислота (фосфатидат), промежуточное соединение для синтеза триацилглицеролов (ТАГ) и фосфолипидов. Жирные кислоты, входящие в состав гицеро фосфолипидов, неравноценны. Ко второму атому углерода присоединена, как правило, полиненасыщенная жирная кислота. При углероде С1 находятся любые жирные кислоты, чаще мононенасыщеннные. В состав ФЛ входят азотсодержащие соединения серин, этаноламин, холин, циклический шестиатомный спирт инозитол (витамин В8).
Функции: Фосфатидилсерин (ФС), фосфатидилэтаноламин (ФЭА, кефалин), фосфатидилхолин (ФХ, лецитин) – структурные ФЛ, вместе с холестерином формируют липидный бислой клеточных мембран. От их жирнокислотного состава зависит активность мембранных ферментов, вязкость и проницаемость мембран. Наиболее широкими функциями обладает фосфатидилхолин: 1. входит в состав желчи и, вместе с желчными кислотами, участвует в эмульгировании пищевых липидов в просвете кишечника. 2. присутствуя в желчи, поддерживает находящийся здесь холестерин в растворенном состоянии и улучшает выведение его из организма, 3. обеспечивает формирование внешнего гидрофильного слоя транспортных липопротеинов крови, 4. дипальмитоилфосфатидилхолин, являясь поверхностно-активным веществом, служит основным компонентом сурфактанта легочных альвеол.
Недостаток в легких недоношенных младенцев фосфатидилхолина приводит к развитию синдрома дыхательной недостаточности
 Ф
Ф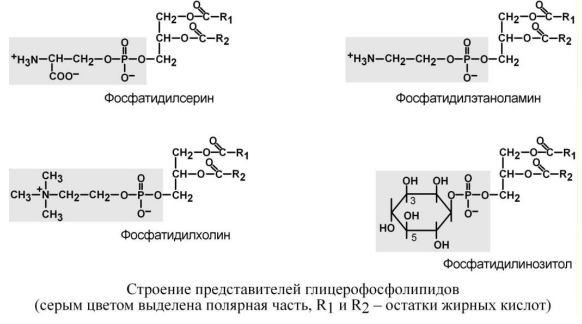 осфатидилинозитол
(ФИ) – играет ведущую роль в
фосфолипид-кальциевом механизме передачи
гормонального сигнала в клетку.
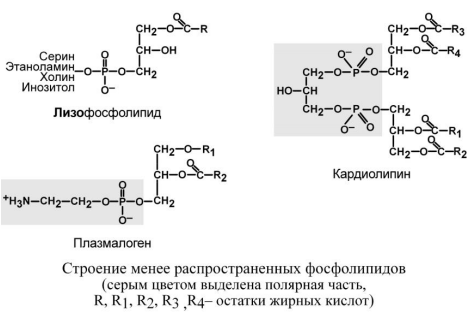
Лизофосфолипиды – продукт гидролиза
фосфолипидов фосфолипазой А2, образуются
катаболизме фосфолипидов или при
определенных стимулах, вызывающих в
клетке синтез эйкозаноидов (простагландинов,
тромбоксанов, лейкотриенов). Плазмалогены
при С1 содержат высший спирт вместо
жирной кислоты. Они участвуют в построении
мембран, составляют до 10% фосфолипидов
мозга и мышечной ткани. Гораздо более
редким является кардиолипин – структурный
фосфолипид в мембране митохондрий.
осфатидилинозитол
(ФИ) – играет ведущую роль в
фосфолипид-кальциевом механизме передачи
гормонального сигнала в клетку.
Лизофосфолипиды – продукт гидролиза
фосфолипидов фосфолипазой А2, образуются
катаболизме фосфолипидов или при
определенных стимулах, вызывающих в
клетке синтез эйкозаноидов (простагландинов,
тромбоксанов, лейкотриенов). Плазмалогены
при С1 содержат высший спирт вместо
жирной кислоты. Они участвуют в построении
мембран, составляют до 10% фосфолипидов
мозга и мышечной ткани. Гораздо более
редким является кардиолипин – структурный
фосфолипид в мембране митохондрий.
 Сфингофосфолипиды.
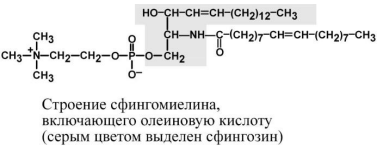
Сфингофосфолипиды.
Основным представителем у человека являются сфингомиелины – наибольшее их количество расположено в сером и белом веществе головного и спинного мозга, в оболочке аксонов периферической нервной системы, есть в печени, почках, эритроцитах и других тканях. В качестве жирных кислот выступают насыщенные и мононенасыщенные кислоты.
Гликолипиды.
Г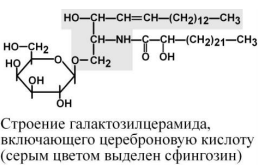
 ликолипиды
широко представлены в нервной ткани и
мозге. Размещаются они в наружном
монослое плазматических мембран, при
этом олигосахаридные цепи направлены
наружу. Функции гликолипидов изучены
недостаточно, они обладают рецепторной
функцией, участвуют в межклеточных
взаимодействиях и контактах, являются
антигенами клеточной поверхности
(группы крови Lewis и AB0). Большую часть
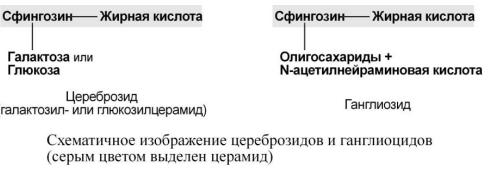
гликолипидов составляют гликосфинголипиды,
включающие церамид (соединение
аминоспирта сфингозина с длинноцепочечной
жирной кислотой) и один или несколько
остатков сахаров. В нервной
ткани главным цереброзидом является
галактозилцерамид. Для других тканей
более характерны глюкозилцерамиды.
Еще одна группа гликолипидов, широко
представленных в мозге – ганглиозиды.
Они образуются из глюкозилцерамида и
дополнительно содержат одну или несколько
молекул сиаловой кислоты, моносахаров
и их производных (сульфосахаров и
аминосахаров).
ликолипиды
широко представлены в нервной ткани и
мозге. Размещаются они в наружном
монослое плазматических мембран, при
этом олигосахаридные цепи направлены
наружу. Функции гликолипидов изучены
недостаточно, они обладают рецепторной
функцией, участвуют в межклеточных
взаимодействиях и контактах, являются
антигенами клеточной поверхности
(группы крови Lewis и AB0). Большую часть
гликолипидов составляют гликосфинголипиды,
включающие церамид (соединение
аминоспирта сфингозина с длинноцепочечной
жирной кислотой) и один или несколько
остатков сахаров. В нервной
ткани главным цереброзидом является
галактозилцерамид. Для других тканей
более характерны глюкозилцерамиды.
Еще одна группа гликолипидов, широко
представленных в мозге – ганглиозиды.
Они образуются из глюкозилцерамида и
дополнительно содержат одну или несколько
молекул сиаловой кислоты, моносахаров
и их производных (сульфосахаров и
аминосахаров).
Если моносахариды несут на себе сульфогруппу, то такие гликолипиды называют сульфолипидами.
Вопросы внеаудиторной работы:
1. Характеристика реакций липолиза по плану: локализация и условия протекания процесса, последовательность реакций и ферменты, конечные продукты, гормональная регуляция процесса, транспорт и использование свободных жирных кислот, образующихся при липолизе.
И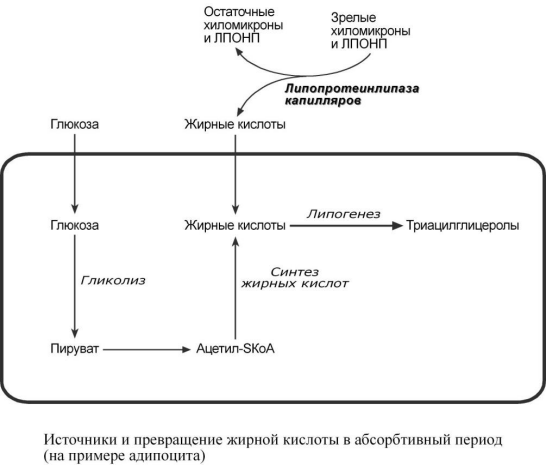 сточники
и судьба жирных кислот: Жирные кислоты
входят в состав большей части липидов.
Поэтому вопросы метаболизма липидов –
это часто вопросы обмена жирных кислот,
их источники и пути дальнейших превращений.
Судьба жирной кислоты зависит от ее
строения (насыщенная ЖК или полиненасыщенная
ЖК) и от внутриклеточных условий (наличие
или отсутствие энергии в клетке,
гормональные влияния). Абсорбтивный
период: в течение нескольких часов после
приема пищи насыщенные и мононенасыщенные
жирные кислоты (НЖК) поступают от
кишечника в определенные ткани из
хиломикронов.
сточники
и судьба жирных кислот: Жирные кислоты
входят в состав большей части липидов.
Поэтому вопросы метаболизма липидов –
это часто вопросы обмена жирных кислот,
их источники и пути дальнейших превращений.
Судьба жирной кислоты зависит от ее
строения (насыщенная ЖК или полиненасыщенная
ЖК) и от внутриклеточных условий (наличие
или отсутствие энергии в клетке,
гормональные влияния). Абсорбтивный
период: в течение нескольких часов после
приема пищи насыщенные и мононенасыщенные
жирные кислоты (НЖК) поступают от
кишечника в определенные ткани из
хиломикронов.
Параллельно в этот период времени в печени жирные кислоты способны синтезироваться из избытка экзогенной глюкозы и полученные эндогенные жирные кислоты этерифицируются с глицеролом в реакциях липогенеза с образованием ТАГ. Далее они транспортируются из печени в ткани, имеющие липопротеинлипазу, в составе ЛПОНП. В клетках жировой ткани после приема пищи насыщенная жирная кислота либо синтезируется из глюкозы, либо поступает из хиломикронов и ЛПОНП. Далее она направляется в липогенез и запасается в составе ТАГ.
сли липопротеинлипазы нет в ткани, то жирная кислота доставляется сюда в комплексе с альбумином. Этот комплекс образуется после работы липопротеинлипазы в других тканях. Полиненасыщенные жирные кислоты (ПНЖК) обычно поступают в клетки в виде эфиров холестерола и в составе фосфолипидов ЛПВП и ЛПНП. Эти кислоты необходимы для синтеза эйкозаноидов в некоторых видах клеток, либо они участвуют в синтезе фосфолипидов для мембран клетки.
Г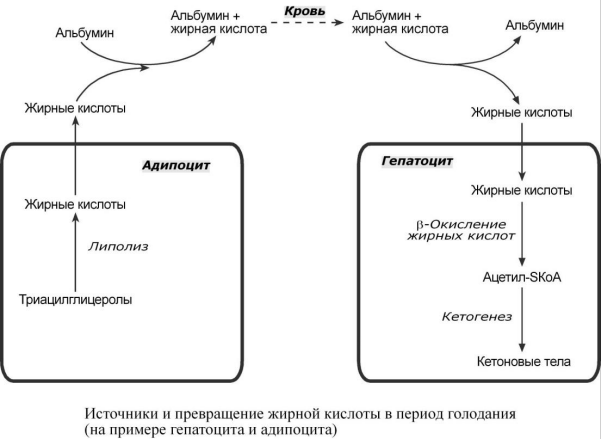 олодание
и мышечная работа: при голодании
хиломикроны и ЛПОНП в крови отсутствуют.
Так как данному состоянию обычно
сопутствует гипогликемия, то для ее
компенсации из поджелудочной железы
секретируется глюкагон. Под влиянием
глюкагона и других гормонов в жировых
депо активируется расщепление ТАГ до
жирных кислот и глицерола (липолиз).
Транспорт жирных кислот, вышедших в
кровь, осуществляется альбумином. В
состоянии покоя, когда процессы
пищеварения уже закончились, при
длительном голодании (более 20 часов) и
при физической нагрузке в большинстве
клеток, кроме нейронов и эритроцитов,
жирные кислоты используются для
образования энергии в процессах
-окисления и ЦТК
(50% и более всей энергии клетки). В печени
при длительном голодании жирная кислота
направляется в кетогенез на синтез
кетоновых тел.
олодание
и мышечная работа: при голодании
хиломикроны и ЛПОНП в крови отсутствуют.
Так как данному состоянию обычно
сопутствует гипогликемия, то для ее
компенсации из поджелудочной железы
секретируется глюкагон. Под влиянием
глюкагона и других гормонов в жировых
депо активируется расщепление ТАГ до
жирных кислот и глицерола (липолиз).
Транспорт жирных кислот, вышедших в
кровь, осуществляется альбумином. В
состоянии покоя, когда процессы
пищеварения уже закончились, при
длительном голодании (более 20 часов) и
при физической нагрузке в большинстве
клеток, кроме нейронов и эритроцитов,
жирные кислоты используются для
образования энергии в процессах
-окисления и ЦТК
(50% и более всей энергии клетки). В печени
при длительном голодании жирная кислота
направляется в кетогенез на синтез
кетоновых тел.
Использование триацилглицеролов: Распад ТАГ (липолиз, мобилизация жира) идет в жировых клетках постоянно и обычно существует равновесие между синтезом и распадом ТАГ. В состоянии покоя печень, сердце, скелетные мышцы и другие ткани (кроме эритроцитов и нейроцитов) более 50% энергии получают из окисления жирных кислот, поступающих из жировой ткани благодаря фоновому липолизу. Мобилизация жира активируется: 1. при нормальных физиологических стрессовых ситуациях – эмоциональный стресс, мышечная работа, голодание, 2. при патологических состояниях – сахарный диабет I типа, другие гормональные заболевания: гиперкортицизм, гипертиреоз.
Общая характеристика мобилизации жиров.
В целом мобилизацию жира можно представить как последовательность следующих событий:
1. Липолиз – гормонзависимый распад ТАГ в жировой ткани (см ниже) или резервных ТАГ в самой клетке. 2. Транспорт жирных кислот из жировой ткани по крови в комплексе с альбумином. 3. Проникновение жирной кислоты в цитозоль клетки-мишени. 4. Активация жирной кислоты через присоединение HS-КоА. 5. Карнитин-зависимое перемещение жирной кислоты в митохондрию. 6. Окисление жирной кислоты с образованием ацетильных групп (ацетил-SКоА). 7. Сгорание ацетил-SКоА в цикле лимонной кислоты или синтез (только в печени) кетоновых тел.
2.Гормончувствительная липаза, роль аденилатциклазной системы в регуляции её активности. Регуляция липазы гормонами: адреналином, глюкагоном, кортизолом и инсулином. Аллостерическая регуляция активности ферментов липолиза и липогенеза.
Гормонзависимая активация ТАГ-липазы.
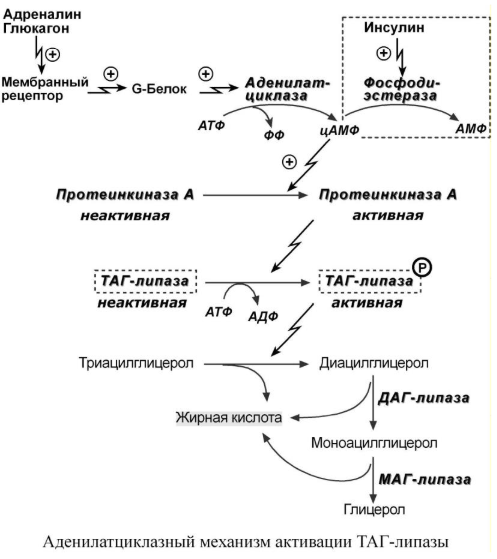 Гормонзависимая
активация ТАГ-липазы адипоцитов
адреналином и глюкагоном происходит
при напряжении организма (голодание,
длительная мышечная работа, охлаждение).
В первую очередь активность ТАГ-липазы
зависит от соотношения инсулин/глюкагон.
В целом последовательность событий
липолиза выглядит следующим образом:
1. Молекула гормона (адреналин, глюкагон,
АКТГ, СТГ) взаимодействует со своим
рецептором. 2. Активный гормон-рецепторный
комплекс воздействует на мембранный
G-белок. 3. G-белок активирует фермент
аденилатциклазу. 4. Аденилатциклаза
превращает АТФ в циклический АМФ (цАМФ)
– вторичный посредник (мессенджер). 5.
цАМФ аллостерически активирует фермент
протеинкиназу А. 6. Протеинкиназа А
фосфорилирует ТАГ-липазу и активирует
ее. 7. ТАГ-липаза отщепляет от
триацилглицеролов жирную кислоту в 1
или 3 положении с образованием ДАГ. Кроме
ТАГ-липазы, в адипоцитах имеются еще
ДАГ-липаза и МАГ-липаза, активность
которых высока и постоянна, однако в
покое она не проявляется из-за отсутствия
субстрата. Как только в клетке появляются
ДАГ, начинает работать постоянно активная
ДАГ-липаза, продукт ее реакции МАГ
является субстратом для МАГ-липазы.
Кроме гормонов, влияющих на активность
аденилатциклазы через G-белки, существуют
иные механизмы регуляции. Например,
соматотропный гормон увеличивает
количество аденилатциклазы, глюкокортикоиды
способствуют синтезу ТАГ-липазы.
Гормонзависимая
активация ТАГ-липазы адипоцитов
адреналином и глюкагоном происходит
при напряжении организма (голодание,
длительная мышечная работа, охлаждение).
В первую очередь активность ТАГ-липазы
зависит от соотношения инсулин/глюкагон.
В целом последовательность событий
липолиза выглядит следующим образом:
1. Молекула гормона (адреналин, глюкагон,
АКТГ, СТГ) взаимодействует со своим
рецептором. 2. Активный гормон-рецепторный
комплекс воздействует на мембранный
G-белок. 3. G-белок активирует фермент
аденилатциклазу. 4. Аденилатциклаза
превращает АТФ в циклический АМФ (цАМФ)
– вторичный посредник (мессенджер). 5.
цАМФ аллостерически активирует фермент
протеинкиназу А. 6. Протеинкиназа А
фосфорилирует ТАГ-липазу и активирует
ее. 7. ТАГ-липаза отщепляет от
триацилглицеролов жирную кислоту в 1
или 3 положении с образованием ДАГ. Кроме
ТАГ-липазы, в адипоцитах имеются еще
ДАГ-липаза и МАГ-липаза, активность
которых высока и постоянна, однако в
покое она не проявляется из-за отсутствия
субстрата. Как только в клетке появляются
ДАГ, начинает работать постоянно активная
ДАГ-липаза, продукт ее реакции МАГ
является субстратом для МАГ-липазы.
Кроме гормонов, влияющих на активность
аденилатциклазы через G-белки, существуют
иные механизмы регуляции. Например,
соматотропный гормон увеличивает
количество аденилатциклазы, глюкокортикоиды
способствуют синтезу ТАГ-липазы.
Инсулин препятствует влиянию остальных гормонов на липолиз, т.к. он активирует фермент фосфодиэстеразу, которая гидролизует цАМФ и, следовательно, снижает активность ТАГ-липазы. Также он активирует протеинфосфатазы, дефосфорилирующие ТАГ-липазу.
О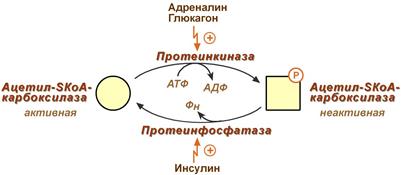 бмен
жирных кислот регулируется
бмен
жирных кислот регулируется
Гормональная регуляция
Синтез и окисление триацилглицеролов и жирных кислот зависит от соотношения инсулин / глюкагон.
1. Изменение количества ферментов: Ферменты комплекса пальмитатсинтазы и ацетил-SКоА-карбоксилазы являются адаптивными ферментами, количество их возрастает при усиленном питании и уменьшается при голодании и потреблении жира. Индуктором биосинтеза этих ферментов является инсулин.
2. Ковалентная модификация: благодаря инсулину, глюкагону, адреналину, тиреотропному и адренокортикотропному гормонам происходит ковалентная модификация ферментов ацетил-SКоА-карбоксилазы и ТАГ-липазы путем фосфорилирования-дефосфорилирования.
Регуляция
активности ацетил-SКоА-карбоксилазы:
Инсулин активирует протеинфосфатазу и
способствует дефосфорилированию и
активации ацетил-SКоА-карбоксилазы.
Одновременно в клетке дефосфорилируется
и инактивируется ТАГ-липаза.
Глюкагон, адреналин или
другие гормоны, действуя по аденилатциклазному
механизму с участием цАМФ-зависимой
протеинкиназы, вызывают фосфорилирование
и ингибирование ацетил-SКоА-карбоксилазы и,
следовательно, останавливают липогенез.
Одновременно они активируют ТАГ-липазу.
При уменьшении количества инсулина и
возрастании глюкагона усиливаются
липолиз в жировой ткани, поступление
жирных кислот в печень и другие ткани
и реакции их β-окисления. Такое состояние
наблюдается при гипогликемии любого
происхождения. При обратном соотношении
г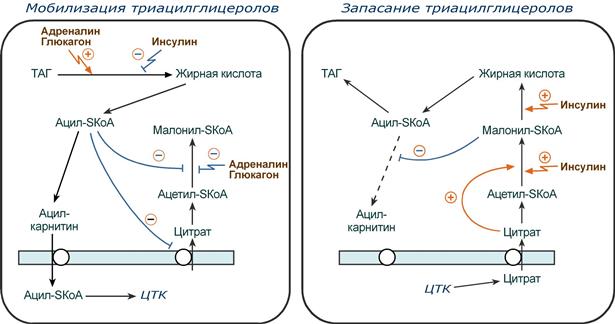 ормонов
начинаются реакции синтеза жиров.
Способы регуляции реакций обмена
триацилглицеролов.
ормонов
начинаются реакции синтеза жиров.
Способы регуляции реакций обмена
триацилглицеролов.
Метаболическая регуляция
В регуляции синтеза и окисления жирных кислот играют роль три участка: 1. Активность ацетил-SКоА-карбоксилазы регулируется:
цитратом – аллостерический активатор фермента, накапливается в цитозоле при избыточном количестве энергии,
ацил-SКоА по принципу обратной отрицательной связи ингибирует фермент, препятствуя синтезу малонил-SКоА. Т.е. если ацил-SКоА не успевает вступить в этерификацию или усиливается липолиз в клетке или увеличивается поступление жирных кислот извне, то автоматически блокируется синтез новых жирных кислот.
2. Транспорт цитрата из митохондрии в цитозоль подавляется избытком ацил-SКоА, это снижает синтез жирных кислот.
3. Карнитин-ацилтрансфераза ингибируется при образовании малонил-SКоА, что останавливает поступление ацил-SКоА внутрь митохондрий и снижает β-окисление.
Таким образом, когда в клетке имеется избыток энергии, то усиление синтеза жирных кислот достигается поступлением в цитозоль цитрата и при наличии малонил-S-КоА. Полученные молекулы ацил-SКоА быстро поступают на этерификацию глицерола до ТАГ и не накапливаются в цитозоле.
Если в клетке недостаточно энергии, то необходимо активировать β-окисление жирных кислот для ее получения. В этом случае гормональные влияния вызывают липолиз (или поступление жирных кислот извне) и накопление ацил-SКоА в цитозоле, что автоматически (см пункт 2) через уменьшение количества цитрата и малонил-SКоА препятствует синтезу новых жирных кислот. Параллельно (см пункт 3) убыль малонил-SКоА и активация карнитин-ацил-трансферазы запускает β-окисление.
Попавшая в митохондрию жирная кислота неизбежно окисляется до ацетил-SКоА.
При появлении избытка ацетильных групп и достаточном количестве АТФ в митохондриях печени эти группы перенаправляются на синтез кетоновых тел.
Существует биологически активная добавка к пище, используемая в программах для похудения – "Цитримакс". Она представляет собой препарат гидроксилимонной кислоты. Имея структурное сходство с лимонной кислотой, гидроксилимонная кислота конкурентно ингибирует активность АТФ-цитрат-лиазы, что препятствует синтезу жирных кислот.
3. Ферменты, осуществляющие расщепление фосфолипидов. Роль фосфолипаз а1, а2, с и d.
Фосфолипаза — фермент, гидролизующий фосфолипиды. Различают 4 основных класса фосфолипаз: A, B, C и D, каждый из которых гидролизует определенную связь в фосфолипиде. Фосфолипазы класса А подразделяются на фосфолипазы A1, отщепляющие SN-1 ацильную цепь фосфолипида и фосфолипазы A2, отщепляющие SN-2 ацильную цепь. Среди фосфолипаз А2 выделяют:
внеклеточные фосфолипазы А2 ядов змей, рептилий и насекомых
панкреатическую фосфолипазу
внутриклеточные фосфолипазы А2
Панкреатическая фосфолипаза — фосфолипаза класса А2 (КФ 3.1.1.4), липолитический фермент, разлагающий жиры пищи (триглицериды). Секретируется в виде профермента поджелудочной железы профосфолипазы, который активируется в тонкой кишке трипсином/ Оптимальная кислотность для каталитической активности панкреатической фосфолипазы 7,5–9,0 рН. «Работает» как фермент в присутствии Ca2+ (являющимся коферментом для фосфолипазы). При гидролитическом расщеплении лецитина желчи фосфолипазой А образуется лизолецитин. Дальнейший метаболизм лизолецитина катализируется фосфолипазой В, которая тормозится желчными кислотами/
Роль фосфолипазы в развитии некоторых форм панкреатита
При недостаточности большого сосочка двенадцатиперстной кишки и повышенном давлении в двенадцатиперстной кишке возможен рефлюкс желчи или дуоденального содержимого в протоки поджелудочной железы. Желчь, попадая в протоки поджелудочной железы, может подвергаться воздействию панкреатической фосфолипазы, уже активированной трипсином, в результате чего образуется лизолецитин, который, проникая в интерстициальное пространство поджелудочной железы, вызывает глубокие повреждения в клетках.
4. Реакции окисления жирных кислот до углекислого газа и воды: роль карнитина в окислении жирных кислот, локализация и условия протекания ‑окисления, последовательность реакций ‑оксиления и ферменты, участие витаминов и коферментов, конечные продукты, связь с ЦТК и дыхательной цепью, энергетический выход процесса, расчёт энергетической ценности ‑окисления пальмитиновой кислоты.
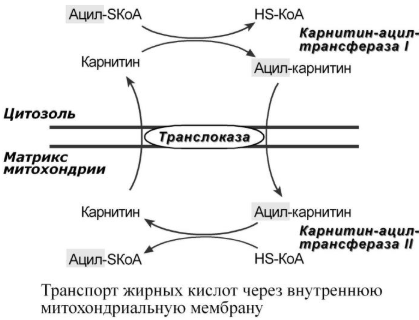
Реакции β-окисления происходят в митохондриях большинства клеток организма (кроме нервных клеток). Для окисления используются жирные кислоты, поступающие в цитозоль из крови или появляющиеся при внутриклеточном липолизе ТАГ.
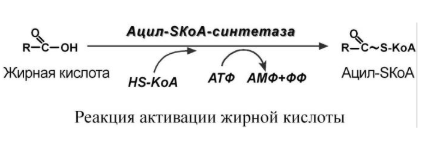
1. Прежде, чем проникнуть в матрикс митохондрий и окислиться, жирная кислота в цитозоле должна активироваться. Это осуществляется присоединением коэнзима А с образованием ацил-SКоА. Ацил-SКоА является высокоэнергетическим соединением. Необратимость реакции достигается гидролизом дифосфата на две молекулы фосфорной кислоты.
 2.
Ацил-SКоА не способен проходить через
митохондриальную мембрану, поэтому
существует способ переноса жирной
кислоты в комплексе с витаминоподобным
веществом карнитином. На наружной
мембране митохондрий имеется фермент
карнитин-ацилтрансфераза I.
2.
Ацил-SКоА не способен проходить через
митохондриальную мембрану, поэтому
существует способ переноса жирной
кислоты в комплексе с витаминоподобным
веществом карнитином. На наружной
мембране митохондрий имеется фермент
карнитин-ацилтрансфераза I.
3. После связывания с карнитином жирная кислота переносится через мембрану транслоказой. Здесь на внутренней стороне мембраны фермент карнитин-ацилтрансфераза II вновь образует ацил-SКоА который вступает на путь β-окисления.
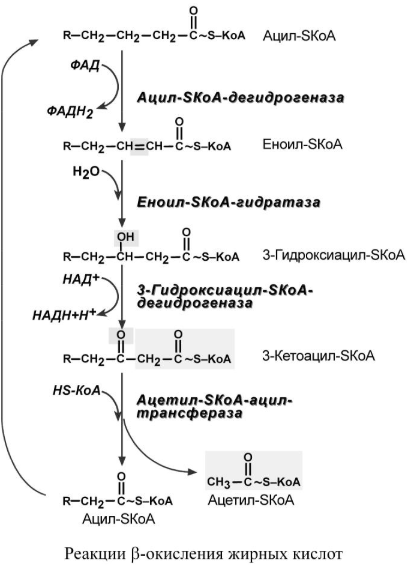
 4.
Процесс собственно β-окисления состоит
из 4-х реакций, повторяющихся циклически.
В них последовательно происходит
окисление, гидратирование и вновь
окисление 3-го атома углерода (β-положение).
В последней реакции от жирной кислоты
отщепляется ацетилSКоА. Оставшаяся
укороченная на два углерода жирная
кислота возвращается к первой реакции
и все повторяется снова, до тех пор, пока
в последнем цикле не образуются два
ацетил-SКоА.
4.
Процесс собственно β-окисления состоит
из 4-х реакций, повторяющихся циклически.
В них последовательно происходит
окисление, гидратирование и вновь
окисление 3-го атома углерода (β-положение).
В последней реакции от жирной кислоты
отщепляется ацетилSКоА. Оставшаяся
укороченная на два углерода жирная
кислота возвращается к первой реакции
и все повторяется снова, до тех пор, пока
в последнем цикле не образуются два
ацетил-SКоА.
Ацил-SКоА-синтетазы находятся в эндоплазматическом ретикулуме, на наружной мембране митохондрий и внутри них. Существует широкий ряд синтетаз, специфичных к разным жирным кислотам.
Карнитин синтезируется в печени и почках и затем транспортируется в остальные органы. Во внутриутробном периоде и в первые годы жизни значение карнитина для организма чрезвычайно велико. Энергообеспечение нервной системы детского организма и, в частности, головного мозга осуществляется за счет двух параллельных процессов: карнитин-зависимого окисления жирных кислот и аэробного окисления глюкозы. Карнитин необходим для роста головного и спинного мозга, для взаимодействия всех отделов нервной системы, ответственных за движение и взаимодействие мышц. Существуют исследования, связывающие с недостатком карнитина детский церебральный паралич и феномен "смерти в колыбели".
Дети раннего возраста, недоношенные и дети с малой массой особенно чувствительны к недостаточности карнитина. Эндогенные запасы у них быстро истощаются при различных стрессовых ситуациях (инфекционные заболевания, желудочно-кишечные расстройства, нарушения вскармливания). Биосинтез карнитина недостаточен, а поступление с обычными пищевыми продуктами неспособно поддержать достаточный уровень в крови и тканях.
