
- •Занятие 2 Ферменты: строение, механизмы действия, кинетика. Коферменты.
- •Уравнение Лайнувера-Бэрка. Графики зависимости обратных величин в присутствии ингибиторов.
- •Этапы ковалентного катализа на примере химотрипсина.
- •Механизм кислотно-основного катализа на примере алкогольдегидрогеназы.
- •5. Классификация и номенклатура ферментов.
- •7. Характеристика структурно-функциональной организации ферментов по плану:
- •8. Понятие о мультиферментном комплексе: строение, принципы самосборки, роль
- •9. Изоферменты, особенности их строения на примере лактатдегидрогеназы и
- •10. Специфичность, виды специфичности. Механизмы специфичности – теория Фишера и теория Кошланда.
- •12. Основы кинетики ферментативных реакций. Уравнение Михаэлиса-Ментен.
Занятие 2 Ферменты: строение, механизмы действия, кинетика. Коферменты.
Вопросы для внеаудиторной работы
Уравнение Лайнувера-Бэрка. Графики зависимости обратных величин в присутствии ингибиторов.
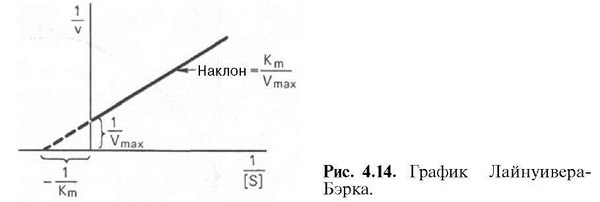
у = ах + b. Если теперь в соответствии с этим уравнением построить график в координатах 1/v (y) от l/[£] (x), то получим прямую линию, тангенс угла наклона который будет равен величине Km/Vmax; отрезок, отсекаемый прямой от оси ординат, представляет собой l/Vmax (обратная величина максимальной скорости). Если продолжить прямую линию за ось ординат, тогда на абсциссе отсекается отрезок, соответствующий обратной величине константы Михаэлиса — 1/Кт. Таким образом, величину Km можно вычислить из данных наклона прямой и длины отрезка, отсекаемого от оси ординат, или из длины отрезка, отсекаемого от оси абсцисс в области отрицательных значений.
Следует подчеркнуть, что значения Vmax, как и величину Km, более точно, чем по графику, построенному в прямых координатах, можно определить по графику, построенному по методу двойных обратных величин. Поэтому данный метод нашел широкое применение в современной энзимологии. Предложены также аналогичные графические способы определения Km и Vmax в координатах зависимости v от v/[S] и [S]/v от [S].
Этапы ковалентного катализа на примере химотрипсина.
Ковалентный катализ – ферменты реагируют со своими субстратами, образуя при помощи ковалентных связей очень нестабильные фермент-субстратные комплексы, из которых в ходе внутримолекулярных перестроек образуются продукты реакции.
Рассмотрим механизм ковалентного катализа на примере хемомотрипсина, осуществляющего гидролиз пептидных связей при переваривании белков в двенадцатиперстной кишке. Субстратами химотрипсина служат пептиды, содержащие аминокислоты с ароматическими и циклическимиаирофобными радикалами (Фен, Тир, Три), что вызывает на участие гидрофобных сил в формировании фермент-субстратного комплекса. Радикалы Асп|02, Гис57 и Сер195 участвуют в акте катализа. Вследствие нуклеоофильной атаки пептидной связи субстрата происходит разрыв этой связи с образованием •ковалентно-модифицированного серина — ацил-трипсина
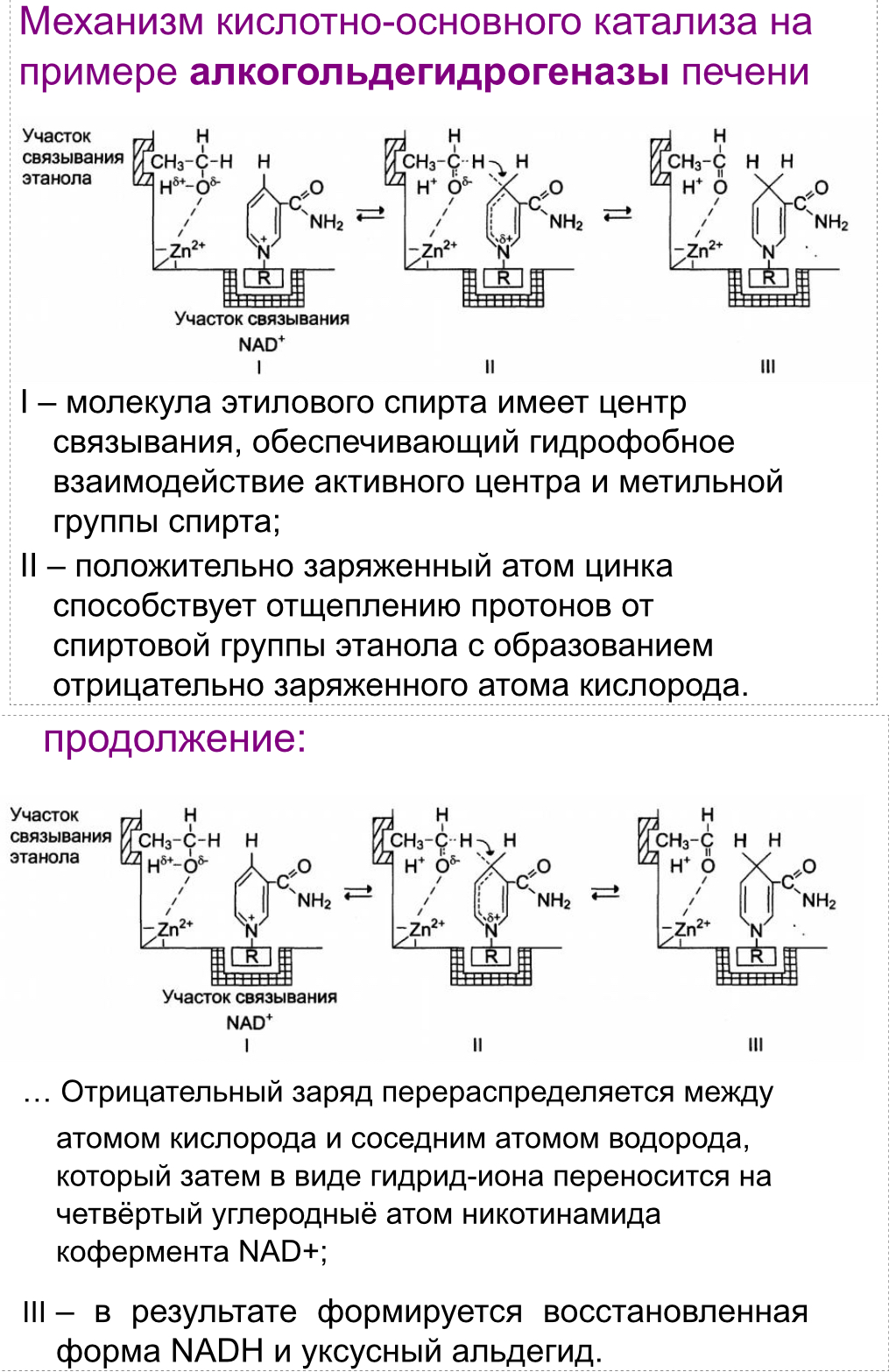
Механизм кислотно-основного катализа на примере алкогольдегидрогеназы.
Примером кислотно-основного катализа, в котором кофакторами являются ионы Zn2+, а в качестве кофермента используется молекула NAD+, можно привести фермент алкогольдегидрогеназу печени, катализирующую реакцию окисления спирта:
 С2Н5ОН
+ NAD+ → СН3-СОН + NADH + H
С2Н5ОН
+ NAD+ → СН3-СОН + NADH + H
Вопросы для аудиторной работы
Общая характеристика ферментов. Сходство и различие в действии ферментов и неорганических катализаторов.
В нормальных физиологических условиях биохимические реакции в организме протекают с высокими скоростями, что обеспечивается биологическими катализаторами белковой природы – ферментами.
Их изучением занимается наука энзимология – наука об энзимах (ферментах), специфических белках – катализаторах, синтезируемых любой живой клеткой и активирующих различные биохимические реакции, протекающие в организме. Некоторые клетки могут содержать до 1000 различных ферментов.

