
Строение, свойства и функции белков. Простые и сложные белки. Гемопротеины
..pdf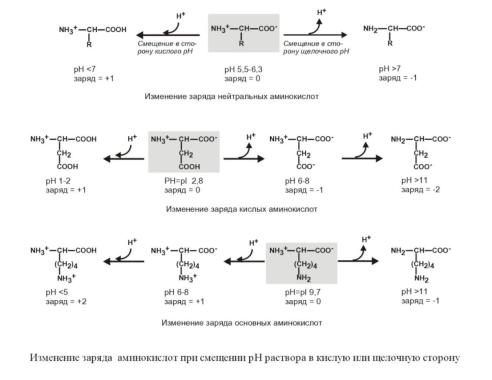
Биохимия. ЗАНЯТИЕ №1
№1. Изоэлектрическая точка аминокислот и пептидов. От чего она зависит? Влияние изменения рН на заряд и растворимость пептидов и белков.
Аминокислоты сочетают в себе свойства и кислот и оснований. Соответственно, в водном растворе аминокислоты ведут себя как кислоты – доноры протонов и как основания – акцепторы протонов.
Если общий заряд аминокислоты равен 0, то это ее состояние называют изоэлектрическим. Величина рН, при которой заряд аминокислоты равен 0, называется изоэлектрической точкой (ИЭТ, pI). Значение изоэлектрической точки зависит от строения радикала аминокислоты:
pI большинства аминокислот располагается в диапазоне рН от 5,5 (фенилаланин) до 6,3 (пролин),
pI кислых аминокислот – рI глутамата 3,2, рI аспартата 2,8,
pI основных аминокислот – pI гистидина 7,6, pI аргинина 10,8, pI лизина 9,7.
Заряд аминокислот зависит от величины рН среды.
Отправным пунктом для понимания причин появления заряда у аминокислот является величина изоэлектрической точки. Ситуация различается для нейтральных, кислых и основных аминокислот.
№2. Свойства белков: амфотерность, ионизация (заряд), гидратация, растворимость.
Амфотерность. Так как белки содержат кислые и основные аминокислоты, то в их составе всегда имеются свободные кислые (СОО–) и основные (NH3+) группы. Заряд белка зависит от соотношения количества кислых и основных аминокислот. Поэтому, аналогично аминокислотам, белки заряжаются
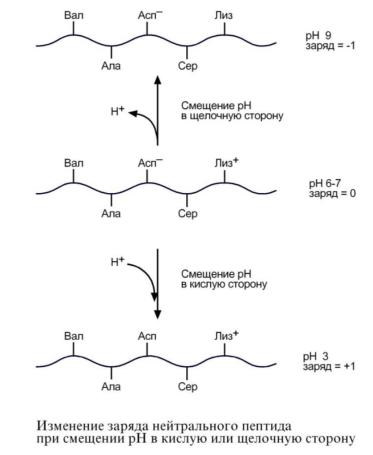
положительно при уменьшении рН, и отрицательно при его увеличении. Если рН раствора соответствует изоэлектрической точке белка, то заряд белка равен 0. Если в пептиде или белке преобладают кислые аминокислоты (глутамат и аспартат), то при нейтральных рН заряд белка отрицательный и изоэлектрическая точка находится в кислой среде. Для большинства природных белков изоэлектрическая точка находится в диапазоне рН 4,8-5,4, что свидетельствует о преобладании в их составе глутами-
новой и аспарагиновой аминокислот.
Если в белке преобладают основные аминокислоты (лизин и аргинин) – при нейтральных рН заряд обусловлен этими, положительно заряженными, аминокислотами.
Амфотерность имеет значение для выполнения белками некоторых функций, например, их буферные свойства, т.е. способность поддерживать неизменным рН крови, основаны на способности присоединять ионы Н+ при закислении среды или отдавать их при защелачивании.
С практической стороны наличие амфотерности позволяет разделять белки по заряду (электрофорез) или использовать изменение величины рН раствора для осаждения какого-либо известного белка. Наличие как положительных, так и отрицательных зарядов в белке обуславливает их способность к высаливанию, что удобно для выделения белков в нативной конформации.
Влияние рН на заряд белка. При смещении рН в растворе изменяется концентрация ионов Н+. При закислении среды (при снижении рН) ниже изоэлектрической точки ионы Н+ присоединяются к отрицательно заряженным группам глутаминовой и аспарагиновой кислот и нейтрализуют их. Заряд белка становится положительным.
При увеличении рН в растворе выше изоэлектрической точки концентрация ионов Н+ снижается и положительно заряженные группы белка (NH3+ -группы

лизина и аргинина) теряют протоны, их заряд исчезает. Суммарный заряд белка становится отрицательным.
Растворимость. Так как большинство белков несет много заряженных групп, то в целом они водорастворимы. Растворимость объясняется:
наличием заряда и взаимоотталкиванием заряженных молекул белка, наличием гидратной оболочки – чем больше полярных и/или заряженных
аминокислот в белке, тем больше гидратная оболочка (100 г белка альбумина связывает 30-50 г воды).
Так как растворимость белков зависит от заряда и наличия гидратной оболочки, то исчезновение одного или обоих этих факторов ведет к осаждению белка.
Денатурация – необратимое осаждение белка из-за разрыва связей, стабилизирующих четвертичную, третичную, вторичную структуры белка, сопровождаемое изменением растворимости, вязкости, химической активности, снижением или полной потерей биологической функции.
1. Физическая денатурация – повышение температуры, ультрафиолетовое и микроволновое излучение, механические воздействия, ионизация заряженными частицами.
2. Химическая:
кислоты и щелочи образуют водородные связи с пептидными группами, органические растворители образуют водородные связи и вызывают
дегидратацию, алкалоиды образуют связи с полярными группами и разрывают систему
водородных и ионных связей тяжелые металлы взаимодействуют с заряженными радикалами, нейтрализуют
отрицательные заряды и разрывают систему водородных и ионных связей.
Обратимое осаждение. Обратимость осаждения белков обусловлена сохранением первичной структуры белка. Восстановление физико-химических и биологических свойств белка называется ренативация (ренатурация) Иногда для ренативации достаточно просто удалить денатурирующий объект.
Высаливание – это добавление растворов нейтральных солей (Na2SO4, (NH4)2SO4). Анионы (SO42–) и катионы (Na+, NH4+) взаимодействуют с зарядами белка (группы NH4+ и COO–). В результате заряд исчезает, и соответственно, исчезает взаимоотталкивание молекул. Одновременно резко уменьшается гидратная оболочка. Это ведет к "слипанию" молекул и осаждению.
Так как белки плазмы крови отличаются по размерам, заряду, строению, то можно подобрать такие количества соли, которые вызовут осаждение менее устойчивых белков, пока другие еще будут растворены.
Например, подобным образом раньше определяли соотношение альбумины/глобулины в плазме крови. Альбумины, как более полярные молекулы, остаются в растворенном состоянии при 50% насыщении раствора нейтральными солями, в то время как глобулины в этих условиях уже осаждаются. В норме соотношение альбумины/глобулины в плазме крови равно 1,2-1,8.
Осаждение водоотнимающими средствами. При добавлении водоотнимающих средств (ацетон, этанол) происходит отнятие у белка гидратной оболочки, но не заряда. Растворимость несколько снижается, но денатурации не наступает. Например, антисептическое действие этанола.
Изменение рН. Мягкое изменение рН до изоэлектрической точки белка ведет к исчезновению заряда, уменьшению гидратной оболочки и снижению растворимости молекулы.
№3. Аминокислоты - структурные компоненты белка. Пептидная связь, реакция ее образования. Свойства пептидной связи.
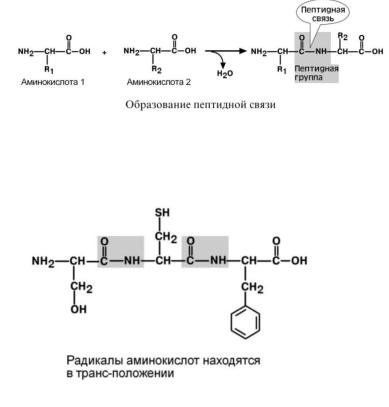
Аминокислоты способны соединяться между собой связями, которые называются пептидными, при этом образуется полимерная молекула.
Пептидная связь – это связь между а-карбоксильной группой одной аминокислоты и альфа-аминогруппой другой аминокислоты.
К свойствам пептидной связи относятся:
1. Трансположение заместителей (радикалов) аминокислот по отношению к C- N связи.
2.Копланарность. Все атомы, входящие в пептидную группу находятся в одной плоскости, при этом атомы "Н" и "О" расположены по разные стороны от пептидной связи.
3.Наличие кетоформы и енольной формы.
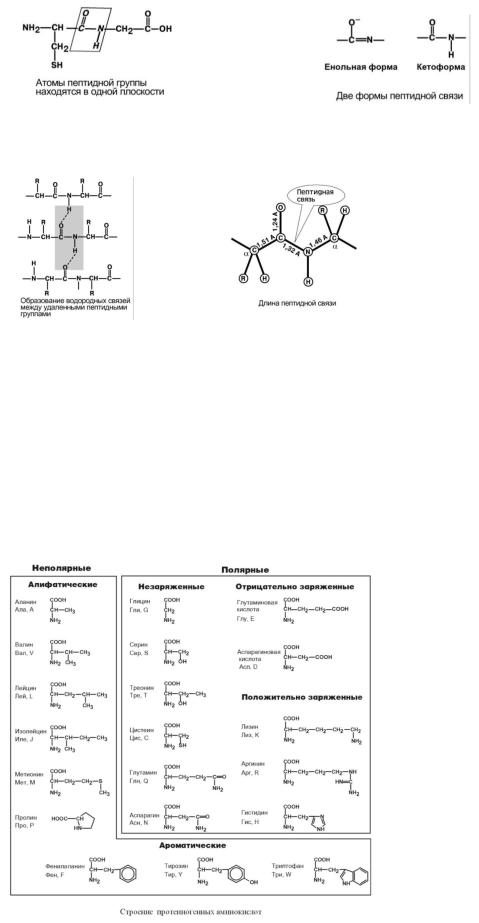
4.Способность к образованию двух водородных связей с другими пептидными группами.
5.Пептидная связь имеет частично характер двойной связи. Ее длина меньше, чем одинарной связи, она является жесткой структурой, и вращение вокруг нее затруднено.
Но так как, кроме пептидной, в белке есть и другие связи, цепочка аминокислот способна вращаться вокруг основной оси, что придает белкам различную конформацию (пространственное расположение атомов).
№4. Структурные формулы протеиногенных аминокислот.
Выделяют протеиногенные (20 АК) и непротеиногенные (около 40 АК). Все протеиногенные аминокислоты являются а-аминокислотами.
№5. Классификация аминокислот по биологической роли (заменимые и незаменимые):
по физико-химическим свойствам (нейтральные, кислые, основные; гидрофобные, гидрофильные);
по химическому строению (с алифатическими радикалами, с дополнительной функциональной группой, с ароматическим и гетероциклическим радикалом, аминокислоты);
по растворимости в воде (неполярные, полярные незаряженные, полярные отрицательно и положительно заряженные)
В зависимости от положения аминогруппы. Выделяют а,В,y и другие аминокислоты. Для организма млекопитающих наиболее характерны а- аминокислоты.
По абсолютной конфигурации молекулы
По абсолютной конфигурации молекулы выделяют D- и L-формы. Различия между изомерами связаны с взаимным расположением четырех замещающих групп, находящихся в вершинах воображаемого тетраэдра, центром которого является атом углерода в а-положении.
В белке любого организма содержится только один изомер, для млекопитающих это L-аминокислоты. Однако оптические изомеры претерпевают самопроизвольную неферментативную рацемизацию, т.е. L-форма переходит в D-форму. Это обстоятельство используется для определения возраста, например, костной ткани зуба (в криминалистике, археологии).
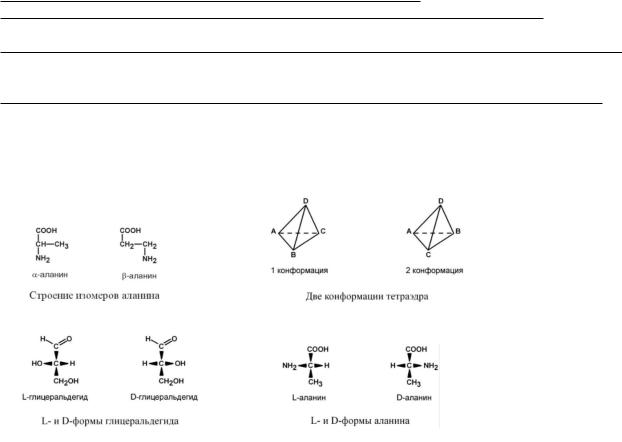
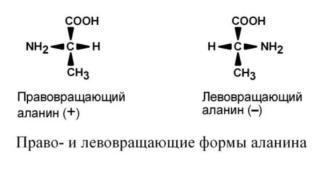
По оптической активности
По оптической активности аминокислоты делятся на право- и левовращающие. Наличие ассиметричного атома углерода (хирального центра) делает возможным только два расположения химических
групп вокруг него. Это приводит к особому отличию веществ друг от друга, а именно – изменению направления вращения плоскости поляризации
поляризованного света, проходящего через раствор. Величину угла поворота определяют при помощи поляриметра. В соответствии с углом поворота выделяют правовращающие (+) и левовращающие (-) изомеры.
Деление на L- и D-формы не соответствует делению на право- и левовращающие. Для одних аминокислот L-формы (или D-формы) являются правовращающими, для других– левовращающими. Например, L-аланин – правовращающий, а L-фенилаланин – левовращающий. При смешивании L- и D- форм одной аминокислоты образуется рацемическая смесь, не обладающая оптической активностью.
По участию аминокислот в синтезе белков
Выделяют протеиногенные (20 АК) и непротеиногенные (около 40 АК). Все протеиногенные аминокислоты являются а-аминокислотами.
На примере протеиногенных аминокислот можно показать дополнительные способы классификации:
по строению бокового радикала – неполярные (алифатические, ароматические) и полярные (незаряженные, отрицательно и положительно заряженные),
электрохимическая – по кислотно-основным свойствам подразделяют нейтральные (большинство), кислые (Асп, Глу) и основные (Лиз, Арг, Гис) аминокислоты,
физиологическая классификация – по необходимости для организма выделяют незаменимые (Лей, Иле, Вал, Фен, Три, Тре, Лиз, Мет) и заменимые. Две аминокислоты являются условно незаменимыми (Арг, Гис), т.е. их синтез происходит в недостаточном количестве.
№6. Уровни организации структуры белковых молекул (первичная, вторичная, третичная, четвертичная). Связи, участвующие в формировании уровней структуры белка. Функциональные группы аминокислот, ответственные за образование этих связей. Четвертичная структура белков. Что такое комплементарность протомеров? В чем заключаются кооперативные изменения конформации протомеров?
Первичная структура.
Это последовательность аминокислот в полипептидной цепи. Учитывая, что в синтезе белков принимает участие 20 аминокислот можно сказать о невообразимом количестве возможных белков.
Первичная структура белков задается последовательностью нуклеотидов в ДНК. Выпадение, вставка, замена нуклеотида приводит к изменению аминокислотного состава и, следовательно, структуры синтезируемого белка. Если изменение последовательности аминокислот носит не летальный характер, а приспособительный или хотя бы нейтральный, то такой белок может передаться по наследству и остаться в популяции. В результате возникают новые белки и новые качества организма. Такое явление называется
полиморфизм белков.
Последовательность и соотношение аминокислот в первичной структуре определяет формирование вторичной, третичной и четвертичной структур.
Вторичная структура.
Вторичная структура – это способ укладки полипептидной цепи в упорядоченную структуру, при которой аминокислоты взаимодействуют через пептидные группы. Формирование вторичной структуры вызвано стремлением
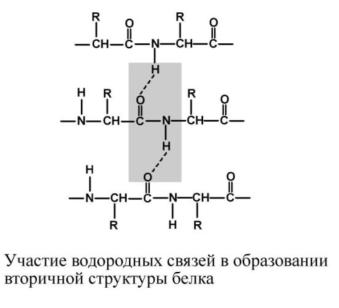
пептида принять конформацию с наибольшим количеством водородных связей между пептидными группами. Вторичная структура определяется: устойчивостью пептидной связи, подвижностью С-С связи, размером аминокислотного радикала.
Все это вкупе с аминокислотной последовательностью приводит к строго определенной конфигурации белка.
Можно выделить два возможных варианта вторичной структуры: а-спираль и B- структура (B-складчатый слой). Вторичная структура образуется при участии только водородных связей между пептидными группами: атом кислорода одной группы реагирует с атомом водорода следующей, одновременно кислород этой пептидной группы связывается с водородом еще одной и т.д. В одном белке, как правило, присутствуют a-спираль и B-структура. В глобулярных белках преобладает a-спираль, в фибриллярных – B-складчатый слой.
a-спираль.
Правозакрученная спираль, образуется при помощи водородных связей между пептидными группами 1-го и 4-го, 4-го и 7-го, 7-го и 10-го и так далее аминокислотных остатков.
Формированию спирали препятствуют пролин и гидроксипролин, которые обуславливают “перелом” цепи, ее резкий изгиб.
Высота витка составляет 0,54 нм и соответствует 3,6 аминокислотных остатков, 5 полных витков соответствуют 18 аминокислотам и занимают 2,7 нм.
В-складчатый слой.
В этом способе укладки белковая молекула лежит "змейкой", удаленные отрезки цепи оказываются поблизости друг от друга. В результате пептидные группы ранее удаленных аминокислот белковой цепи способны взаимодействовать при помощи водородных связей.
При формировании В-структуры аминокислоты взаимодействуют с отдаленными пептидными группами этой же белковой цепи при помощи водородных связей
между пептидными группами.
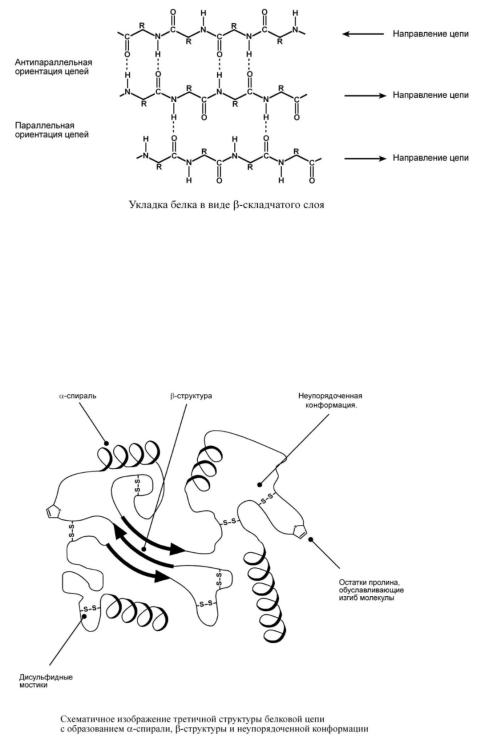
Ориентация реагирующих участков может быть параллельна (когда соседние цепи идут в одном направлении) или антипараллельна (цепи идут в противоположном направлении). Таких взаимодействующих друг с другом участков одного белка может быть от двух до пяти.
Третичная структура.
Третичная структура – это укладка полипептидной цепи в глобулу ("клубок"). Четкой границы между вторичной и третичной структурами провести нельзя, однако в основе третичной структуры лежат стерические взаимосвязи между аминокислотами, отстоящими далеко друг от друга в цепи. Благодаря третичной структуре происходит еще более компактное формирование цепи.
Наряду с а-спиралью и В-структурой в третичной структуре обнаруживается так называемая неупорядоченная конформация, которая может занимать значительную часть молекулы. В разных белках наблюдается разное соотношение типов структур.
Аминокислоты принимают участие в формировании третичной структуры, образуя связи между своими функциональными группами (радикалами): водородные – между ОН-, СООН-, NH2-группами радикалов аминокислот, дисульфидные – между остатками цистеина,
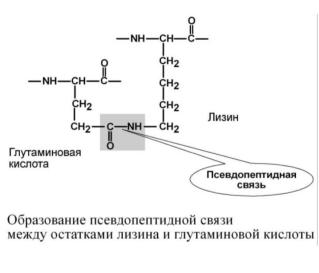
гидрофобные – между остатками алифатических и ароматических аминокислот,
ионные – между СООН-группами глутамата и аспартата и NH2-группами лизина и аргинина,
псевдопептидные – между дополнительными СООН-группами глутамата и аспартата и дополнительными NH2-группами лизина и аргинина.
Четвертичная структура.
Если белки состоят из двух и более полипептидных цепей, связанных между собой нековалентными (не пептидными и не дисульфидными) связями, то говорят, что они обладают четвертичной структурой. Такие агрегаты стабилизируются водородными связями, ионными и электростатическими взаимодействиями между остатками аминокислот, находящихся на поверхности глобулы.
Подобные белки называются олигомерами, а их индивидуальные цепи – протомерами (мономерами, субъединицами). Если белки содержат 2 протомера, то они называются димерами, если 4, то тетрамерами и т.д.
Взаимодействие протомеров друг с другом осуществляется по принципу комплементарности, т.е. их поверхность подходит друг другу по геометрической форме и по функциональным группам аминокислот (возникновение ионных и водородных связей).
Так как субъединицы в олигомерах очень тесно взаимодействуют между собой, то любое изменение конформации какой-либо одной субъединицы обязательно влечет за собой изменение других субъединиц. Этот эффект называется
кооперативное взаимодействие. Например, у гемоглобина такое взаимодействие субъединиц в легких ускоряет в 300 раз присоединение кислорода к гемоглобину. В тканях отдача кислорода также ускоряется в 300 раз.
Присоединение в легких первой молекулы кислорода к одной из субъединиц гемоглобина изменяет ее конформацию. В результате она начинает влиять на следущую убъединицу, облегчая присоединение к ней кислорода. После этого они вдвоем влияют на третью субъединицу и так далее. В тканях первая молекула кислорода отделяется от своей субъединицы не очень легко, вторая уже быстрее и так далее.
