
Тема 7 (аминокислоты)
.pdfТема: «Аминокислоты: структура, функции, биологически важные
реакции»
Вопросы:
1.Аминокислоты: строение, номенклатура, биологическая роль,
2.Классификация аминокислот: по строению радикала, кислотно-основному характеру, возможности синтеза в организме. Стереоизомерия
3.аминокислот.
4.Кислотно-основное поведение аминокислот: биполярная структура,
5.изоэлектрическая точка, зависимость суммарного заряда от рН среды.
6.Биологически важные реакции аминокислот: отщепление, перенос,
7.присоединение аминогруппы.
8.Биологически важные реакции аминокислот: декарбоксилирование,
гидроксилирование, окисление и восстановление тиольных групп.
9. имические сво ства -аминокислот как гетерофункциональных соединени : образование внутрикомплексных соле , реакции этерификации,
ацилирования, образования иминов. Взаимоде ствие с азотисто кислото .
Качественные реакции -аминокислот.
Теория
1. Номенклатура, строение, стереоизомерия аминокислот.
Аминокислоты – это полифункциональные производные углеводородов, в молекулах которых обязательно наличие карбоксильно группы COOH и аминогруппы NH2.
Аминокислоты имеют важное значение, так как являются основно структурно составляюще белков. В природных белках встречается всего 20
аминокислот, причем все они содержат карбоксильную и аминогруппы у одного и того же атома углерода, то есть являются -аминокислотами:
1

H
H2N  C
C
 COOH
COOH
R
Номенклатура.
По систематической номенклатуре названия аминокислот образуются из названи соответствующих кислот прибавлением приставки
амино- и указанием места расположения аминогруппы по отношению к карбоксильно группе. Нумерация углеродно цепи начинается с атома углерода старше карбоксильно группы.
Например:
По рациональной номенклатуре к тривиальному названию карбоново кислоты добавляется приставка амино- с указанием положения аминогруппы букво греческого алфавита.
Например:
Названия аминокислот произошли в основном от исходных материалов, из которых они были впервые выделены. Например, аспарагин
(от лат. asparagus - спаржа) получен из сока спаржи; цистеин и цистин (от греч. cystis - мочево пузырь) - из камне мочевого пузыря. Глутамин и глутаминовая кислота (от нем. das Gluten - кле ковина) - из кле ковины пшеницы; серин (от греч. seros - шелковичны червь) - из шелка; тирозин
(от греч. tyros - сыр) - из сыра.
2
Другие названия связаны с методами выделения. Так, аргинин (от лат.
argentum — серебро) был впервые получен в виде серебряно соли.
Триптофан выделен при расщеплении белка с помощью трипсина.
Структурные связи с другим природным соединениями также внесли вклад в названия некоторых аминокислот. Так, валин назван, как
производное валерианово кислоты; треонин структурно связан с
моносахаридом треозо . Название «пролин» происходит от рационального обозначения пирролидин-2-карбоново кислоты.
Двадцать важне ших - аминокислот имеют тривиальные названия,
рекомендуемые правилами IUPAC, которые приведены в таблице 6.1.
Строение - аминокислот.
Общая структурная особенность - аминокислот – наличие амино- и
карбоксильно групп, соединенных с одним и тем же - углеродным атомом.
H
H2N  C
C
 COOH
COOH
R
R – радикал аминокислот. В просте шем случае он представлен атомом водорода (глицин), но может иметь и более сложное строение.
Стереоизомерия аминокислот.
Все природные - аминокислоты, кроме глицина (NH2 CH2 COOH),
имеют асимметрически атом углерода ( -углеродны атом), а некоторые из них даже два хиральных центра, например, треонин. Таким образом, все аминокислоты могут существовать в виде пары несовместимых зеркальных антиподов (энантиомеров).
За исходное соединение, с которым принято сравнивать строение -
аминокислот, условно принимают D- и L-молочные кислоты, конфигурации которых, в свою очередь, установлены по D- и L-глицериновым альдегидам.
3

H |
|
|
O |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
C |
|
|
|
|
|
COOH |
|
|
|
COOH |
|||||||||
H |
|
|
OH |
|
|
H |
|
|
|
OH |
|
|
H |
|
|
|
NH2 |
||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
CH2OH |
|
|
|
|
|
CH3 |
|
|
|
R |
|||||||||
D-глицериновый |
|
|
D-молочная |
|
|
аминокислота |
|||||||||||||||
|
альдегид |
|
|
|
кислота |
|
|
D-ряда |
|||||||||||||
H |
|
|
O |
|
|
|
|
COOH |
|
|
|
|
COOH |
||||||||
|
|
C |
|
|
|
|
|
|
|
|
|||||||||||
HO |
|
|
|
H |
|
|
|
HO |
|
|
|
H |
|
|
|
H2N |
|
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
CH2OH |
|
|
|
|
CH3 |
|
|
|
|
R |
|||||||||
L-глицериновый |
|
|
L-молочная |
|
|
аминокислота |
|||||||||||||||
альдегид |
|
|
кислота |
|
|
L-ряда |
|||||||||||||||
Для определения конфигурации -аминокислоты в качестве эталона
часто используют серин (иногда аланин). Конфигурации их так же выведены
из конфигураци D- и L-глицериновых альдегидов:
|
COOH |
|
|
COOH |
|
COOH |
|
|
COOH |
||||||||
H |
|
|
NH2 |
|
H2N |
|
|
H |
H |
|
|
NH2 |
|
H2N |
|
|
H |
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
|
|
|
|
|||||||||
|
CH2OH |
|
|
CH2OH |
|
CH3 |
|
|
CH3 |
||||||||
|
D-серин |
|
|
L-серин |
D-аланин |
|
L-аланин |
||||||||||
ПРИРОДНЫЕ АМИНОКИСЛОТЫ, ВХОДЯЩИЕ В СОСТАВ БЕЛКОВ,
ОТНОСЯТСЯ К L-РЯДУ!
D-формы аминокислот встречаются сравнительно редко, они синтезируются только микроорганизмами и называются «неприродными» аминокислотами. Животными организмами D-аминокислоты не усваиваются.
Интересно отметить де ствие D- и L-аминокислот на вкусовые рецепторы: большинство аминокислот L-ряда имеют сладки вкус, а
аминокислоты D-ряда горькие или безвкусные.
Без участия ферментов самопроизвольны переход L-изомеров в D-
изомеры с образованием эквимолярно смеси - рацемической смеси
осуществляется в течение достаточно длительного промежутка времени.
4

Рацемизация каждо L-кислоты при данно температуре идет с определенно скоростью. Это обстоятельство можно использовать для установления возраста люде и животных. Так, например, в твердо эмали зубов имеется белок дентин, в котором L-аспартат переходит в D-изомер при температуре тела человека со скоростью 0,01% в год. В период формирования зубов в дентине содержится только L-изомер, поэтому по содержанию D-аспартата можно рассчитать возраст человека или животного.
2. Аминокислоты, входящие в состав белков: классификация с учетом химической природы радикала. Незаменимые аминокислоты.
Классификация.
В настоящее время едино классификации аминокислот не существует.
Аминокислоты делят на природные (содержатся в растительных и животных организмах) и синтетические – полученные искусственным путем.
Организм синтезирует аминокислоты главным образом из пищевых белков. Но есть целая группа аминокислот, которых организм сам синтезировать не может – незаменимые аминокислоты.
Запомните названия незаменимых аминокислот:
ВАЛИН, ЛЕЙЦИН, ИЗОЛЕЙЦИН, ЛИЗИН, ТРЕОНИН, МЕТИОНИН, ФЕНИЛАЛАНИН,
ТРИПТОФАН
Внастоящее время известно свыше 150 аминокислот, но только 20 из них входят в состав белков.
Втаблице 3.1. приведена классификация 20 основных -аминокислот белков в зависимости от строения их радикала.
5
Таблица36.1.
Классификация - аминокислот
Формула и Сокращенное русское и латинское тривиальное названия
название
I.Аминокислоты
салифатическими радикалами
|
|
|
|
|
|
COOH |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
Гли, Gly |
H2N |
|
|
|
|
C |
|
|
|
|
H |
||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
H |
|
|||||||
1. Глицин |
|
|||||||||||||
|
|
|
|
|
|
COOH |
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
Ала, Ala |
||
H2N |
|
|
|
|
C |
|
|
H |
||||||
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
CH3 |
|
|||||||
2. Аланин |
|
|||||||||||||
|
|
COOH |
|
|||||||||||
|
|
|
|
|
|
|
||||||||
H2N |
|
C |
|
H |
Вал, Val |
|||||||||
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH |
|
|||||||||||
H C |
|
|
|
|
|
|
|
|
|
|
|
CH3 |
|
|
3 |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
3. Валин
|
|
COOH |
|
|||
|
|
|
|
|
|
|
H2N |
|
C |
|
H |
Ле , Leu |
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
CH2 |
|
||
CH
H3C CH3
4. Ле цин
COOH
H2N C H
Иле, Ile
H C CH3
CH2
CH3
5. Изоле цин
II. Аминокислоты, содержащие в алифатическом радикале дополнительную функциональную группу
COOH
H2N C
C H
H
Сер, Ser
CH2OH
6. Серин
6

|
|
|
|
|
COOH |
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H2N |
|
|
C |
|
|
H |
Тре, Thr |
|||||||
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
H |
|
|
|
C |
|
|
|
|
OH |
|||||
|
|
|
|
|
||||||||||
|
|
|
|
|
||||||||||
|
|
|
|
|
CH3 |
|
||||||||
7. Треонин |
|
|||||||||||||
|
|
|
|
|
|
COOH |
|
|||||||
|
|
|
|
|
|
|
||||||||
H2N |
|
C |
|
H |
Асп, Asp |
|||||||||
|
|
|||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|||||||
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
COOH |
|
|||||||
8. Аспарагиновая |
|
|||||||||||||
кислота |
|
|||||||||||||
|
|
|
|
|
|
COOH |
|
|||||||
|
|
|
||||||||||||
H2N |
|
C |
|
H |
|
|||||||||
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
CH2 |
Глу, Glu |
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
||||||
|
|
|
|
|
|
COOH |
|
|||||||
9. Глутаминовая |
|
|||||||||||||
кислота |
|
|||||||||||||
COOH
H2N  C
C H
H
CH2 Асн, Asn
C
H2N O
10. Аспарагин
|
|
|
|
|
|
COOH |
|
||||||||||||||
H2N |
|
|
C |
|
|
|
H |
|
|
||||||||||||
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
CH2 |
|
|
|
Глн, Gln |
||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
|
|
|
||||||||||
|
|
|
|
|
|
C |
|
|
|
|
|
|
|
|
|
|
|||||
H2N |
|
|
|
|
|
|
|
|
|
O |
|
|
|
||||||||
11. Глутамин |
|
||||||||||||||||||||
|
|
|
|
|
|
COOH |
|
||||||||||||||
H2N |
|
|
|
C |
|
|
H |
|
Лиз, Lys |
||||||||||||
|
|
|
|
|
|
||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
) |
|
||
|
|
|
|
(CH |
2 |
4 |
|||||||||||||||
|
|
|
|
|
|||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
NH2 |
|
|
|
|
|||||||||||
12. Лизин |
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|||||||||||
|
|
|
|
|
COOH |
|
|||||||||||||||
H2N |
|
|
C |
|
|
|
H |
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
) |
|
|
|
||||||
|
|
|
|
(CH |
2 |
3 |
Арг, Arg |
||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
NH |
|
|
|
|
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
NH |
|
|||||||
|
|
|
|
|
C |
|
|
|
|
|
|
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
||||||||||
|
|
|
|
|
NH2 |
|
|
|
|
|
|||||||||||
13. Аргинин |
|
||||||||||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
7
|
|
|
|
COOH |
|
|||||
H2N |
|
|
|
C |
|
|
|
H |
Цис, Cys |
|
|
|
|
|
|||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
CH2 |
|
||||
|
|
|
|
SH |
|
|||||
14. Цистеин |
|
|||||||||
|
|
|
|
|
|
|||||
|
|
|
|
COOH |
|
|||||
H2N |
|
C |
|
H |
Мет, Met |
|||||
|
|
|||||||||
|
|
|
|
|
|
|||||
|
|
|
|
|
CH2 |
|||||
|
|
|
|
|
CH2 |
|
||||
|
|
|
|
S |
|
|||||
|
|
|
|
|
|
|
||||
|
|
|
|
CH3 |
|
|||||
15. Метионин |
|
|||||||||
|
|
|
|
|
|
|
|
|
|
|
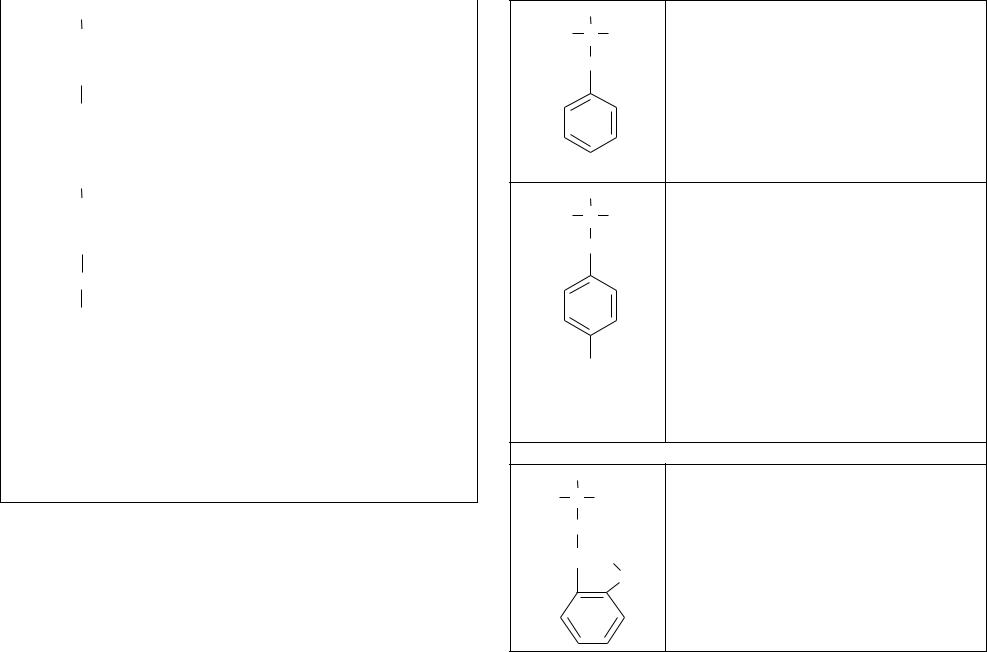
III. Аминокислоты, содержащие ароматический радикал
COOH |
|
H2N C H |
|
CH2 |
Фен, Phe |
|
16. Фенилаланин |
|
COOH |
|
H2N C H |
|
CH2 |
Тир, Tyr |
|
OH
17. Тирозин
IV. Аминокислоты с гетероциклическими радикалами
COOH |
|
H2N C H |
Три, Trp |
CH2 H
C C
C
NH
8

18. Триптофан |
|
|
|
H |
|
|
|
COOH |
|
||||||||||||
|
|
|
|
||||||||||||||||||
|
|
COOH |
|
|
|
|
|
|
|
|
|
|
|||||||||
|
|
Гис, His |
|
|
N |
|
|
C |
|
H |
Про, Pro |
||||||||||
|
|
|
|
|
|
|
|||||||||||||||
|
|
|
|
|
|
|
|
|
H C |
|
|
|
|
|
|
||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||||
H2N C |
H |
||||||||||||||||||||
|
|
2 |
CH2 |
|
|
CH2 |
|
||||||||||||||
|
|
|
|
|
|
|
|
|
|
||||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||||||
|
|
CH2 |
|
|
|
||||||||||||||||
|
|
|
|
|
20. Пролин |
|
|||||||||||||||
|
|
C |
|
|
|
N |
|
|
|
|
|||||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|||||
|
|
|
|
|
|
|
CH |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
C |
|
|
|
N |
|
|
|
|
|
|
|
|
|
|
|
|
|
||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
||||
|
|
H |
|
|
H |
|
|
|
|
|
|
|
|
|
|
|
|
|
|||
19. Гистидин
V. Иминокислота
9

3.Кислотно-основные свойства, биполярная структура.
Изоэлектрическая точка нейтральных, кислых и основных
аминокислот.
При растворении в воде аминокислоты ионизируются и ведут себя как кислоты или основания. Знание кислотно-основных сво ств аминокислот имеет исключительно важное значение для понимания многих сво ств белков, методов их разделения, идентификации и количественного анализа.
- аминокислоты, содержащие одну аминогруппу и одну карбоксильную группу, кристаллизуются из не тральных водных растворов в виде полностью ионизированных молекул, которые называют биполярными ионами или цвиттер-ионами (что по-немецки означает «гибридные ионы»):
|
|
COOH |
+ |
COO - |
|||||||
|
|
|
|
|
|
|
|
|
|
||
H2N |
|
C |
|
H |
|
|
|
|
|||
|
|
H3N |
|
C |
|
H |
|||||
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
R |
||||||
неионная форма |
биполярная форма |
||||||||||
|
|
|
|
|
|
(цвиттер-ион) |
|||||
В водном растворе аминокислоты существуют в форме биполярных ионов, которые функционируют либо как кислоты (доноры протонов):
+ |
COO - |
+ |
COOH |
||||||||
|
|
|
H + H+ |
|
|
|
|
||||
|
|
|
|
|
|
|
|||||
H3N |
|
C |
|
H3N |
|
C |
|
H |
|||
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
||
|
|
R |
|
|
R |
||||||
Либо как основания (акцепторы протонов):
+ |
|
COO - |
|
|
COO- |
||||||
|
|
|
|
|
|
|
|
|
H + H + |
||
H3N |
|
C |
|
H |
H2N |
|
C |
|
|||
|
|
||||||||||
|
|
|
|
||||||||
|
|
|
|
|
|
|
|
|
|
|
|
|
|
R |
|
|
R |
||||||
Вещества с такими |
дво ственными сво ствами являются |
||||||||||
амфотерными или амфолитами
Простая моноаминомонокарбоновая -аминокислота, такая, как аланин, представляет собо по существу двухосновную кислоту, когда она
10
