
Тема 3 (классификация и свойства карбоновых кислот и тиофэиров)
.pdfКлассификация и свойства карбоновых кислот и тиоэфиров
Вопросы:
1. Классификация карбоновых кислот по: числу карбоксильных групп
(основности), насыщенности, наличию функциональной группы, числу углеродов в цепи. ω- номенклатура ВЖК.
2.Изомерия карбоновых кислот: структурная и пространственная.
3.Физические свойства карбоновых кислот. Реакционные центры карбоновых кислот. Закономерности в изменении кислотных свойств.
4.Химические свойства с участием карбоксильной группы:
этерификация.
5. Свойства карбоновых кислот и тиоэфиров по радикалу:
-предельному (дегидрирование, конденсация);
-непредельному (гидрирование, гидратация, окисление);
-содержащему гидроксильную группу (дегидрирование, дегидратация,
изомеризация, этерификация);
- содержащему оксогруппу (гидрирование, тиолазное расщепление,
декарбоксилирование, карбоксилирование). Гидролиз тиоэфиров,
изомеризация.
6. Производные карбоновых кислот (соли, амиды, ангидриды, сложные эфиры), их получение.
Теория
Карбоновые кислоты – производные углеводородов, в которых один или несколько атомов водорода замещены на карбоксильную группу.
Классификация карбоновых кислот
Классификация |
Пример |
Название |
|
|
тривиальное систематическое |
По количеству карбоксильных групп в молекуле:
Монокарбоновые HCOOH |
Муравьиная/ |
Метановая |
кислоты |
формиаты |
|
CH3COOH |
Уксусная/ |
Этановая |
|
|
ацетаты |
|
|
CH3CH2COOH |
Пропионовая |
Пропановая |
|
|
/пропионаты |
|
|
CH3(CH2)2COOH |
Масляная/ |
Бутановая |
|
|
бутираты |
|
|
CH3(CH2)3COOH |
Валерианова |
Пентановая |
|
|
я/валериаты |
|
Дикарбоновые |
HOOC-COOH |
Щавелевая/ |
Этандиовая |
кислоты |
|
оксалаты |
|
|
HOOC-CH2-COOH |
Малоновая |
Пропандиовая |
|
|
/малонаты |
|
|
HOOC-(CH2)2-COOH |
Янтарная/ |
Бутандиовая |
|
|
сукцинаты |
|
|
HOOC-(CH2)3-COOH |
Глутаровая/ |
Пентандиовая |
|
|
глутараты |
|
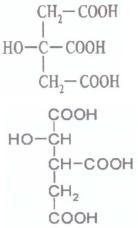
Трикарбоновые |
|
Лимонная |
2-гидрокси-1,2,3- |
кислоты |
|
/цитраты |
пропантрикарбон |
|
|
|
овая кислота |
|
|
Изолимонная |
1-гидрокси-1,2,3- |
|
|
/изоцитраты |
пропантрикарбон |
|
|
|
овая кислота |
По степени насыщенности: |
|
|
|
Насыщенные |
CH3COOH |
Уксусная/ |
Этановая |
|
|
ацетаты |
|
Ненасыщенные |
CH2=CH-COOH |
Акриловая/ |
Пропеновая |
монокарбоновые |
|
акрилаты |
|
Ненасыщенные |
HOOC-CH=CH- |
Цис-изомер – |
Бутен-2-диовая |
дикарбоновые |
COOH |
малеиновая |
|
|
Транс-изомер |
|
|
- фумаровая |
|
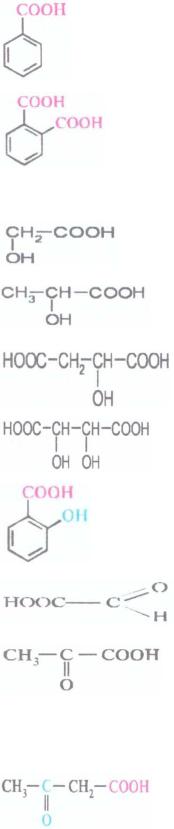
Ароматические |
Бензойная |
Бензойная |
|
кислота |
кислота |
|
Фталевая |
1,2- |
|
кислота |
бензолдикарбо- |
|
|
новая кислота |
По характеру гетероатома в радикале |
|
|
Гидроксикарбо- |
Гликолевая/ |
Гидроксиэтано- |
новые кислоты |
гликолаты |
вая |
|
Молочная/ |
2-гидрокси- |
|
лактаты |
пропановая |
|
|
|
|
Яблочная/ |
2-гидроксибутанди- |
|
малаты |
овая |
|
|
|
|
Винная/ |
2,3-дигидрокси- |
|
тартраты |
бутандиовая |
|
Салициловая/ |
2-гидрокси- |
|
салицилаты |
бензойная |
|
|
кислота |
Гидроксикарбо- |
Глиоксиловая/ |
Оксоэтановая |
новые кислоты |
глиоксилаты |
кислота |
|
Пировиноград |
2-оксопропановая |
|
ная/ |
кислота |
|
пируваты |
|
|
(ПВК) |
|
|
β-оксомасля- |
3-оксобутановая |
|
ная |
|
|
(ацетоуксусная)/ |
|
|
ацетоацетаты |
|
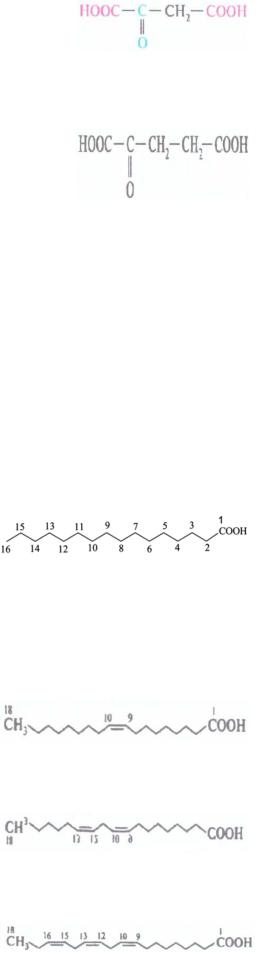
ЩавелевоукОксобутандиовая сусная/ кислота оксалоацетаты
(оаа)
α-оксоглута- 2-оксопентан-
ровая (α- диовая кислота кетоглута-
ровая)/α-
кетоглутарат
(α-КГ)
По числу атомов углерода в цепи:
Низшие |
CH3CH2COOH |
Пропионовая/ |
Пропановая |
|
кислоты |
|
пропионаты |
|
|
Высшие |
- предельные ВЖК |
|
|
|
жирные |
C15H31COOH или CH3(CH2)14COOH |
Пальмитино- |
С16:0 |
|
кислоты |
|
вая |
|
|
(ВЖК) – |
|
|
|
|
содер- |
C17H35COOH |
Стеариновая |
С18:0 |
|
|
|
|
|
|
жат |
- непредельные ВЖК |
|
|
|
|
|
|
|
|
|
C17H33COOH |
Олеиновая |
С18:1, |
9 |
более 10 |
|
|||
атомов |
CH3(CH2)7CH=CH(CH2)7COOH |
|
|
|
|
|
|
|
|
углеро- |
|
|
|
|
да в |
C17H31COOH |
Линолевая |
С18:2, |
9,12 |
|
|
|||
цепи CH3(CH2)4CH=CHCH2CH=CH(CH2)7COOH
C17H29COOH |
Линоленовая С18:3, |
9,12,15 |
|
CH3CH2(CH=CHCH2)3(CH2)6COOH

C19H31COOH |
Арахидоновая С20:4, |
CH3(CH2)3(CH=CHCH2)4(CH2)2COOH |
5,8,11,14 |
|
Природные ВЖК, как правило, содержат четное количество атомов углерода. Условно их состав обозначается: С16:0. Это означает, что в состав молекулы входит 16 атомов углерода и отсутствуют двойные связи.
Положение двойной связи в жирных кислотах обозначается знаком с
надстрочным индексом, соответствующим минимальному номеру атома углерода при двойной связи. Например, 9 – двойная связь находится при девятом атоме углерода.
Для полиненасыщенных кислот используется другая система записи, в
которой атомы углерода нумеруются в обратном порядке: последнему атому углерода присваивается номер 1 и его же означают греческой буквой ω
(«омега»). Положение двойных связей указывают по отношению к ω-
углероду. Так, линолевая кислота обозначается как С18:3, ω-3 (омега-3):
Выделяют три семейства ненасыщенных кислот: ω-3, ω-6, ω-9. Для нормального метаболизма важен баланс между полиненасыщенными жирными кислотами (ПНЖК). Несбалансированность ПНЖК в рационе питания повышает риск развития сердечно-сосудистых заболеваний.
Оптимальное соотношение ω-3 и ω-6 кислот находится в интервале от 1:1 до
4:1. ВЖК, содержащие 2 и более двойных связей: линолевая, линоленовая,
арахидоновая (комплекс этих кислот объединяют в группу витаминов F) в
организме не синтезируются, их называют незаменимыми (эссенциальными)
кислотами. Рекомендуется получать их с пищей в количестве около 5 г в
день. Рыбий жир содержит много ω-3 кислот, поэтому его часто прописывают пациентам с заболеваниями сердечно-сосудистой системы.
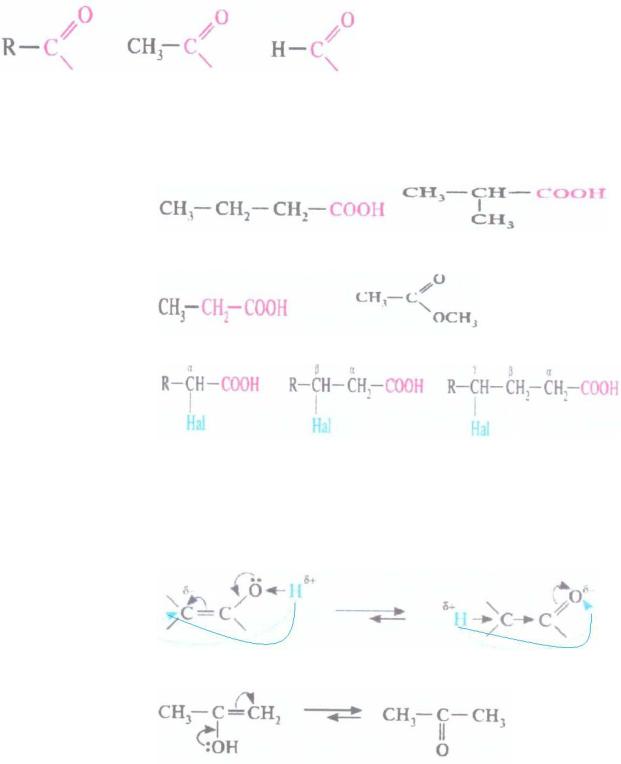
Остатки карбоновых кислот, образующиеся в результате удаления гидроксильной группы, называют:
ацил |
ацетил |
формил |
Типы изомерии карбоновых кислот
Структурная изомерия:
углеродного
скелета
|
масляная кислота |
изомасляная кислота |
|
|
межклассовая |
|
|
|
|
|
пропановая кислота |
метилацетат |
|
|
положения |
|
|
|
|
функциональной |
|
|
|
|
группы |
|
|
|
|
|
α-гидроксокарбоновая |
β- гидроксокарбоновая |
γ- |
|
|
гидроксокарбоновая |
|
|
|
|
кислота |
кислота |
кислота |
|
прототропная |
кето-енольная таутомерия: водород обратимо мигрирует |
|||
таутомерия |
от атома кислорода к углероду: |
|
|
|
(миграция атома водорода)
енольная форма кетонная форма
ацетон
Пространственная изомерия:
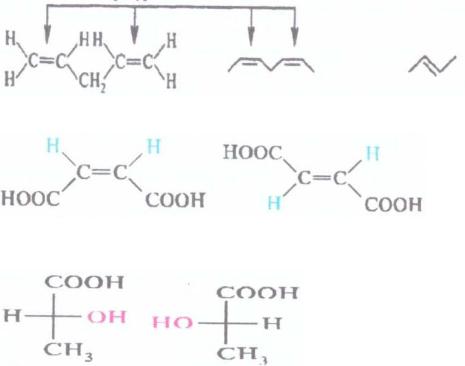
геометрическая |
цисконфигурация двойной связи |
сокращенная |
трансконфигурация |
запись |
двойной связи |
малеиновая кислота |
фумаровая кислота |
оптическая
D (+)- молочная |
L(–)- молочная |
кислота |
кислота |
Физические свойства карбоновых кислот зависят от числа атомов углерода и наличия гетероатомов в молекуле. Карбоновые кислоты представляют собой:
- жидкости с острым запахом, хорошо растворимые в воде – предельные кислоты состава C1-C9.
- твердые вещества, без запаха, растворимые в воде – дикарбоновые,
ненасыщенные кислоты состава C2-C4.
- твердые вещества, без запаха, нерастворимые в воде – предельные кислоты состава C10 и более.
Температуры плавления зависят от длины и степени насыщенности углеводородной цепи: при комнатной температуре насыщенные жирные кислоты C10-C24 – твердые вещества, а ненасыщенные – жидкие. Это обусловлено различной упаковкой молекул жирных кислот.
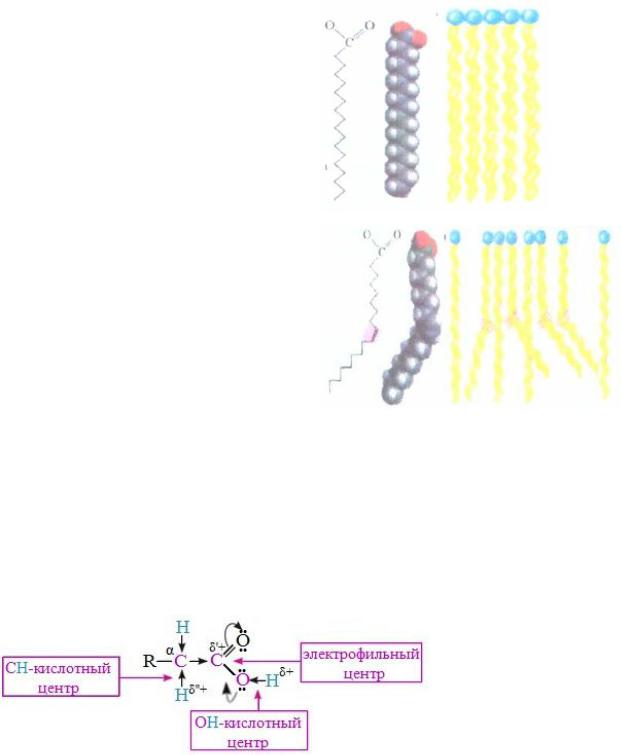
У насыщенных кислот:
- молекулы вытянуты за счет свободного вращения относительно σ-
связей, поэтому плотно упакованы;
- создаются более прочные Ван-дер-
Ваальсовы взаимодействия вдоль всей длины цепи.
У ненасыщенных кислот:
-появляются изгибы в районе двойных связей, поэтому отсутствует плотная упаковка в мембране;
-Ван-дер-Ваальсовы взаимодействия ослаблены.
Реакционные центры карбоновых кислот
Реакционная способность карбоновых кислот определяется наличием в их структуре: карбоксильной группы, кратных связей, функциональных групп.
Реакционные центры карбоновых кислот:
Закономерности в изменении кислотных свойств
Карбоновые кислоты способны отщеплять протон от карбоксильной группы с образованием карбоксилат-иона, устойчивость которого обусловлена делокализацией электронов между тремя атомами:
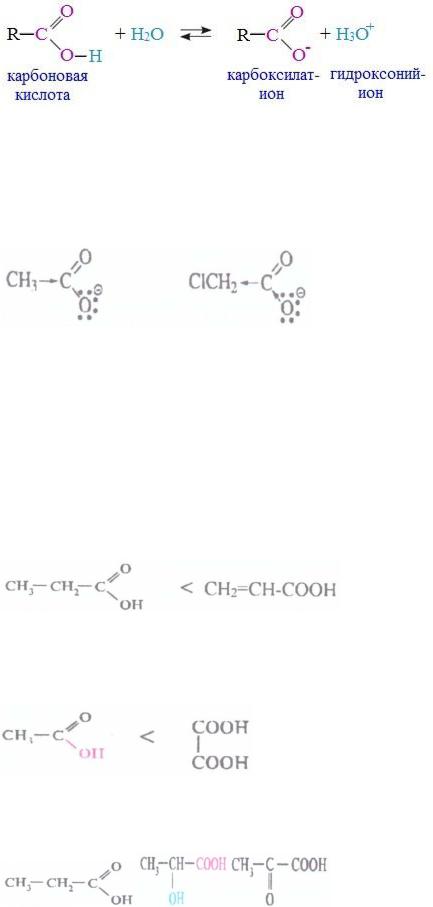
Кислота тем сильнее, чем устойчивее образуемый ион, поэтому группы атомов, притягивающие на себя электронную плотность
(электроноакцепторы, -I) стабилизируют и увеличивают силу кислот, а
электронодоноры (+I) – ослабляют:
менее стабильный анион |
более стабильный анион |
|
Кислотность усиливается с: |
|
Стабилизация иона за счет: |
Уменьшением длины радикала |
|
Уменьшения числа доноров в |
CH3CH2COOH ˂ CH3COOH ˂ HCOOH |
радикале |
|
Увеличением числа кратных |
связей |
в Сопряжения кратных связей |
радикале. Монокарбоновые: |
|
|
предельные ˂ непредельные |
|
|
пропионовая кислота |
акриловая кислота |
|
Увеличением числа карбоксильных групп в |
увеличение числа акцепторов в |
|
молекуле: |
|
радикале |
Увеличением степени окисления атома углерода:
пропионовая |
˂ молочная |
˂ пировиноградная |
кислота |
кислота |
кислота |
Кислота сильнее, когда:
-радикал короче;
-в молекуле присутствуют акцепторы.
Усиление кислотных свойств наблюдается в рядах:
-монокарбоновые: предельные ˂ непредельные
-монокарбоновые ˂ дикарбоновые
-предельные: монокарбоновые ˂ гидроксикислоты ˂ оксокислоты
Химические свойства карбоновых кислот и тиоэфиров
Тип реакции |
Пример |
Реакции по карбоксильной группе
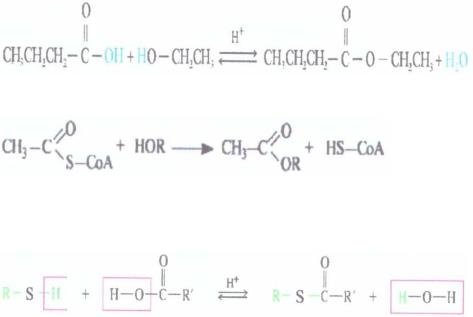
этерификация Сложные эфиры образуются при взаимодействии:
• спиртов как с карбоновыми кислотами, так и с их
тиоэфирами:
масляная кислота |
этилбутират |
Тиоэфиры карбоновых кислот образуются при взаимодействии карбоновых кислот с тиоспиртами:
Только ацетоуксусная кислота в организме ферментативно превращается в тиоэфир, получая SKoA от сукцинил-SKoA:
