
С1 Р1
.docxБИЛЕТ 1
Классификация органических реакций по типу реагента
по электронной природе реагентов (нуклеофильные, электрофильные, свободнорадикальные и т.д.)
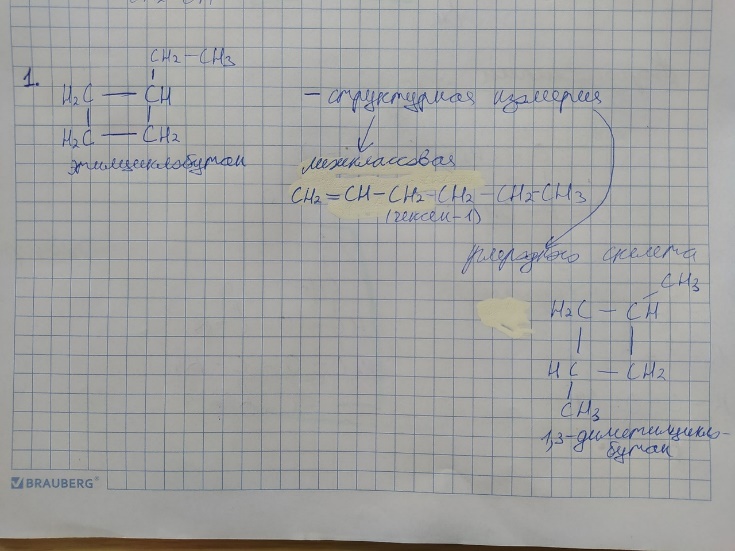
Виды изомерии, характерные для 2-аминопентана
1)у.в. скелета С5Н11NH2| C5H13N
2) Положение -NH2
3) межклассовая (с нитросоединениями, сложными эфирами)

БИЛЕТ 2
1)с55-56
основность зависит от:
1.Природы атома в основном центре(электроотрицательность гетероатома,размеров гетероатома)
основность увеличивается слева направо в ряду:
ch3-sh ch3-oh ch3-nh2
2.Характера заместителя,связанного с кислотным центром(электроноакцепторные заместители уменьшают основность,электродонорные увеличивают.
nh3<ch3-nh2<ch3-nh-ch3
анилин<ch3-nh2
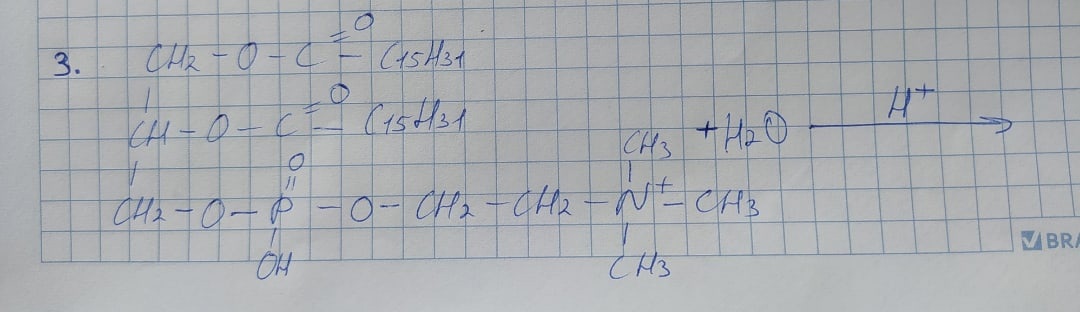
C17H33COOH -олеиновая кислота
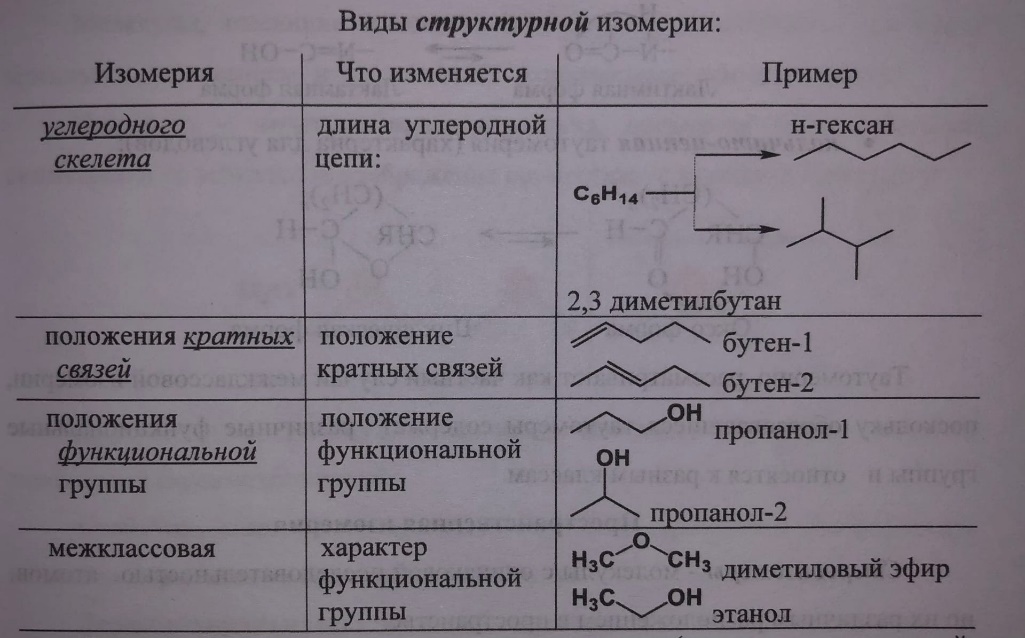
изомерия:
* структурная
- углеродного скелета
- межклассовая(сложные эфиры)
- положения кратной связи
* пространственная
-
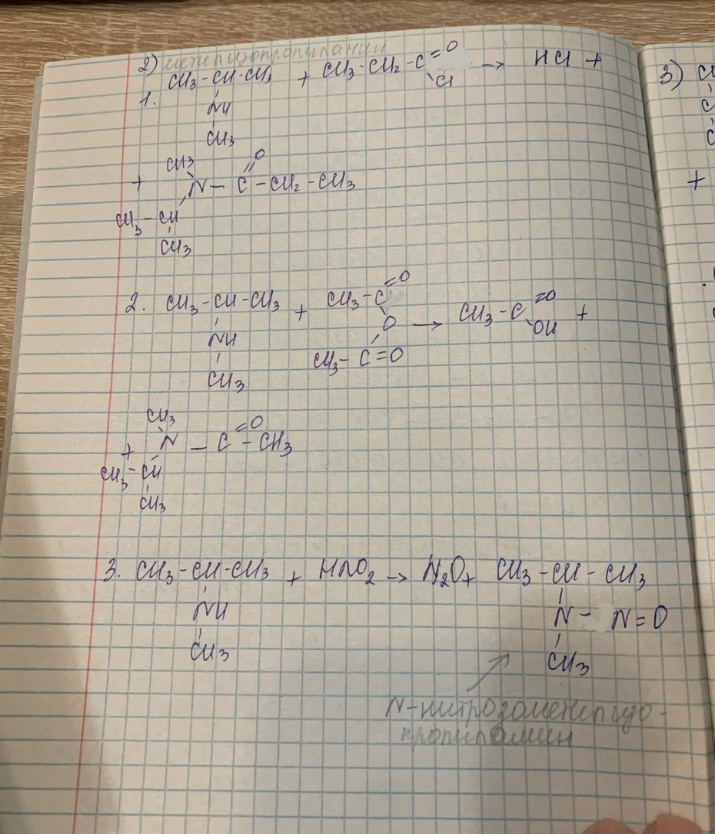 геометрическая(цис,транс)
геометрическая(цис,транс)
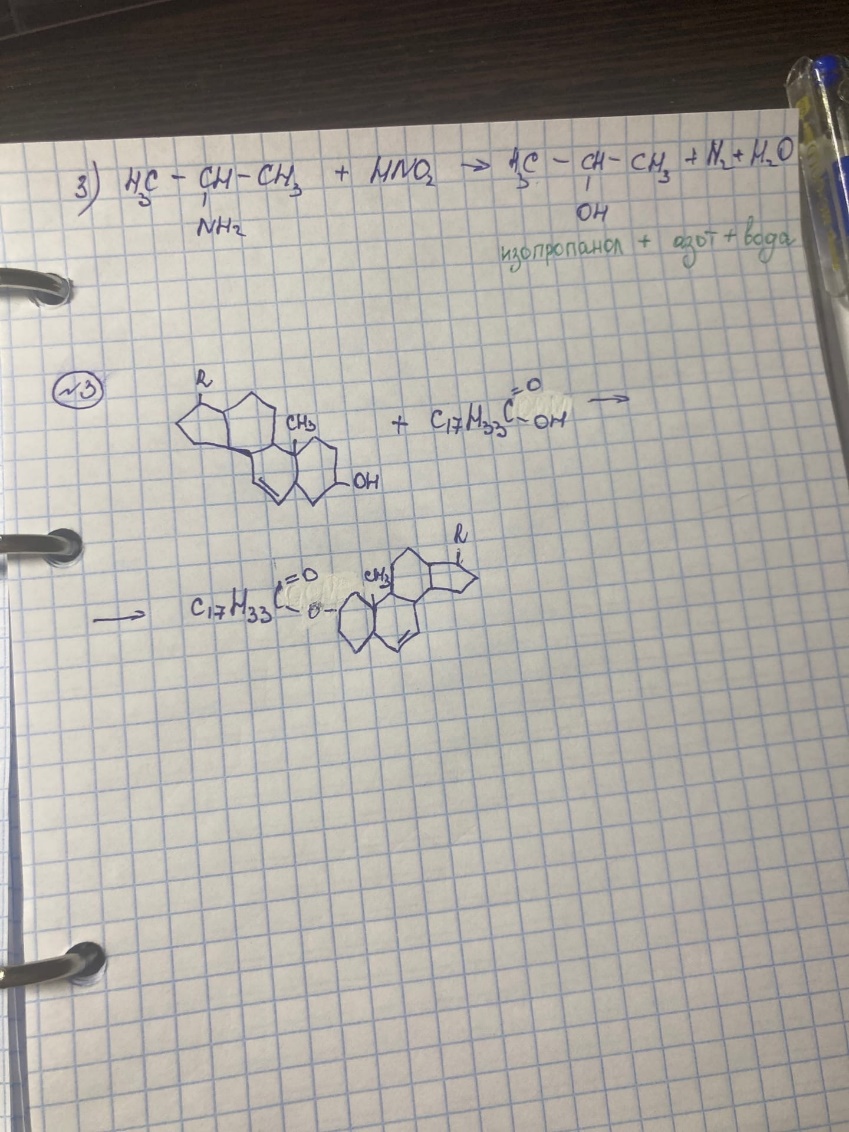
БИЛЕТ 3
1. Кислотность – это способность соединения отдавать протон, т.е. способность к диссоциации.
 Основность
– это способность соединения принимать
протон.
Основность
– это способность соединения принимать
протон.

 БИЛЕТ
4
БИЛЕТ
4


БИЛЕТ 5
1. В качестве конфигурационного стандарта используют D- и L-глицериновый альдегид: у левовращающего (-) энантиомера ОН-группа при хиральном центре находится слева (L), а у правовращающего энантиомера ОН-группа при ассиметричном атоме углерода находится справа (D).
Если в соединении несколько хиральных центров, то принадлежность изомера к D- или L-стереохимическому ряду определяют по последнему хиральному центру в проекции Фишера (есть исключения)
Благодаря абсолютной конфигурации можно установить истинное расположение атомов или атомных групп вокруг хирального центра.

БИЛЕТ 6
1. Зависимость кислот по Бренстеду. Электроотрицательность, чем она больше, тем лучше делокализован заряд сопряженного основания и сильнее кислота.
Тип гибридизации атомы в sp гибридизации более электроотрицательны
Поляризуемост, чем больше размер атома, тем более сильнее кислота
Электроакцепторность, чем больше электроакцепторов, тем сильнее кислота
Делокализация электронов в многостопном кислотном центре эффективнее стабилизирует анион сопряженного основания, поэтому сила кислот будет увеличиваться

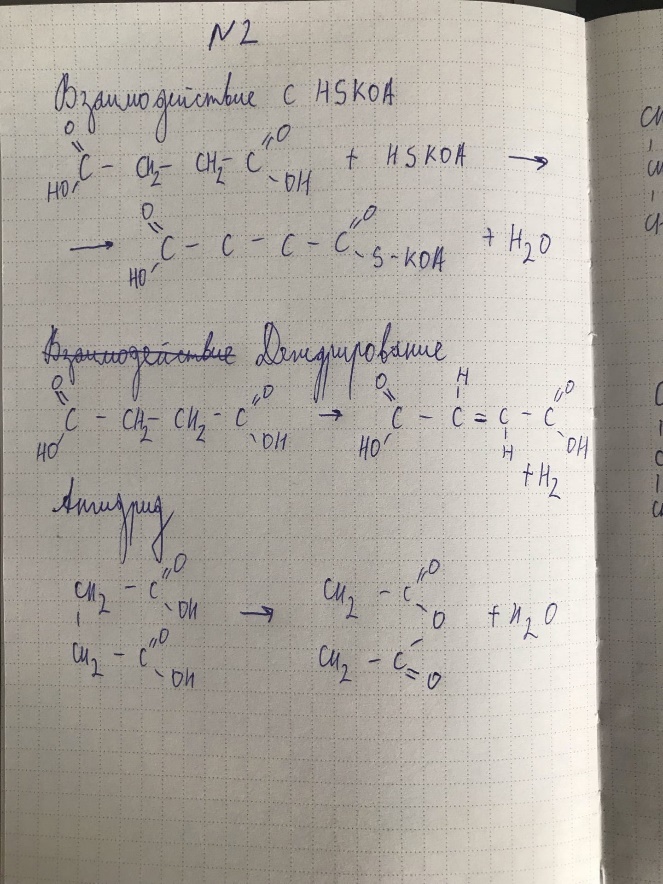

 БИЛЕТ
7, 8
БИЛЕТ
7, 8


БИЛЕТ 9

БИЛЕТ 10
CH3COOH→HCOOH→FCH2COOH→CCl3COOH

Б ИЛЕТ
11
ИЛЕТ
11

БИЛЕТ 12
1.Оптическая -характерна для соединений с двойной углерод-углеродной связью ,так как по месту такой связи молекула имеет плоскостное строение
Пример:фото
Геометрическая -в-ва ,молекулы которых имеют асимметрический или хиральный ,атом углерода ,связанный с четырьмя различными заместителями
Пример:фото
самая сильная 2,2-дибромпентановая ,т.к она содержит большее число акцепторов (-Br)
А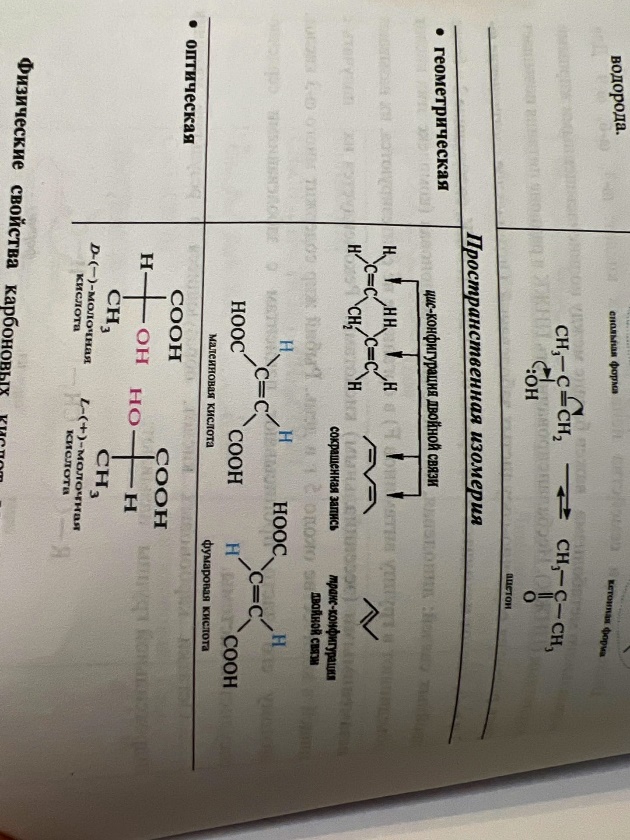 2,2-диметилпропанова слабее ,чем пентановая.
2,2-диметилпропанова слабее ,чем пентановая.

БИЛЕТ 14
1.Мезомерный эффект-это передача электронного влияния заместителей по сопряжённой системе.
Положительный мезомерный эффект(+М) проявляют заместители,содержащие атомы,с неподеленной парой электронов (-NH2>-OH>-OR>-SH>-CL>-Br>I) или отрицательным зарядом.
Отрицательный мезомерный эффект
(-М) характерен для групп:-NO2>-CN>-CHO>-COOH. Мезомерный эффект, в отличие от индуктивного, практически не затихает.
+М группы активируют бензольное кольцо и направляют заместители в орто и пара положения
-М группы снижают реакционную способность кольца и ориентируют заместители в мета положение.
Молекула молочной кислоты-С3H6O3
а ссиметрична
и поэтому может существовать в двух
оптически изомерных формах: правовращающаяся
(L-молочная) и левовращающаяся (D-молочная).
Смесь двух оптических изомеров одного
вещества в равных количествах называют
рацематом.
ссиметрична
и поэтому может существовать в двух
оптически изомерных формах: правовращающаяся
(L-молочная) и левовращающаяся (D-молочная).
Смесь двух оптических изомеров одного
вещества в равных количествах называют
рацематом.
БИЛЕТ 16
1) Оптическая активность – свойство вещества вращать плоскость поляризации луча
Хиральность – означает, что два предмета находятся по отношению друг к другу как левая и правая рука, т.е. являются зеркальными изображениями, не совпадающими друг с другом в одной плоскости при попытки их совмещать
Энантиомеры – молекулы, содержащие один асимметрический атом углерода, существующие в виде двух стереоизомеров, относящихся друг к другу как предмет к своему зеркальному изображению
Диастереомеры – стереоизомеры, не являющиеся энантиомерами, имеют одинаковую конфигурацию при одном асимметрическом атоме углерода, но разную – при другом
- кислотность (от слабого к сильному):
1. Метанол
2. Фенол
3. Угольная к-та
4. Уксусная к-та
К ислотность
органических соединений выше, когда
атом в кислотном центре более
электроотрицателен и поляризуем, а в
радикале присутствуют электроноакцепторы.
ислотность
органических соединений выше, когда
атом в кислотном центре более
электроотрицателен и поляризуем, а в
радикале присутствуют электроноакцепторы.
БИЛЕТ 17
Задание 1
Классификация:
Радикалы( OH, HOO, R, CI )
Электрофилы: Электрофилы можно подразделить на сильные и слабые: Электрофилы – это частицы, обладающие повышенным сродством к электрону или с положительно заряженным центром. ТИПЫ РЕАГЕНТОВ К ним относятся заряженные частицы (катионы) или нейтральные частицы, обладающие повышенным сродством к электрону.
Нуклеофилы:
отрицательно заряженные (HO, NH2, I, Br, Cl, H)ВСЕ ОТРИЦАТЕЛЬНЫЕ
Электронейтральные (NH3,H20,CH2=CH2, C6H6)
ПОРЯДОК ОСНОВНЫХ СВОЙСТВ:
Метиламин -> аммиак -> анилин (фениламин) –> маслянная к-та
митильная группа донор электронов, смещает эл. в сторону аминогруппы, увелич. эл. прострочит на основ. центре и сильнее притягивает протон, чем сильнее притяжение, тем сильнее основ.свойства.

 Бензольное
кольцо- акцептор (вроде!) эл., смещает их
на себя и ум. эл. плотность на осн. центре,
замедляя присоед. Протона.
Бензольное
кольцо- акцептор (вроде!) эл., смещает их
на себя и ум. эл. плотность на осн. центре,
замедляя присоед. Протона.
БИЛЕТ 18
Оптическая активность – свойство веществ вращать плоскость поляризации луча
Рацемат – смесь равных количеств энантиомеров
Хиральный центр - атом углерода в sp3 гибридизации, связанный с 4 разными заместителями
Мезоформа – стереоизомер, молекула которого имеет плоскость симмметрии и совместима со своим зеркальнм отражением.


БИЛЕТ 19
Геометрическая изомерия - это один из видов стереоизомерии, заключающийся в возможности расположения по одну или разные стороны плоскости двойной связи или неароматического цикла.
Виды геометрической изомерии:
Цис-изомерия (одинаковые атомы расположены по одну сторону от кратной связи или неароматического цикла)
Транс-изомерия (одинаковые атомы расположены по разным сторонам кратной связи или неароматического цикла)
Примеры: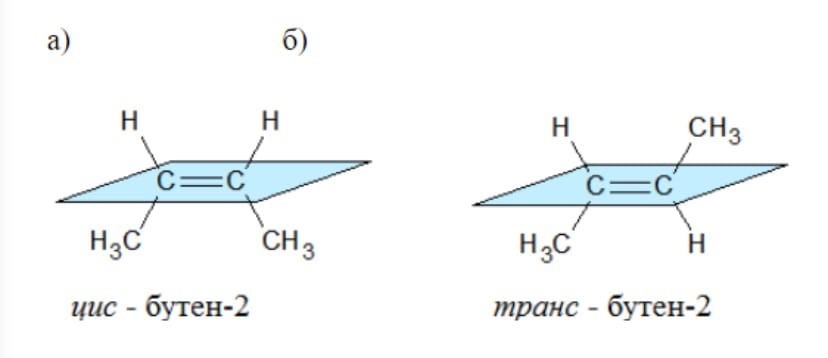


Б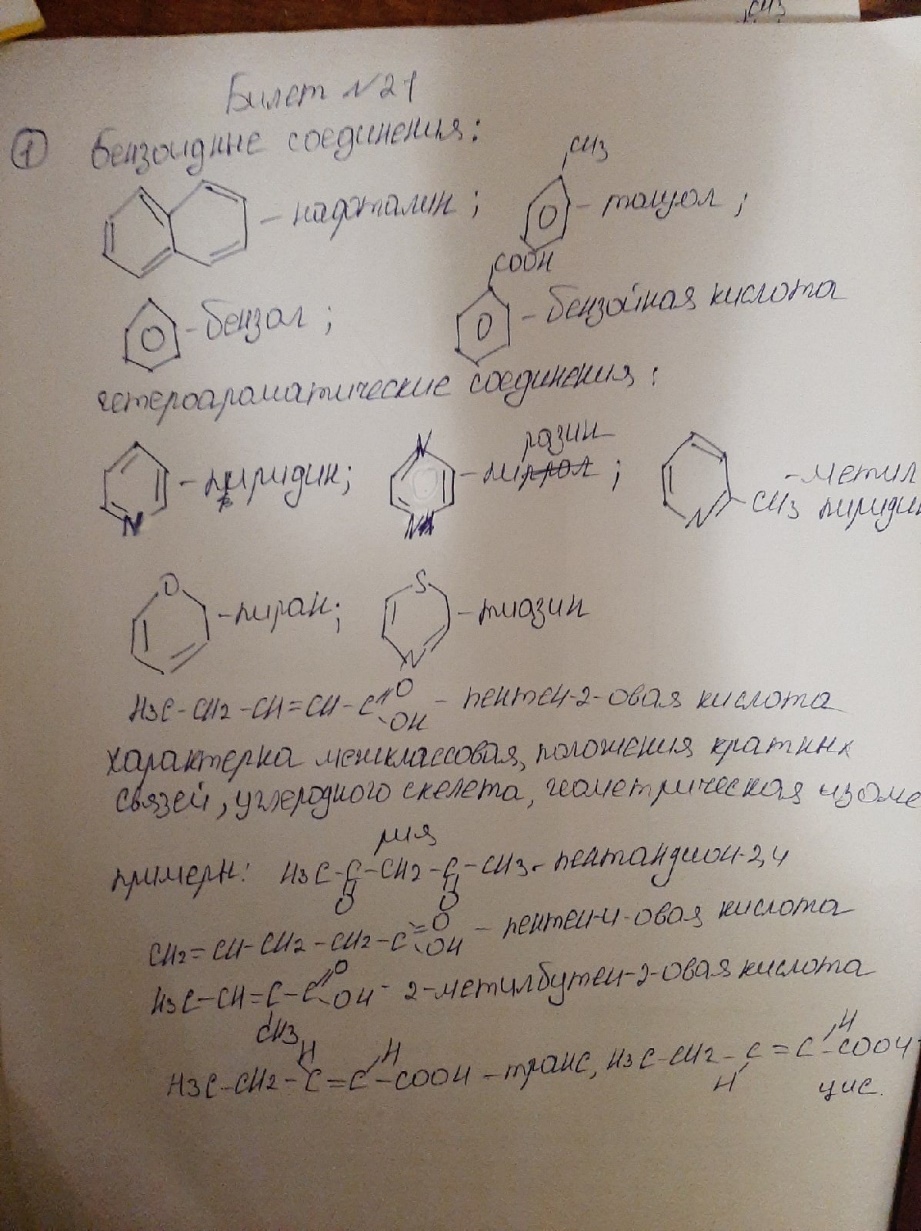 ИЛЕТ
21
ИЛЕТ
21

