
_Ma'ruza - 11'''
.doc11-MA'RUZA
MAVZU: Ideal va real gazlarning termodinamik jarayonlari
Reja:
Ideal gaz tushunchasi
Boyl-Mariot va Gey-Lyussak qonunlari
Real gaz tushunchasi
Real gaz molekulalarining o'zaro ta'sir kuchlari
Tayanch iboralar: Ideal gaz xajmi, o'zgarmas harorat, ideal gaz xolat tenglamasi, real gaz, Van-Der-Vaals tenglamasi, ichki energiya, kritik temperatura.
IDEAL GAZLAR
Bir jinsli, bir molekulali, bir xil turdagi, molekulalari oʻzaro mutlaqo taʼsirlash- maydigan gazlar ideal gazlar deb ataladi. Ideal gazlar xech qachon tabiatda uchramaydi. Ideal gazlar faqat laboratoriya sharoitlarida yaratiladi. Mendeleev jadvalida shu vaqtgacha yaratilgan ideal gazlardan 6 tasi mavjud.
1 .
Geliy-He
2.
Neon
- Ne 3.
Argon-Ar.
4.
Kripton-Kr.
5.
Ksenon-Xe.
6.
Radon-Ra.
.
Geliy-He
2.
Neon
- Ne 3.
Argon-Ar.
4.
Kripton-Kr.
5.
Ksenon-Xe.
6.
Radon-Ra.
1662 yilda R. Boyl - 1676 yilda esa undan mustaqil xolda E.Mariott o'zgarmas temperaturada gaz bosimining uning xajmiga ko'paytmasi o'zgarmas ya'ni izotermik protsessda gazning kengayishi yoki sikilishi to'g'risida tadqiqotlar olib borib, PV=const ekanligini ko'rsatgan edi. Shuning uchun ushbu qonuniyat Boyl - Mariott qonuni xam deb ataladi. Gey-Lyussak 1802 yilda agar kizdirish prosesida gaz bosimi uzgartirilmasdan saklab turilsa (ya'ni izobarik protsess amalga oshirilsa)u xolda temperaturaning ortishi bilan gaz xajmining orta borishini aniqladi. Ideal gazlarda molekulalarning o'zaro tortishish va itarish kuchlari bo'lmaydi, molekulalarning hajmi esa gazning hajmiga nisbatan juda kam. Hamma real gazlar yuqori haroratlarda va past bosimlarda "Ideal gaz" tushunchasiga mos keladi, deyarli xususiyati bilan ideal gazdan farq qolmaydi. Gey-Lyussak qonuni o'zgarmas bosimda solishtirma hajmi bilan absolyut haroratii o'zaro bog'liqligini o'rnatadi, ya'ni o'zgarmas bosimda ideal gazning bir hil hajmli miqdori absolyut haroratga nisbatan to'g'ri proporsionalda o'zgaradi.

![]()
Sharl qonuni ideal gazni solishtirma hajmi o'zgarmas bo'lganda bosmini haroratga bog'liqligini o'rnatadi, ya'ni ideal gazni solishtirma hajmini o'zgarmas xolatida, uni absolyut bosimi absolyut haroratiga to'g'ri proporg'ionalda o'zgaradi.
![]()
REAL GAZLAR
Tabiatdagi barcha gazlar real gazlar deb yuritiladi. Real-haqiqiy degan ma'noni bildiradi. Real gaz zichligi ortgan sari uning hossalari ideal gaz hossalaridan keskin farq qila boshlaydi. Real gazni soddalashtirish yo'li bilan ideal gaz deb qaralib, unda gaz molekulalarining xususiy hajmlari va molekulalarining o'zaro ta'sir kuchlari e'tiborga olinmaydi. Real gazda gaz molekulalarining xususiy hajmlari e'tiborga olinib, gaz molekulalarining xususiy hajmi egallagan idish hajmidan ancha kichikdir.
R
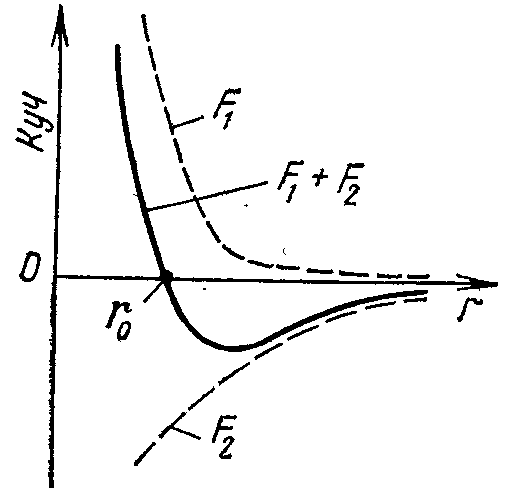 eal
gaz molekulalari o'rtasida o'zaro ta'sir kuchlari mavjud. Ikki
molekula o'rtasida o'zaro uzoklashtiradigan – F1
kuch va o'zaro tortishadigan – F2
kuch bir vaqtda ta'sir etadi. F1
kuch
musbat, F2
kuch
manfiy deb qaraladi. Bu kuchlarning qiymatlari ikki molekula
orasidagi r
masofaga bog'liq.
Biror
r=r0
masofada F1
va
F2
kuchlar
bir – birini muvozanatlab, natijaviy kuch nolga teng bo'ladi. R<r0
masofalarda
natijaviy kuch uzidan uzoklashtirish harakteriga, r>r0
da esa tortishish harakteriga ega bo'ladi.
eal
gaz molekulalari o'rtasida o'zaro ta'sir kuchlari mavjud. Ikki
molekula o'rtasida o'zaro uzoklashtiradigan – F1
kuch va o'zaro tortishadigan – F2
kuch bir vaqtda ta'sir etadi. F1
kuch
musbat, F2
kuch
manfiy deb qaraladi. Bu kuchlarning qiymatlari ikki molekula
orasidagi r
masofaga bog'liq.
Biror
r=r0
masofada F1
va
F2
kuchlar
bir – birini muvozanatlab, natijaviy kuch nolga teng bo'ladi. R<r0
masofalarda
natijaviy kuch uzidan uzoklashtirish harakteriga, r>r0
da esa tortishish harakteriga ega bo'ladi.
Mendeleev -Klapeyron tenglamasiga tegishli tuzatmalar kiritib, real gaz xolat tenglamasini hosil qilish mumkin. Bu vazifani 1873 yilda golland olimi Van-Der-Vaals bajardi. U molekulalar nng chekli o'lchamlari va molekulalar orasidagi o'zaro ta'sir kuchlarini e'tiborga olib, real gazning xolat tenglamasini quyidagicha ko'rinishda yozdi.
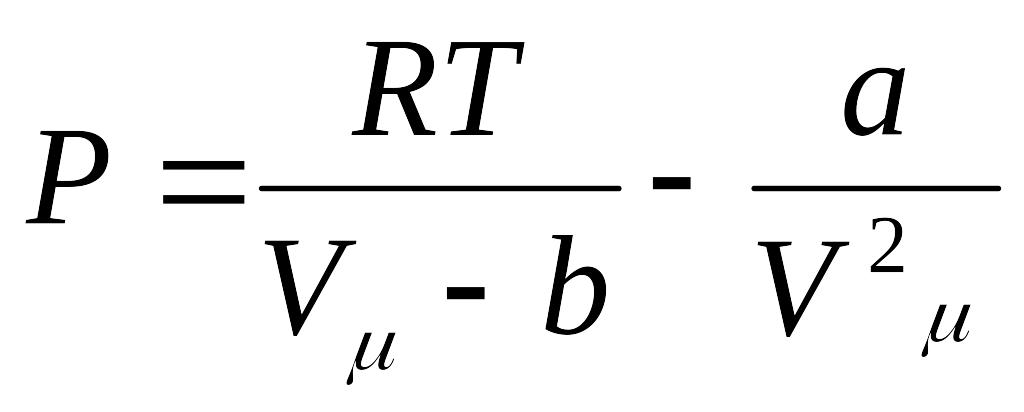 yoki
yoki
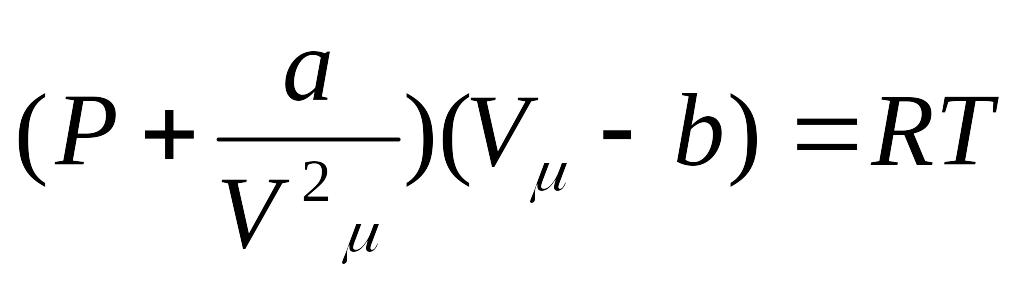
Bu ifodalar Van-Der-Vals tenglamasi deb ataladi. Bundagi a va b muayyan gaz molekulalarini harakterlovchi doimiylar bo'lib,ularni Van-Der- Vals tuzatmalari deb ham ataladi. Van-Der- Vals tenglamasi Mendeleev – Klapeyron tenglamasiga nisbatan real gaz xossalarini aniqroq aks ettiradi. Real gazning ichki energiyasini hisoblashda malekulalarning o'zaro ta'sirlashish potensial energiyasini ham e'tiborga olish kerak.
1 mol' real gazning ichki energiyasi
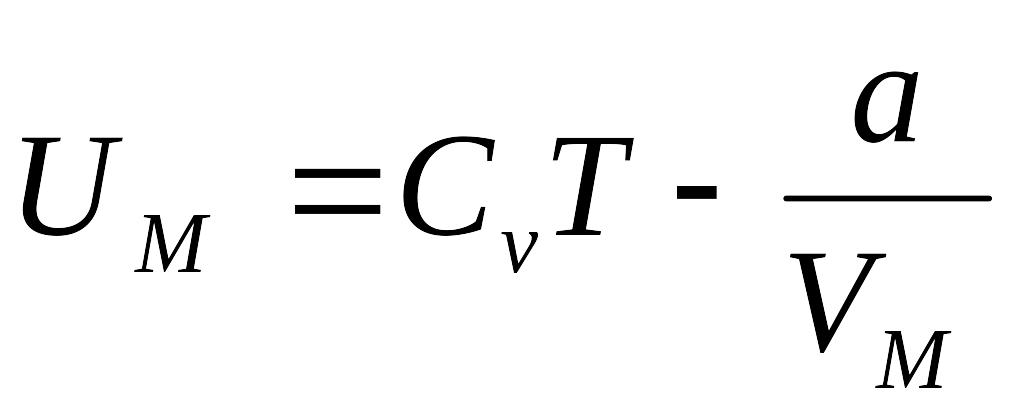 ga
teng bo'ladi
ga
teng bo'ladi
Demak real gazning ichki energiyasi, gazning tempuraturasiga va gazning hajmiga bog'liq bo'lgan jarayondir. Gazsimon moddalar siqish yoki sovutish yuli bilan kichik xajmga,yoki suyuk xolatga o'tkaziladi. Siqish jarayonida malekulalar orasidagi o'rtacha masofa kamayganligi uchun malekulalarning o'zaro ta'sirlashish potensial energiyasi ortadi. Sovitish tufayli esa malekulalar issiqlik harakatining o'rtacha kinetik energiyasi kamayadi. Kritik tempuratura (Tk) dan past tempuraturalarda to'yinish sohasi mavjud bo'ladi. Kritik tempuratura – gazni suyuqlikka aylantirishi mumkin bo'ladigan eng yuqori tempuraturadir.
Turli moddalar uchun kritik tempuratura turlicha.
SO2
( Sulfat oksid)– uchun
![]() 3040
K
3040
K
N2O(Azot oksidi) – uchun 6470K Ne(Neon) – uchun 50 K
Qisqacha xulosalar:
Boyl-Mariot va Gey-Lyussak qonunlariga to'liq bo'ysunadigan gazlar xam ideal gazlar deb ataladi.
O'zgarmas haroratda kechadigan jarayon - izotermli jarayon deb ataladi.
Van-Der-Vaals tenglamasi:
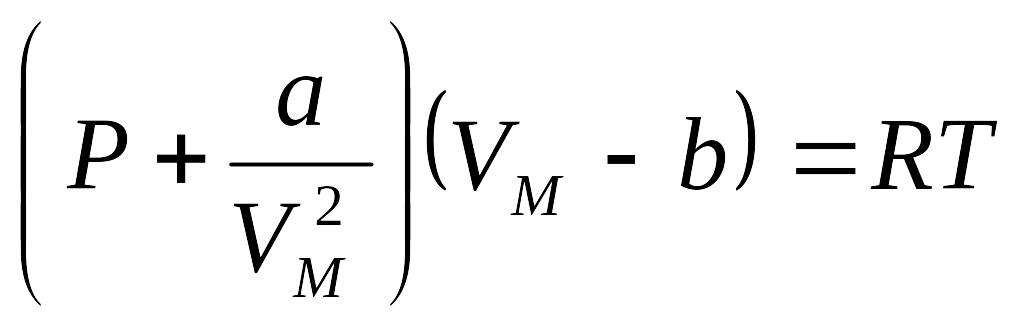
Real gazning ichki energiyasi:
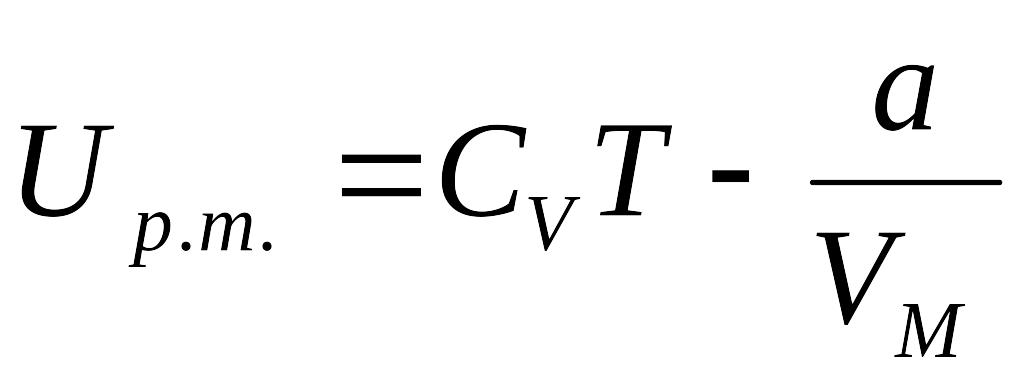
Nazorat savollari:
Ideal gaz deganda siz nimalarni tushunasiz?
Gaz doimiysi deb nimaga aytiladi?
Real gazlarda termodinamik jarayonlar nimalarga bog'liq?
Gazlarda issiqlik o'tkazuvchanlik qachon ro'y beradi?
