ВВиОР 1 курс 2 сем. лабы / химия 4
.docxМинистерство образования Республики Беларусь
Учреждение образования
«Брестский Государственный Технический Университет»
Кафедра химии
Лабораторная работа №4
«Определение содержания основных ионов в природной и сточной воде»
Выполнил:
Студент 1-го курса
Группы В-11
--------------------
Проверил(а):
----------------------
Брест 2025
Лабораторная работа №4
Тема: определение содержания основных ионов в природной и
сточной воде.
Цель: изучение качественных реакций и полуколичественное определение основных ионов в воде.
Ход работы
Опыт №1
“Качественный анализ ионов NO2- и NO3-“
О
 пределение
NO3-
пределение
NO3-
В месте соприкосновения H2SO4 с образуется бурое пятно, что свидетельствует об наличии в растворе нитратов.
2KNO3+2(NH4)2SO4·FeSO4+5H2SO4→ Fe(SO4)3+2NO2+K2SO4+2(NH4)2SO4+3H20
Сульфат
железа (III)
+ диоксид азота + сульфат калия + сульфат
аммония + вода
2Fe2+ + 2NO3- +4H+ → 2Fe3+ + 2NO2 +2H2O
Fe2+ - e-→ Fe3+ |
в-ль, ок-ся |
NO3- +2H+ + e- → NO2 +2H2O |
ок-ль, в-ся |
Определение NO2-
-

Появление синего пятна после добавления анализируемого раствора (NaNO2) – признак присутствия NO2-.
C6H10O5 + 2CH3COOH + 2KI + 2NaNO2 → C6H9O4NO2 + I2 + 2H2O + 2NaCH3COO
Нитродекстрин + йод + вода + ацетат натрия
2I- + 2NO2- + 2H+ → I2 + 2H2O
Опыт №2
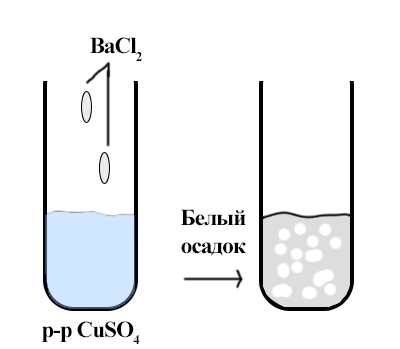
“Качественный анализ сульфат-ионов”
|
Образование осадка BaSO4 показывает наличие сульфат ионов в исследуемом растворе (CuSO4). Также происходит обесцвечивание раствора.
|
|
CuSO4 + BaCl2 → CuCl2 + BaSO4↓ |
||
|
хлорид меди(II) + сульфат бария |
|
Ba2+ + SO42- → BaSO4↓ |
||
Опыт №3
“Качественное определение хлорид-ионов”
2

1 |
CaCl2 + 2AgNO3 → 2AgCl↓ + Ca(NO3)2 2Cl- + 2Ag+ → 2AgCl↓ |
Образование осадка AgCl↓ |
2 |
AgCl↓ + 2NH3 → [Ag(NH3)2]Cl AgCl↓ + 2NH3 → [Ag(NH3)2]+ + Cl- |
Растворение осадка аммиаком |
3 |
[Ag(NH3)2]Cl + 2HNO3 → 2NH4NO3 + AgCl↓ [Ag(NH3)2]+ + Cl- + 2H+ → 2NH4+ + AgCl↓ |
Повторное образование осадка |
Продукты реакций:
AgCl – хлорид серебра
[Ag(NH3)2]Cl - хлорид диамминсеребра
2NH4NO3 - нитрат аммония
Опыт №4
“Определение содержания NH4+, K+, Na+, Fe2+, Fe3+”
Определение ионов K+ и Na+:
 Ионы
калия и натрия окрашивают пламя спиртовки
в фиолетовый и желтый цвет соответственно
Ионы
калия и натрия окрашивают пламя спиртовки
в фиолетовый и желтый цвет соответственно
Определение ионов аммония NH4+:
NH4Cl+2K2[HgI4] + 4KOH= [Hg2ONH2]I + 7KI +KCl +3H2O
NH4+ + 2[HgI4]2- + OH- → [Hg2ONH2]I↓ + I- +3H2O
Из-за концентрации ионов аммония образуется оранжевый осадок.
Продукты реакции:
[Hg2ONH2]I - йодистый меркураммоний
KI – йодид калия
KCl – хлорид калия
Определение ионов аммония Fe2+:
3FeSO4 + 2K3[Fe(CN)6] → 3K2SO4 + Fe3[Fe(CN)6]2
3Fe2+ + 2[Fe(CN)6]3- → Fe3[Fe(CN)6]2↓
Образуется темно-синий осадок
Продукты реакции:
1. K2SO4 – сульфат калия
2. Fe3[Fe(CN)6]2 - гексацианоферрат(III) железа(II)
Определение ионов аммония Fe3+:
4FeCl3 + 3K4[Fe(CN)6] → 12KCl + Fe4[Fe(CN)6]3
4Fe3+ + 3[Fe(CN)6]4- → Fe4 [Fe(CN)6] 3↓
Образуется синий осадок
Продукты реакции:
1. KCl – хлорид калия
2. Fe[Fe(CN)6] - ферроцианид железа(II)
Вывод: изучили методы качественного анализа наличия ионов в воде.